Importanza della chiralità e dell’analisi enantioselettiva:
applicazioni in campo forense
Ina Varfaj
Assegnista di Ricerca dell’Università di Perugia
e-mail: ina.varfaj@outlook.com
Indice
2. Applicazioni in ambito forense
Abstract. Chirality is defined as the property of a molecule to exist in two non-superimposable mirror images, known as enantiomers. Despite the presence of numerous physical properties in common, enantiomers exhibit divergent interactions with chiral biological systems, thereby impacting pharmacological activity and toxicity. The thalidomide case represented a significant turning point in the realm of pharmaceutical regulation, underscoring the paramount importance of enantiomeric separation for ensuring drug safety. The advent of sophisticated techniques, such as chiral HPLC in conjunction with mass spectrometry, has rendered the analysis of complex chiral samples with exceptional precision attainable. This analysis is of crucial importance not only for research and clinical practice, but also for forensic science and chemical and forensic intelligence. It allows us to distinguish between legal and illegal uses, identify routes of administration, metabolic processes and synthesis methods.
Keywords: separazione enantiomerica; indagini forensi; nuove sostanze psicoattive (NPS); chiralità
Il termine chirale deriva dalla parola greca “cheir”, che significa mano. Le molecole che si relazionano tra loro come un paio di mani sono chiamate molecole chirali. Ma come è possibile questo? Partiamo dal principio.
La chiralità può essere definita come la capacità di una molecola di presentarsi in due forme asimmetriche che sono immagini speculari non sovrapponibili l’una all’altra senza modificare la composizione atomica, le connessioni atomo-atomo o gli ordini di legame (Figura 1).
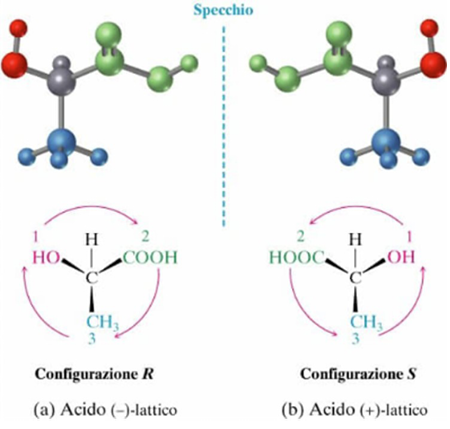
Figura 1. Modelli molecolari di due enantiomeri dell’acido lattico
Questo fenomeno si verifica generalmente a causa di una differenza nell’orientamento tridimensionale di quattro diversi sostituenti legati a un singolo atomo centrale, creando quelle che possono essere considerate versioni sinistra e destra della stessa molecola, denominate enantiomeri. Quando si tenta di sovrapporre queste versioni, ci sarà sempre almeno un sostituente attaccato all’atomo chirale che non può essere sovrapposto. Per differenziare i due enantiomeri, viene utilizzato il sistema Cahn-Ingold-Prelog, o semplicemente la notazione R/S, come raccomandato dall’Unione Internazionale di Chimica Pura e Applicata (IUPAC) e dalla notazione +/– per la rotazione ottica [1, 2] (Figura 1). Gli enantiomeri sono solitamente descritti come aventi proprietà fisiche identiche in ambienti achirali, a eccezione della rotazione della luce polarizzata piana. Infatti, la luce polarizzata piana è composta da componenti sinistrorse e destrorse della luce polarizzata circolare, che è chirale, e il fenomeno della rotazione ottica è dovuto a lievi differenze nel modo in cui le molecole chirali interagiscono con queste componenti. Quando entrambi gli enantiomeri di un composto sono presenti in concentrazioni uguali in un campione, si parla di racemato o miscela racemica. Quando si considerano molecole più complesse, la chiralità può comunque verificarsi, con sostituenti più complessi legati a un centro chirale o a più centri chirali. Queste molecole, quando non sono enantiomeri l’una dell’altra, sono denominate diastereoisomeri. Allo stesso modo, tali molecole possono avere proprietà fisiche diverse, come punti di ebollizione, punti di fusione, ecc.
Ma perché ne parliamo?
Le molecole chirali sono composti otticamente attivi che hanno suscitato grande interesse nel tempo, e il motivo è semplice: i sistemi viventi sono intrinsecamente chirali. Le proteine, gli acidi nucleici e i polisaccaridi presentano strutture tridimensionali chirali che sono strettamente legate alle loro funzioni biologiche. La chiralità non è, quindi, solo una curiosità chimica, ma un principio fondamentale dell’organizzazione della materia vivente (Figura 2).
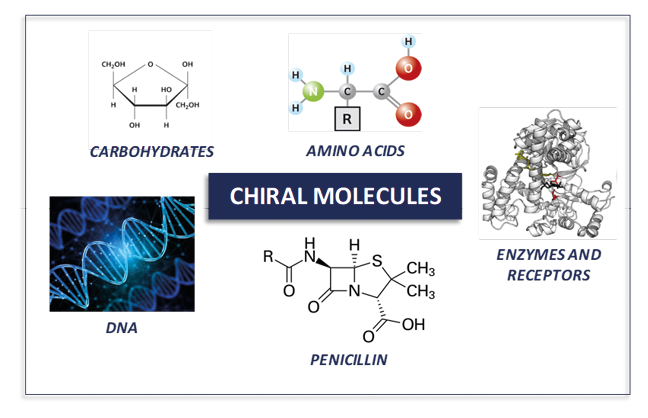
Figura 2. Esempi di dove si trovano e quali possono essere le molecole chirali
A causa della chiralità, gli organismi viventi mostrano spesso risposte biologiche differenti nei confronti dei due enantiomeri (o isomeri ottici) di una stessa sostanza, come avviene nei farmaci, nei pesticidi o nei composti di scarto. Un esempio emblematico è il L-(+)-glutammato di sodio, che ha un sapore gradevole, mentre il suo enantiomero, D-(–)-glutammato, può risultare amaro o insipido, a seconda della sensibilità individuale [3].
Sebbene gli enantiomeri condividano la stessa massa, composizione atomica, punto di fusione, punto di ebollizione e altre proprietà fisiche, differiscono per la rotazione della luce polarizzata e, soprattutto, per il modo in cui interagiscono con sistemi chirali, come gli enzimi e i recettori biologici. Proprio come un guanto sinistro non si adatta alla mano destra, anche le molecole chirali possono dare luogo a fenomeni di stereoselettività nelle reazioni chimiche e nelle interazioni biologiche. Nonostante dal punto di vista fisico e chimico gli enantiomeri possano comportarsi in modo essenzialmente identico, in un ambiente chirale (come i costituenti biomolecolari di un organismo vivente) i risultati della loro reattività possono essere notevolmente diversi.
Addentrandoci nell’ambito farmaceutico, diventa evidente come la determinazione della composizione stereoisomerica di un composto chimico sia di importanza cruciale e non possa essere sottovalutata [4]. Un esempio tristemente noto è quello della talidomide [5, 6], uno dei farmaci più famigerati nella storia della medicina. Negli anni Cinquanta del secolo scorso, la talidomide fu commercializzata come sedativo e come trattamento per le nausee gravidiche, ma portò a una catastrofe sanitaria mondiale, causando malformazioni congenite in migliaia di neonati. La molecola presenta due enantiomeri, uno dei quali ha effetti terapeutici, mentre l’altro è teratogeno, ossia in grado di provocare gravi danni allo sviluppo fetale (Figura 3).
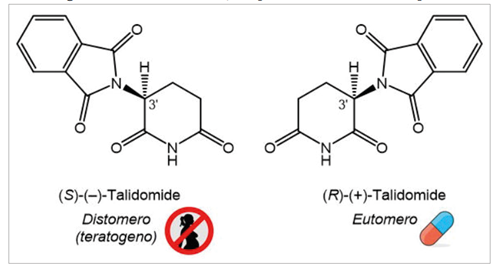
Figura 3. Struttura della talidomide
Circa vent’anni dopo la tragedia della talidomide, Blaschke e collaboratori scoprirono che solo l’enantiomero (S)-(–) della molecola era responsabile dell’attività teratogena osservata negli animali da laboratorio (topi e ratti) [7]. Oggi è ampiamente riconosciuto che isomeri differenti di una stessa molecola, siano essi enantiomeri o diastereomeri, possono presentare attività biologiche e farmacologiche profondamente diverse [8], dovuta al fatto che i due enantiomeri interagiscono in modo differenziale con i componenti chirali degli organismi viventi, come recettori, enzimi, proteine di trasporto, membrane cellulari, ecc.
Il caso della talidomide ha avuto un impatto profondo sulla regolamentazione farmaceutica, segnando l’inizio di una nuova era in cui la valutazione della chiralità e della stereoisomeria è diventata un requisito fondamentale nello sviluppo di nuovi farmaci.
Questo è solo uno dei tanti esempi che dimostrano quanto sia cruciale studiare a fondo le differenze nelle proprietà farmacologiche e tossicologiche dei singoli enantiomeri all’interno dei farmaci racemici. Purtroppo, in numerose situazioni queste differenze non sono ancora state sufficientemente investigate, verosimilmente a causa delle difficoltà tecniche nel separare o sintetizzare i singoli enantiomeri in forma otticamente pura.
Per garantire la sicurezza e l’efficacia sia dei farmaci attualmente in uso sia di quelli in fase di sviluppo, è fondamentale determinare con precisione la composizione stereochimica delle sostanze attive. Ciò implica l’isolamento e l’analisi separata di ciascun enantiomero, al fine di comprenderne in modo esaustivo il profilo farmacologico, farmacocinetico e tossicologico.
A questo punto, sorge spontanea una domanda… come si può fare questo?
La risoluzione cinetica e termodinamica, così come le moderne tecniche cromatografiche chirali, rappresentano strumenti fondamentali per la separazione degli enantiomeri. Uno dei metodi più tradizionali per ottenere isomeri otticamente puri è la risoluzione ottica dei racemati, un processo noto fin dal 1848, quando Louis Pasteur riportò il primo esempio di separazione di cristalli enantiomerici. Da allora, sono stati risolte le strutture di oltre 7.000 composti chirali, principalmente attraverso la cristallizzazione frazionata di sali diastereomerici [8].
Tuttavia, le tecniche classiche mostrano limiti significativi in termini di efficienza, versatilità e applicabilità su larga scala. Al contrario, i metodi cromatografici chirali sono oggi considerati i più efficaci e affidabili per la risoluzione ottica e la separazione degli enantiomeri. Essi offrono notevoli vantaggi in termini di rapidità, selettività, sensibilità e riproducibilità, specialmente nella separazione degli enantiomeri, che rappresentano la classe stereoisomerica più complessa da distinguere.
Negli ultimi anni, i progressi nella progettazione di fasi stazionarie chirali e lo sviluppo di nuove condizioni operative hanno reso possibile la risoluzione cromatografica di un numero crescente di composti chirali. Tra le tecniche disponibili, la più utilizzata è senza dubbio la cromatografia liquida ad alte prestazioni (HPLC). L’HPLC rappresenta uno strumento analitico di primaria importanza, utilizzato per separare, identificare e quantificare i componenti di una miscela chirale.
Il principio alla base dell’HPLC si fonda sulla cromatografia, ovvero sulla separazione dei composti in base alle loro differenti interazioni con una fase stazionaria e una fase mobile. Quando i due enantiomeri vengono efficacemente separati, il risultato è un cromatogramma in cui ciascun picco rappresenta uno dei due isomeri ottici (Figura 4).
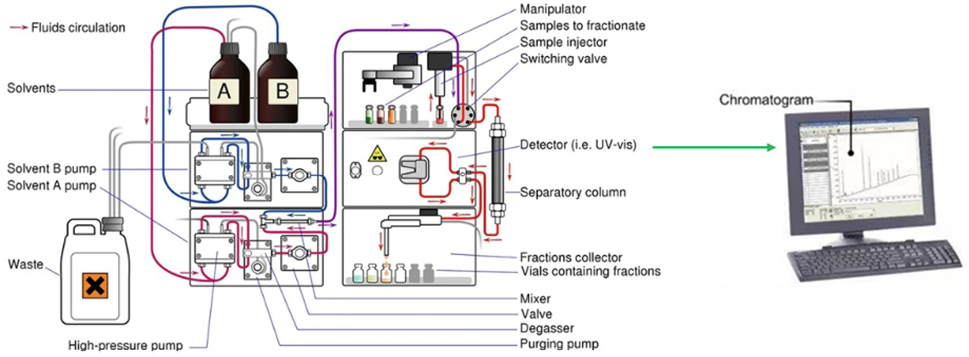
Figura 4. Schema dettagliato strumento HPLC ed esempio di cromatogramma
Inoltre, sistemi di cromatografia liquida preparativa su larga scala sono già stati immessi sul mercato come unità di processo per la separazione e la purificazione di sostanze chimiche e prodotti naturali. La possibilità di produrre enantiomeri in forma otticamente pura su scala industriale rende l’HPLC chirale uno strumento ideale sia in ambito di ricerca che produttivo.
Un ulteriore passo avanti è rappresentato dall’accoppiamento dell’HPLC (o U(H)PLC) con la spettrometria di massa (MS). L’integrazione con un rilevatore UV e successivamente con un sistema LC-UV-MS ha portato a una potente sinergia analitica, oggi largamente utilizzata anche nel campo della chiralità. Questo approccio fornisce dati ricchi e complementari, aumentando in modo significativo la sensibilità, la specificità e l’efficienza analitica.
La spettrometria di massa, in particolare, ha raggiunto una notevole maturità tecnologica, diventando uno strumento di routine affidabile. In combinazione con l’HPLC, consente la caratterizzazione qualitativa e quantitativa di molecole in concentrazioni estremamente basse (fino al range femtomolare o attomolare), rendendola uno strumento chiave per l’analisi di xenobiotici, metaboliti endogeni e sostanze traccianti.
Di conseguenza, questi sistemi sono oggi impiegati su vasta scala non solo nell’industria farmaceutica e nei centri di ricerca, ma anche nei laboratori clinici e forensi. Ed è proprio in quest’ultimo contesto, quello delle applicazioni forensi e di intelligence, che il binomio chiralità–HPLC si rivela di importanza strategica, permettendo di identificare con precisione la firma stereochimica di sostanze potenzialmente implicate in crimini, doping, o traffici illeciti.
2. Applicazioni in ambito forense
2.1 Analisi stereoselettiva di campioni di sostanze/droghe d’abuso provenienti da sequestri
Un esempio particolarmente significativo dell’importanza dell’analisi enantiomerica in ambito forense è rappresentato da uno studio condotto da un gruppo di ricercatori tedeschi, i quali hanno analizzato la composizione enantiomerica di anfetamina, metanfetamina e MDMA in campioni di droghe d’abuso sequestrati nel sud della Germania [9]. Le sostanze psicoattive d’abuso possono essere sintetizzate attraverso vie diverse, che variano soprattutto in base ai precursori chimici disponibili. Di conseguenza, anche la composizione enantiomerica del prodotto finale può differire in base alla sintesi adottata. È noto, infatti, che persino all’interno dello stesso laboratorio clandestino si possano impiegare precursori differenti, in base alla disponibilità sul mercato nero. In questo contesto, l’applicazione di metodi di analisi stereoselettiva ai campioni sequestrati si rivela cruciale non solo per scopi investigativi, ma anche dal punto di vista giuridico e normativo. In Germania, ad esempio, il German Narcotics Act riconosce esplicitamente la differenza di attività farmacologica tra gli enantiomeri, attribuendo una maggiore potenza psicostimolante agli enantiomeri S di anfetamina, metanfetamina e MDMA. Proprio sulla base di tali differenze, le autorità giudiziarie possono modulare la gravità delle accuse: per dosi ritenute significative di droga (non-small amount), è prevista una soglia di tolleranza per gli enantiomeri R che può essere il doppio (per l’anfetamina) o addirittura dieci volte superiore (per la metanfetamina) rispetto a quella prevista per gli enantiomeri S [10].
Uno studio particolarmente interessante condotto da Losacker e collaboratori ha valutato la composizione enantiomerica di anfetamina, metanfetamina e MDMA in campioni di droghe sequestrate nel sud della Germania [9]. Per quanto riguarda l’anfetamina, l’analisi enantioselettiva è stata eseguita su 143 campioni (quasi tutti in forma di polvere, a eccezione di quattro campioni liquidi). Per l’MDMA, sono stati analizzati 94 campioni, di cui 63 in forma di compresse policrome, 30 in cristalli e 1 in polvere. In alcuni campioni di anfetamina sono state rilevate tracce di MDMA racemica, mentre in un campione di MDMA è stata individuata anfetamina racemica. Queste contaminazioni crociate sono comuni nei laboratori clandestini, dove spesso vengono sintetizzati più composti chimicamente affini in ambienti non separati né controllati.
Il caso della metanfetamina è ancora più significativo: sono stati analizzati 528 campioni, tutti provenienti da sequestri. L’analisi cromatografica ha mostrato che la sintesi era di tipo esclusivamente chimico, probabilmente eseguita in laboratori clandestini nei Paesi Bassi, dove si impiegano precursori non di tipo farmaceutico. Circa il 95% dei campioni in cristalli conteneva soltanto l’enantiomero S, mentre 10 campioni mostravano 2 casi con eccesso dell’enantiomero R e 8 con prevalenza dell’enantiomero S. Questi risultati suggeriscono che i cristalli di metanfetamina sequestrati potessero derivare da più rotte di traffico (differenti laboratori clandestini, con diversi protocolli di sintesi), oppure che, all’interno dello stesso laboratorio, si fossero impiegati precursori differenti, in base alla disponibilità contingente sul mercato nero. Storicamente, gran parte della metanfetamina prodotta in Europa proveniva dalla Repubblica Ceca, dove era ottenuta mediante un protocollo di sintesi stereoselettiva a partire da (1S,2S)-pseudoefedrina e, meno frequentemente, da (1R,2S)-efedrina. Tale sintesi porta selettivamente alla formazione dell’enantiomero S, noto per la sua elevata attività psicostimolante rispetto al suo speculare R.
Tra i metodi sintetici alternativi più noti, vi è il cosiddetto “metodo Nazi”, che consente l’ottenimento di metanfetamina enantiomericamente pura nella configurazione S a partire da pseudoefedrina o efedrina, principi attivi comuni in alcuni farmaci da banco per il raffreddore. Numerosi report delle forze dell’ordine descrivono, infatti, il ritrovamento nei laboratori clandestini di questi farmaci, dopo segnalazioni da parte di farmacisti insospettiti dal loro acquisto frequente e ripetuto da parte di soggetti sospetti. Analogamente, segnalazioni di acquisti anomali online di ammoniaca – reagente utilizzato nel metodo Nazi – hanno spesso anticipato indagini e sequestri.
Proprio per contrastare la produzione illegale di metanfetamina, sono state introdotte restrizioni internazionali alla vendita di specifici precursori chimici. Questa evoluzione normativa ha costretto i produttori clandestini a modificare i metodi di sintesi, spesso abbandonando le vie stereoselettive. In tal senso, la metanfetamina spacciata in Germania e prodotta nei laboratori olandesi viene oggi frequentemente ottenuta a partire da 1-fenil-2-propanone (P2P), secondo un protocollo che genera una miscela racemica. Solo in una fase successiva, al fine di arricchire il prodotto nell’enantiomero S, si ricorre a risoluzione chirale per formazione di sali diastereoisomerici mediante acido tartarico: il cosiddetto metodo Pope–Peachey. La frazione ricca dell’enantiomero R può inoltre essere sottoposta a cicli ripetuti di racemizzazione e risoluzione, fino a massimizzare il contenuto dell’enantiomero desiderato. Questo tipo di lavorazione può spiegare la variabilità nella composizione enantiomerica osservata in alcuni campioni analizzati nello studio. Non a caso, in Olanda sono state sequestrate ingenti quantità di acido tartarico, presumibilmente destinate all’uso in questo protocollo di purificazione.
2.2 Nuove sostanze psicoattive
Gran parte della letteratura scientifica e delle attività analitiche è stata finora rivolta alle anfetamine e ai loro derivati, mentre scarse sono le informazioni disponibili per quanto riguarda le altre classi di droghe illegali, in particolare per le cosiddette Nuove Sostanze Psicoattive (NPS). Il numero di NPS segnalate sul mercato illecito è in costante aumento. Ve l’ho ricordate “Smetto quando voglio”?
Ecco, similmente alle sostanze che si cercano nel film, le NPS sono generalmente prodotte illegalmente in paesi dell’Europa orientale o dell’Asia e commercializzate attraverso canali online, spesso mascherate da prodotti legali come “sostanze chimiche per la ricerca”, “sali da bagno”, “fertilizzanti per piante”, o accompagnate dall’etichetta “non destinati al consumo umano”. Tale strategia di etichettatura ha l’obiettivo di eludere la normativa vigente e proteggere i distributori da responsabilità penali [11].
Queste sostanze sono costantemente monitorate e documentate dal Sistema di Allerta Precoce (EWS) dell’Unione Europea. Le NPS comprendono diverse classi chimiche, tra cui catinoni, cannabinoidi, fenetilamine, triptamine, piperazine, arilamine e derivati del fentanil [11]. Ad oggi, l’analisi enantioselettiva delle NPS è stata ottenuta con vari metodi cromatografici ed elettroforetici, ad esempio HPLC [12], GC [13] e CE [14]. Nonostante la disponibilità di molteplici fasi stazionarie chirali (CSP, Chiral Stationary Phases), lo sviluppo di metodi di separazione enantioselettiva rimane una sfida analitica significativa. Infatti, la selezione di una CSP adatta alla separazione di una determinata molecola chirale non è facilmente prevedibile e il processo di ottimizzazione delle condizioni di separazione (fase mobile, pH, modificatori) risulta spesso oneroso in termini di tempo, risorse e costi. In risposta a tali difficoltà e alla necessità crescente di analizzare un’ampia gamma di sostanze eterogenee in termini chimici, negli ultimi dieci anni sono stati sviluppati numerosi metodi cromatografici ed elettroforetici applicati all’analisi delle NPS, sia in matrici biologiche e ambientali, sia in campioni provenienti da sequestri [15].
Anche il nostro gruppo di ricerca, in collaborazione con il team della prof.ssa Laura Mercolini (Università di Bologna), ha dato un contributo significativo in questo ambito, sviluppando metodi basati sulla cromatografia liquida (LC) per l’analisi enantioselettiva di derivati illeciti del fentanil [16], delle feniletilamine benzofuran-sostituite, delle triptamine sostituite e dei catinoni sostituiti [17] e di cannabinoidi sintetici [18]. Nell’ambito dei nostri studi, abbiamo dimostrato l’applicabilità dei metodi sviluppati per le indagini bioanalitiche supportate da piattaforme di spettrometria di massa, così da poter essere applicate anche in ambito forense e di intelligence per indagini future. I campioni analizzati provenivano tutti da sequestri.
Una particolare attenzione è stata dedicata all’analisi dei cannabinoidi sintetici, noti anche come SCRA (Synthetic Cannabinoid Receptor Agonists), che rappresentano uno dei gruppi più numerosi e monitorati tra le NPS a livello internazionale [19]. In particolare, gli SCRA della classe delle carbossamidi sono riconosciuti come il sottogruppo più diffuso e potente di questa famiglia chimica [19]. Attualmente, centinaia di SCRA sono commercializzate illegalmente e associate, su scala globale, a numerosi episodi di intossicazione, sia mortale che non mortale. L’elevata variabilità nella composizione e nella concentrazione dei prodotti finali venduti clandestinamente rende estremamente difficile per l’utente dosare correttamente la sostanza assunta, con conseguente insorgenza di effetti imprevedibili. Tali composti vengono consumati a scopo ricreativo come sostituti della cannabis naturale, sebbene sia ben noto che gli effetti collaterali associati agli SCRA siano molto più gravi rispetto a quelli causati dal Δ⁹-tetraidrocannabinolo (THC), il principale principio attivo della marijuana. Dal punto di vista farmacodinamico, gli SCRA presentano affinità e potenza di legame ai recettori cannabinoidi (CB₁ e CB₂) nettamente superiori rispetto al THC. Tuttavia, le informazioni attualmente disponibili sull’attività enantiospecifica di questi composti sono ancora limitate e non è stato chiarito quali enantiomeri siano responsabili degli effetti psicoattivi maggiormente ricercati dai consumatori [19]. Nel nostro studio, abbiamo indagato sei cannabinoidi sintetici appartenenti alla classe delle indazolo-3-carbossamidi, suddivisi in tre sottogruppi strutturali: a base di valinamide indazolo-3-carbossamide, a base di tert-leucinamide indazolo-3-carbossamide e due derivati a base di fenilalaninamide indazolo-3-carbossamide. Di conseguenza, è stata riscontrata una predominanza degli enantiomeri (S) in tre dei cinque campioni analizzati, in accordo con le prove più diffuse, mentre al contrario, due campioni sono risultati contenere gli enantiomeri puri (R). La presenza selettiva di questi enantiomeri meno attesi può essere attribuita a diversi fattori, tra cui la possibile indisponibilità sul mercato dei precursori per la sintesi dell’enantiomero (S), che può spingere i produttori clandestini a ricorrere a vie sintetiche alternative, analogamente a quanto già osservato per le anfetamine. Altresì, la carenza di dati relativi all’attività stereoselettiva specifica per questi composti, nuovi sul mercato illegale, non consente di escludere un eventuale effetto psicoattivo potenziato dell’enantiomero (R) (Figura 5).
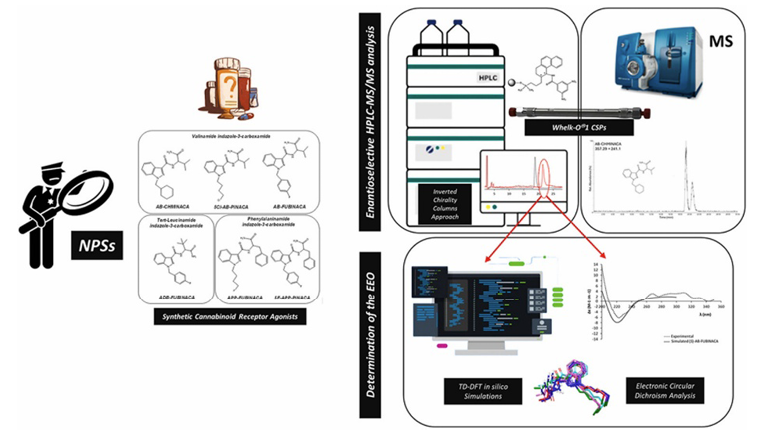
Figura 5. Graphical abstract del riferimento [18]
Tutti gli studi presentati sottolineano l’importanza di considerare la stereochimica, in generale, e la chiralità, in particolare, in ogni ambito della nostra vita. La determinazione della composizione enantiomerica di una sostanza non rappresenta solo un requisito fondamentale per garantire sicurezza, efficacia e qualità in ambito farmaceutico, ma costituisce anche uno strumento strategico nei settori clinico, forense e di intelligence chimica.
Conoscere il profilo enantiomerico di un composto permette infatti di: (i) distinguere tra uso lecito e illecito di uno specifico principio attivo o sostanza; (ii) comprendere se la specie chimica rilevata sia stata assunta direttamente oppure sia il prodotto di un processo metabolico di altre molecole; (iii) risalire alla via di somministrazione impiegata; (iv) determinare il metodo di sintesi utilizzato per ottenere la sostanza, informazione che può rivelarsi cruciale per mappare le rotte e le tecnologie del narcotraffico; (v) monitorare in modo mirato eventuali cambiamenti nei canali di produzione e approvvigionamento delle sostanze d’abuso, con importanti ricadute nella lotta al crimine organizzato e al traffico di stupefacenti. Pertanto, l’analisi enantioselettiva, grazie all’evoluzione di tecniche come l’HPLC chirale e la spettrometria di massa, non solo arricchisce il bagaglio scientifico legato alla chiralità, ma si impone oggi come un’arma analitica cruciale in contesti multidisciplinari dove chimica, medicina, sicurezza e giustizia si incontrano.
Non possiamo non esserne pienamente affascinati, sotto ogni punto di vista e ad ogni livello.
Ed è per questo che la storia non finisce qui …
[1] M. Nic, J. Jirat, B Kosata, IUPAC Gold Book Compendium of chemical terminology. [2005-2025] (http://goldbook.iupac.org).
[2] J. Caldwell, I. W. Wainer, Hum. Psvchopharmacol., 2001, 16, SI05-S107.
[3] K. Hamase, A. Satinder, Anal. Bioanal. Chem., 2011, 401, 1723-1724.
[4] K. Williams, E. Lee, Drugs, 1985, 30, 333-54.
[5] D. M. Burley, W. Lenz, Lancet, 1962, 279, 271-272.
[6] G. E. Diggle, Int. J. Clin. Pract., 2001, 55, 627-631.
[7] G. Blaschke, H. P. Kraft, K. Fickentscher, F. Kohler, Arzneim. Forsch., 1979, 29, 1640-1642.
[8] S. Ahuja, Chiral Separation: applications and technology, Washington DC, 1997.
[9] M. Losacker, S. Zörntlein, B. Schwarze, S. Staudt, J. Röhrich, C. Hess, Drug Test. Anal., 2022, 14, 557-566.
[10] W. R. Bork, R. Dahlenbur, M. Gimbel, A. Jacobsen-Bauer, H. Mahler, S. Zörntlein, Toxichem. Krimtech., 2019, 86, 1-87.
[11] A. Shafi, A. J. Berry, H. Sumnall, D. M. Wood, K. Tracy, Ther. Adv. Psychopharmacol., 2020, 17, 2045125320967197.
[12] M. Taschwer, Y. Seidl, S. Mohr, M. G. Schmid, Chirality, 2014, 26, 411-418.
[13] J. A. Weiß, S. Mohr, M. G. Schmid, Chirality, 2015, 27, 211-215.
[14] J. S. Hägele, E. M. Hubner, M. G. Schmid, Chirality, 2020, 32, 1191-1207.
[15] M. G. Schmid, J. S. Hägele, J. Chromatogr. A, 2020, 1624, 461256.
[16] I. Varfaj, M. Protti, M. Cincirrone, A. Carotti, L. Mercolini, R. Sardella, J. Chromatogr. A, 2021, 1643, 462088.
[17] M. Protti, I. Varfaj, A. Carotti, D. Tedesco, M. Bartolini, A. Favilli, S. Gerli, L. Mercolini, R. Sardella, Talanta, 2023, 257, 124332.
[18] I. Varfaj, M. Protti, A. Di Michele, J. Gonzalez-Rodriguez, A. Carotti, R. Sardella, L. Mercolini, Anal. Chim. Acta, 2024, 1317, 342901.
[19] S. D. Banister, M. Connor, Handbook Exp. Pharmacol., 2018, 252, 165-190.