Un approccio sperimentale induttivo alla regola di Bredt e alle molecole anti-Bredt
Pasquale Fetto e Roberto Soldà
e-mail: pasquale.fetto@didichim.org; roberto.solda@libero.it
Indice
Abstract. Currently, even at a popular science level, the news of a recent and very important discovery has caused quite a stir, concerning the possibility of making stable some so-called anti-Bredt organic molecules; they were previously considered unstable, as a consequence of a rule that has been in force in organic chemistry since 1924. In this article, an inductive experimental approach to this rule is proposed, at the level of basic chemistry, with the main objective of deepening it, providing students with cultural information not limited exclusively to media communication.
Keywords: chimica organica; regola di Bredt; molecole anti-Bredt
È noto a ogni docente che un argomento da trattare diventa più stimolante per l’apprendimento da parte degli allievi se tale argomento può essere connesso all’attualità.
Ebbene questo è il caso delle molecole anti-Bredt [1] che è collegabile agli idrocarburi ciclici introdotti trattando gli idrocarburi, a livello di chimica di base, nel corso di elementi di chimica organica di ogni scuola secondaria di secondo grado.1
A tale proposito, in connessione con l’itinerario didattico proposto, in questo contributo sembra utile fornire alcuni cenni storici e alcune considerazioni.
Fino all’anno scorso il chimico tedesco Julius Bredt era citato solo per la sua regola empirica del 1924, riportata in alcuni testi di chimica organica per l’università [2-6].
La regola, discussa per la prima volta nel 1902 e, infine, codificata nel 1924, stabilisce che negli idrocarburi biciclici e policiclici in generale, ossia negli idrocarburi nella cui struttura sono presenti almeno due anelli che condividono due atomi di carbonio posti in una posizione detta “a testa di ponte”, la tensione angolare implica che non possa essere presente un doppio legame su nessuno dei due atomi a testa di ponte, a meno che l’anello principale non sia sufficientemente grande.
Ad esempio, questo è il caso delle due molecole riportate nella figura 1, che fanno eccezione alla regola di Bredt, e che sono dette, per tale motivo, molecole anti-Bredt.

Figura 1. Formule di struttura di due molecole anti-Bredt
La regola di Bredt è valida quando:
• i due atomi di carbonio del doppio legame e i quattro atomi ad essi legati non si trovano tutti sullo stesso piano, cioè non soddisfano la condizione di complanarità (secondo il modello VSEPR);
• la sovrapposizione degli orbitali p degli atomi di carbonio ibridati sp2 coinvolti nel legame risulta troppo piccola per garantire un legame stabile (secondo il modello orbitalico).
Ma, oltre alla sua regola, Bredt è stato il chimico che nel 1893 riuscì a determinare, per primo, la formula di struttura della canfora riportata in figura 2, che impegnò lo sforzo notevole di molti chimici nella seconda metà dell’Ottocento (fra i quali anche Kekulè), quando ancora pochi erano i mezzi strumentali disponibili per la ricerca scientifica.
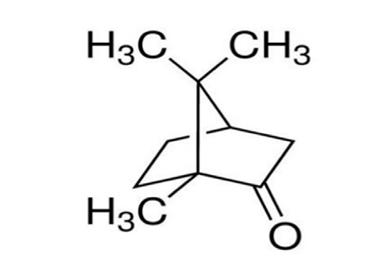
Figura 2. Formula di struttura della canfora
È interessante notare che proprio la determinazione della struttura della canfora e le numerose osservazioni sperimentali a essa collegate hanno condotto Bredt alla regola suddetta [7].
Inoltre, riteniamo importante sottolineare che tale regola rimane ancora valida per prevedere l’esistenza e/o la stabilità di alcune molecole (ad esempio, il 2-norbornene) e anche l’esito di alcune reazioni di chimica organica e chiarirne i loro meccanismi come, ad esempio, quello della reazione di eliminazione del 2-bromonorbornano, della reazione della disidratazione con H2SO4 dell’endoborneolo e di altre reazioni [3-6].
In questo contributo l’approccio sperimentale induttivo alla regola di Bredt è proposto mediante un itinerario che sfrutta, come detto nella premessa, il fatto che tale regola è “nata” nel corso della ricerca sperimentale che Bredt dovette organizzare per determinare la formula di struttura della canfora.
Per realizzare le attività di pre-laboratorio e laboratorio sono necessari reattivi e strumenti facilmente disponibili o reperibili nelle scuole con laboratorio chimico, anche non particolarmente attrezzato e tenendo in particolare considerazione le vigenti norme di sicurezza chimica.
2.1 Attività di pre-laboratorio
Prerequisiti
• Conoscenze di chimica generale a livello di chimica di base
• Modello VSEPR e il suo uso per risalire alla geometria spaziale delle molecole organiche
• Utilizzo di modelli molecolari o saperli costruire utilizzando eventualmente palline di polistirolo e stuzzicadenti
• Conoscenze elementari di chimica organica come da indicazioni curricolari per il corso di chimica di base
Nella discussione preliminare è necessario accertarsi che gli allievi abbiano ben compreso il modello VSEPR (eventualmente richiamandolo) e la sua applicazione per la geometria tridimensionale delle molecole.
In particolare, i ragazzi devono sapere che negli alcheni i due atomi di carbonio del doppio legame e i quattro atomi ad essi legati si trovano tutti sullo stesso piano, cioè soddisfano la condizione di complanarità.
Utilizzo di “domande legittime” [8]
Nel 1924 il chimico tedesco J. Bredt, avvalendosi delle sue osservazioni relative alla ricerca per la determinazione della formula di struttura della canfora, formulò l’ipotesi che la grande tensione vietasse l’esistenza di alcuni bicicloalcheni come, ad esempio, quelli ipotizzabili per il norbornene e riportati in figura 3, con un doppio legame posto in posizioni particolari (B, C).
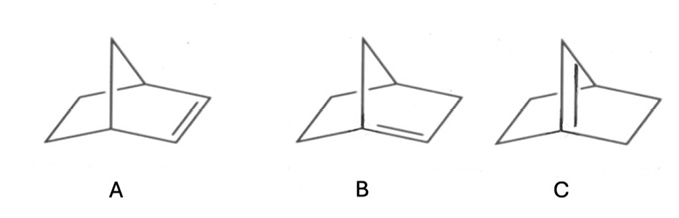
Figura 3. Formule di struttura di isomeri del norbornene
Agli studenti vengono poste le seguenti domande.
• In che modo avete “concretizzato” visivamente le geometrie molecolari dei tre isomeri del norbornene e quali conoscenze di chimica organica avete utilizzato per poter spiegare l’ipotesi di Bredt?
• Quale formula di struttura, fra quelle riportate in figura 3, si deve assegnare al norbornene esistente in realtà?
• Come avete determinato le somiglianze e le differenze fra la molecola della canfora e quella del norbornene?
• A quali classi di composti organici esse appartengono?
In questo modo gli allievi, utilizzando la loro capacità di costruzione di modelli molecolari e le loro conoscenze elementari di chimica, giungono abbastanza facilmente a comprendere la regola di Bredt e che i carboni testa di ponte non possono essere impegnati in doppi legami a causa del divieto imposto dalla condizione di complanarità.
Inoltre, semplicemente confrontando le formule di struttura della canfora e del norbornene, riescono a definire le somiglianze e le differenze di tali molecole e le classi di composti organici a cui esse appartengono.
2.2 Attività di laboratorio
Prequisiti
• Conoscenze elementari di chimica generale e chimica organica
• Sapere utilizzare materiali e reattivi rispettando le norme di sicurezza
Esperienze
In collegamento con l’argomento relativo ai composti organici policiclici (cicloalcani e cicloalcheni) introdotto soltanto teoricamente, si può evidenziare l’importanza dei composti policiclici e in particolare che molte sostanze naturali e sintetiche hanno strutture ad anelli condensati come appunto la canfora (nota perché una volta veniva usata come sostanza antitarme) e il norbornene, oggetto di approfondimento nelle attività di pre-laboratorio.
Facendo riferimento specificatamente alla struttura della canfora, si possono proporre due saggi che, pur usando reattivi e materiali facilmente disponibili, presentano problemi di sicurezza e, pertanto, è consigliabile che vengano effettuati sotto cappa dall’insegnante o dall’aiutante tecnico.
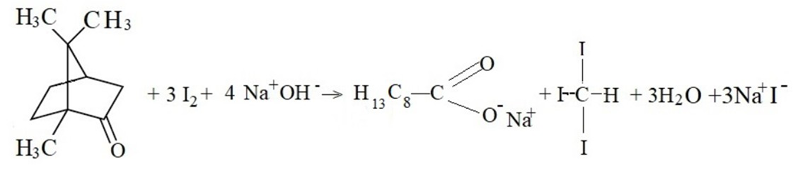
2.2.1 Saggio dello iodoformio per la canfora
Reattivi: 10 g di iodio sciolti in 100 cm3 di acqua distillata contenente 20 g di ioduro potassico; soluzione di idrossido di sodio al 5%
Procedimento: a circa 5 cm3 di una soluzione di idrossido di sodio al 5% si aggiungono circa 0,1 g di canfora in polvere e si mescola fino a totale solubilizzazione; quindi, dopo l’aggiunta di circa 10 cm3 della soluzione di iodio e agitazione fino a persistenza del colore dello iodio, si forma il precipitato giallo di iodoformio, secondo la seguente reazione:
2.2.2 Saggio di pH della soluzione acquosa di canfora (facoltativo)
Di solito, nella trattazione relativa all’unità didattica “acidi e basi”, viene fornita agli allievi dei corsi di chimica di base anche una tabella delle coppie acido-base coniugate con i valori delle relative costanti di dissociazione.
A tale scopo, si fanno notare i valori grandissimi e piccolissimi alle estremità di tale tabella limitandosi a dire teoricamente che, applicando la legge di azione di massa, risultano valori di concentrazioni di [H3O+] corrispondenti a valori di pH non compresi nell’intervallo 0-14. Pertanto, per dimostrare che 0 e 14 non rappresentano limiti estremi, potrebbe essere interessante il saggio del pH della canfora collegandolo all’esperienza relativa ai saggi di pH di acidi e basi.
Infatti, poiché per la canfora in soluzione acquosa si ha Ka = 10–29, si può proporre ai ragazzi, oltre alle soluzioni acquose di acidi e basi, anche la determinazione del pH di una soluzione acquosa di canfora, stimolandoli a rispondere alla seguente domanda legittima:
Utilizzando la Ka della canfora e la legge di azione di massa, per una soluzione acquosa di canfora 0,1 M si calcola [H3O+] =10–15 M; sfruttando le vostre conoscenze di chimica, cercate di spiegare il valore del pH della soluzione acquosa di canfora rilevato mediante la cartina indicatrice di pH.
Nella discussione conclusiva, l’insegnante (evitando, comunque, ogni riferimento al fenomeno della tautomeria cheto-enolica) prende spunto dalle risposte degli allievi per guidarli all’interpretazione, mettendo in evidenza che la dissociazione della canfora come acido si può rappresentare con la seguente reazione:
AH(aq) + H2O ⇌ A–(aq) + H3O+(aq)
ove AH rappresenta la canfora e A– il corrispondente anione.
Quindi si può spiegare che la reazione di dissociazione acida della canfora è un esempio di reazione reversibile per cui, essendo il valore della costante di equilibrio molto piccolo, essa è talmente spostata a sinistra che la [H3O+] è piccolissima e, quindi, trascurabile rispetto a quella relativa all’H2O.
Pertanto, in pratica il pH risulta circa neutro.
Tempo impiegato per le attività di pre-laboratorio e laboratorio. 2 ore
Come detto sopra, lo scopo principale di questa esperienza è l’approfondimento, a livello di chimica di base, della regola di Bredt e dell’argomento relativo all’importante scoperta relativa alle molecole anti-Bredt.
Inoltre, potrebbe essere interessante accennare al fatto che la regola di Bredt, al pari di altre regole, implica delle eccezioni e spesso tali eccezioni stimolano, come in questo caso, gli scienziati a proseguire la ricerca per approfondimenti ed eventuali nuove scoperte importanti.
Infine, si ritiene che questa esperienza, similmente ad altre, dovrebbe incentivare l’interesse degli allievi per la storia della chimica.
[1] G. Conroy, Quelle molecole “impossibili” che infrangono le leggi della chimica, Le Scienze, 2024, 6 novembre.
[2] J. McMurry, Chimica organica, Piccin- Nuova Libraria Editore, 2017, pp. 134 - 139.
[3] E. S. Gould, Mechanism and Structure in organic Chemistry, Holt, Rinehart and Winston, 1959, p. 347 e p. 368.
[4] J. Hine, Physical Organic Chemistry, McGraw-Hill Book Company, 1962, p. 234 e p. 305.
[5] J. March, Advanced Organic Chemistry:Reactions, Mechanisms and Structure, McGraw-Hill, 1968, p. 122 e p. 739.
[6] M. B. Smith, March’s Advanced Organic Chemistry: Reactions, Mechanisms and Structure, 8th Edition, Wiley, 2019.
[7] Bredt’s rule definition and exceptions (anti-Bredt olefins) – Educational Chemistry Videos (ad esempio, https://www.youtube.com/watch?v=2LJeVDkADNI).
[8] M. A. Carrozza, Da un’indagine, spunti per la Chimica. Innovazione metodologica nel processo insegnamento/apprendimento. I parte, La Chimica nella Scuola, CnS, 2005, 1, 9.
Si ringraziano per l’interessamento e alcune utili osservazioni i professori Maria De Nobili, Renzo Bortolomeazzi, Alberto Linda, Antonella Soldà e l’ingegnere Renato Ballerino.
1 Nota della redazione: in realtà oggi un argomento del genere potrebbe essere affrontato solo al secondo anno dei tecnici e, comunque, con grande difficoltà perché gli studenti non hanno più le conoscenze di base per affrontarlo.