Titolazioni acido-base e soluzioni saline come supporto per lo sviluppo di competenze scientifiche, epistemologiche e didattiche
Sidi Mohamed Tounkara
DER PC ENSup Bamako, Mali
Mohamed Soudani
S2HEP, Université Claude Bernard Lyon 1, France
Premessa:
questo contributo offre un esempio di esperienza di formazione-insegnanti
realizzata in ambito francofono, fondata sulla didattica per competenze e l’utilizzo di situazioni-problema per il superamento di concezioni difformi
relative al concetto di neutralizzazione e di punto di equivalenza nelle
titolazioni acido-base. Esso mette in evidenza le difficoltà concettuali degli allievi, ma anche quelle dell’insegnante nella gestione di una prassi didattica non trasmissiva. Riteniamo che
possa essere di ispirazione sia ai titolari dei corsi di didattica della
chimica che agli insegnanti della scuola secondaria.
Riassunto. In una logica curriculare, che promuove l’approccio per competenze, abbiamo proposto a un insegnante principiante due situazioni-problema sulle titolazioni acido-base affinché le sperimentasse nella sua classe di “Scienze Sperimentali” dell’ultimo anno della scuola secondaria (17-18 anni) in Mali. L’analisi dello svolgimento di questa sequenza evidenzia due dimensioni, didattica ed epistemologica, che si manifestano nella formazione continua dell’insegnante all’applicazione di un approccio socio-costruttivista, alla cura del rapporto teoria-esperienza e alla discussione dei limiti dei modelli, ma anche nella messa in evidenza (e nel superamento da parte degli allievi) degli ostacoli che si frappongono alla comprensione del concetto di neutralizzazione acido-base.
Parole-chiave: Acido-base; competenze; situazione-problema; approccio scientifico; modellizzazione.
1.1 Contesto dello studio
Questo lavoro ha un obiettivo curriculare che investe sia la formazione degli insegnanti che l’apprendimento da parte degli studenti mediante un approccio per competenze (APC).
Tra il 1996 e il 2003, l’APC si è affermato nel sistema educativo di cinque paesi africani di lingua francese (Camerun, Gabon, Mali, Senegal e Tunisia), promuovendo una profonda riforma dei programmi di studio [1]. Un rapporto di ricerca del Centro Internazionale per gli Studi sull’Educazione (CIEP) in Africa ha messo in evidenza le notevoli carenze di questa riforma [1], la cui applicazione ha comportato una massiccia ondata di prepensionamenti fra gli insegnanti, con il relativo reclutamento di giovani insegnanti, la riapertura degli istituti di formazione per gli insegnanti (Instituts de Formation de Maîtres, IFM) e la costruzione di nuove aule. La logica avrebbe suggerito di formare in primis i docenti dell’IFM all’APC, con il mandato di promuovere la trans-disciplinarietà delle tematiche per coinvolgere docenti di storia-geografia, chimica e fisica, matematica e biologia intorno allo stesso tema.
Nel 2018, i risultati del PISA hanno mostrato che nei paesi dell’OCSE solo il 6,8% degli studenti dimostra di possedere competenze corrispondenti a un livello di alfabetizzazione scientifica [2]. Secondo la definizione di competenza del Parlamento europeo (2006), questi studenti dovrebbero riuscire a utilizzare le proprie conoscenze scientifiche in modo creativo e autonomo in un’ampia gamma di situazioni, per risolvere problemi, compresi quelli a loro non familiari [2].
Nel tentativo di superare queste carenze, il Mali raccomanda una strategia dal basso che si concentra sul miglioramento della formazione degli insegnanti all’interno della loro pratica in classe. Si tratta, quindi, di offrire loro situazioni-problema (SP) basate su un approccio socio-costruttivista e di analizzare con essi la loro stessa pratica. Ispirate dalla epistemologia bachelardiana, queste situazioni complesse, nelle quali si sperimentano strategie diverse per il superamento di un ostacolo, sono fondamentali per lo sviluppo delle capacità professionali [3].
Il presente testo è un estratto da un lavoro più ampio nel contesto della disseminazione per casi di studio proposti durante seminari di formazione; si focalizza sul tema della titolazione chimica, che ben si presta a questo tipo di approccio.
I metodi di titolazione, detti anche titrimetrici, comprendono un ampio gruppo di procedure quantitative basate sulla misurazione della quantità di un reagente a concentrazione nota che viene consumato dall’analita: titolazioni volumetriche, gravimetriche e coulometriche. In ogni titolazione, il punto di equivalenza corrispondente al completo consumo dell’analita è indicato da un cambiamento di colore di un indicatore o da una variazione nella risposta di uno strumento. L’interesse per questo tema deriva dal fatto che esso è presente:
Distinguiamo due tipi principali di titolazione: titolazioni acido-base e titolazioni redox. Qui tratteremo solo il primo caso. Questa scelta è giustificata dalla loro estesa presenza nei programmi di chimica ai livelli iniziali, diversamente dalle titolazioni redox. Inoltre, riteniamo che le titolazioni acido-base debbano essere studiate prima di quelle redox per fungere da analogo propedeutico [4, 5]. La scelta è anche giustificata dalla messe di lavori disponibili sulle concezioni degli studenti relative a queste titolazioni, che riassumeremo qui di seguito, come supporto per l’elaborazione di SP efficaci, grazie alla conoscenza degli ostacoli impliciti in questo tipo di titolazioni.
1.2 Guide pedagogiche per l’APC
Nel 2020, in seguito a un grande progetto di riforme curriculari, il Mali ha visto la nascita di guide pedagogiche sull’APC nelle scuole superiori, riguardanti la matematica, la chimica, la fisica e le scienze della vita e della Terra, a servizio della formazione continua degli insegnanti. Lo sviluppo di SP e l’attuazione della loro risoluzione in uno spirito socio-costruttivista costituisce la prima competenza professionale raccomandata dai programmi ufficiali.
1.3 Difficoltà e ostacoli degli allievi in merito alle titolazioni acido-base
Limiteremo la nostra presentazione alle concezioni degli studenti relative al concetto di neutralizzazione acido-base.
Nakhleh e Krajcik [6] hanno mostrato che le concezioni degli allievi sulla neutralizzazione possono resistere all’innovazione tecnologica. Gli autori hanno studiato l’effetto di tre tecniche di titolazione acido-base su alunni di età compresa tra 16 e 17 anni: l’indicatore di acidità, il pH-metro e il pH-metro associato ad un computer, per automatizzare l’acquisizione dei dati di misura e visualizzare immediatamente la curva di titolazione. 15 studenti sono stati divisi in tre gruppi e ogni gruppo ha applicato una tecnica di titolazione sui sistemi acido forte, acido debole e poliacido, rispettivamente titolati mediante una base forte. Il gruppo operante con il computer è apparso generalmente più efficiente, ma la sua comprensione del processo di neutralizzazione non è risultata migliore rispetto a quella degli altri.
Sheppard [7] raccomanda la titolazione tra acido forte e base forte assistita da computer, con fasi di predizione, osservazione e spiegazione per una migliore comprensione della reazione di neutralizzazione e del concetto di pH. Al termine dello studio, una decina di studenti su un totale di 16 coinvolti (età 16-17 anni) pensano che la reazione chimica abbia luogo nell’istante della neutralizzazione.
Il concetto di neutralizzazione è stato discusso in relazione alla stechiometria delle reazioni acido-base [8], con 96 studenti destinati a divenire insegnanti: per il 35% di essi, le reazioni acido-base portano sempre a un mezzo neutro.
Ouertatani [9] riporta che le concezioni sulla neutralizzazione persistono oltre il liceo. I suoi risultati mostrano, infatti, che la percentuale di alunni (liceo) e studenti (università) che sono in grado di stabilire una relazione tra lo stato del sistema chimico e la curva del pH è bassa (rispettivamente e paradossalmente 21% e 11%). Allo stesso modo, la persistenza di queste concezioni nel 1° anno di università deriva dalla prassi che identifica come reazioni di “neutralizzazione” le reazioni tra acido debole e base forte o di semi-equivalenza.
Widarti et al. [10] hanno, invece, collegato la questione alla conoscenza della normalità di un acido. Su 66 studenti, il 52% pensa che nella reazione tra idrossido di sodio e acido ossalico si raggiunga l’equivalenza quando sono presenti lo stesso numero di moli di acido e di base: l’equivalenza sembra quindi indipendente dalle normalità coinvolte.
I lavori di cui sopra hanno evidenziato l’ostacolo relativo al concetto di neutralizzazione. Questo sembra correlato:
Essendo consapevoli di questo ostacolo, è stato necessario sviluppare proposte di insegnamento-apprendimento atte a superarlo [11, 12].
L’approccio di Çetingül e Geban [11] mira a elaborare il concetto di neutralizzazione in modo indipendente dalla specifica reazione acido-base presa in esame. Nel loro studio, 47 studenti - divisi in due gruppi (sperimentale e di controllo) - hanno ricevuto dallo stesso docente due tipi di insegnamenti: l’uno incentrato sugli studenti (sperimentale) e l’altro incentrato sul docente (controllo). L’insegnamento proposto al gruppo sperimentale si basava su testi con esempi di concezioni e analogie che i discenti potevano discutere. Il successo del gruppo sperimentale, seppur significativo (57,5% contro il 31,0% del gruppo di controllo), è risultato appena al di sopra della media.
Tounkara et al. [12] hanno utilizzato la metodologia dell’ingegneria didattica per lo sviluppo di una SP e di attività di modellizzazione per la titolazione mediante pH-metro di un acido forte con una base forte. I 35 studenti (età 17-18 anni), che hanno preso parte a questo studio, sono stati divisi in 7 gruppi, con un insegnante tirocinante: 6 gruppi su 7 ritengono che la reazione acido-base avvenga quando il pH cambia bruscamente, un risultato assimilabile a quelli ottenuti da Ouertatani [9].
Resta dunque aperta la domanda: come superare questo concetto di neutralizzazione acido-base, sia sul piano didattico che su quello epistemologico? In conformità con le raccomandazioni ufficiali maliane, abbiamo puntato sulla risoluzione di SP.
1.4 L’approccio per competenze, le situazioni-problema e la modellizzazione
L’APC è tuttora oggetto di discussione [13, 14]. La definizione data nelle guide educative nazionali maliane è simile a quella del Parlamento europeo. La raccomandazione maliana per l’uso di SP si inscrive nell’APC. In effetti, la risoluzione di una SP non è di routine; costituisce quindi una competenza, secondo la definizione utilizzata. La risoluzione di questo tipo di SP richiede la costruzione di un modello in cui diversi registri semiotici sono interconnessi [15, 16]. I modelli acido-base presentano una forma di gerarchia o dei domini di validità che li fanno apparire annidati l’uno nell’altro [16].
Il meccanismo di reazione a due stadi relativo all’equazione chimica bilanciata per la formazione di carbonato di sodio ne offre una buona illustrazione:
![]()
Stadio 1 del meccanismo : interazione dello ione idrossido (come donatore di un doppietto elettronico, ossia come base di Lewis) con una molecola di diossido di carbonio per formare uno ione idrogenocarbonato
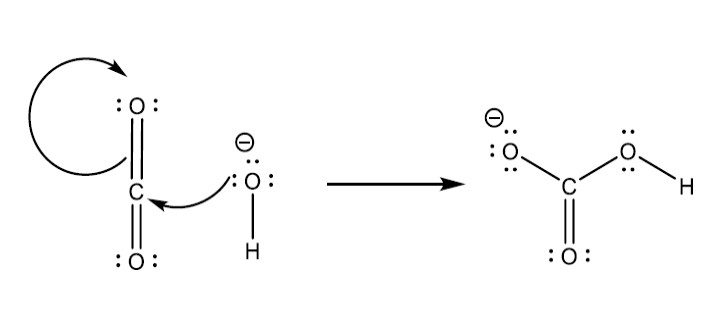
Stadio 2 del meccanismo : interazione dello ione idrossido (come accettore di protoni, ossia come base di Brönsted) con uno ione idrogenocarbonato, per dare uno ione carbonato e una molecola di acqua
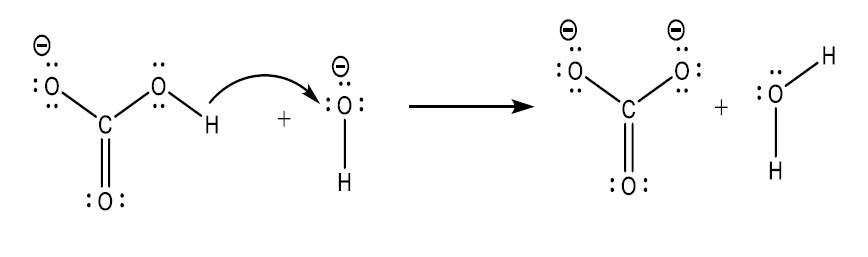
E così, il modello di Brönsted, che introduce coppie acido-base ed è consigliato dai programmi per le classi terminali (17-18 anni), è più elaborato di quello di Arrhenius, ma meno elaborato di quello di Lewis, che non richiede trasferimento di protoni.
Abbiamo proposto a un insegnante principiante (2° anno di servizio, in una scuola superiore nel Distretto di Bamako) le due seguenti SP da provare nella sua classe (età 17-18 anni) che per la prima volta ha sperimentato un approccio di questo tipo:
SP1 - Dell’acetato di sodio, formula CH3 COONa, che è un sale dell’acido acetico, viene disciolto in acqua distillata a 25°C. Pensi che il pH sarà: a) maggiore di 7? b) minore di 7? c) uguale a 7? Come mai?
SP2 - Il solfato di alluminio, formula Al2 (SO4)3, che è un sale dell’acido solforico, viene disciolto in acqua distillata a 25°C. Secondo te, l’ambiente sarà acido o neutro? Come mai?
Questa fase relativa a SP1 è stata immediatamente successiva a quella della titolazione di un acido forte (HCl) con una base forte (NaOH). Ci si attendeva che gli studenti fossero tentati di generalizzare il concetto di “neutralizzazione”, appreso nel caso precedente, alla soluzione acquosa di acetato di sodio. Il materiale didattico a loro disposizione consisteva in istruzioni sperimentali, vetreria e prodotti di laboratorio (forniti dal docente-ricercatore).
Al docente è stato chiesto di partire dalla verifica delle conoscenze pregresse (prerequisiti disciplinari), di dividere i suoi alunni in gruppi, di distribuire loro la prima SP, di assicurarsi che le istruzioni fossero comprese, invitando gli allievi a riflettere secondo l’approccio didattico di indagine: formulazione di ipotesi, proposta e realizzazione di esperienze di sperimentazione, istituzionalizzazione. La SP2 sarebbe servita per la fase di approfondimento.
Al termine della sequenza era previsto un colloquio con il docente sui contributi prodotti, le difficoltà incontrate ed i possibili miglioramenti.
Prima fase
L’insegnante inizia dai prerequisiti, forma gruppi di quattro allievi; quindi, distribuisce le schede della prima SP e chiede a uno studente di leggere l’enunciato ad alta voce. Rilegge la SP e dà loro 10 minuti per pensarci. Circolando tra i gruppi, svolge il ruolo di facilitatore, come mostrato negli estratti seguenti. Per ciascuna SP è stata formulata una sola ipotesi che questa è stata riportata sulla lavagna.
Estratto 1 (I = insegnante; A = allievo)
I: nella titolazione acido forte-base forte, cosa abbiamo ottenuto all’equivalenza?
A1: un pH pari a 7
I: come abbiamo chiamato la regione di viraggio?
A2: di neutralizzazione
I: quindi è una reazione di neutralizzazione; oggi impareremo cosa è una SP mediante la proposizione di due diverse SP.
Estratto 2 (scambi di idee all’interno di un gruppo)
A1: come provarlo [pH=7]?
A3: se avessimo dei dati, potremmo fare un calcolo? Ma qualunque siano i dati, alla neutralizzazione si ha sempre un ambiente neutro
Con questo richiamo, gli alunni sono quindi posti a priori al centro dell’ostacolo rappresentato dal concetto di “neutralizzazione”, ostacolo dovuto all’uso di un modello al di fuori del suo dominio di validità.
Seconda fase: condivisione di ipotesi
I: tutti avete espresso gli stessi valori. Scelgo dunque il gruppo 1
Relatore del gruppo 1: scrive i due valori di pH alla lavagna pari a 7 e 7
Classe: ambiente neutro
Terza fase
Gli studenti non sono abituati alla validazione di ipotesi mediante l’esecuzione di un esperimento; pertanto, è il docente a proporre loro l’esperimento da svolgere (peraltro descritto nella situazione-problema) e a presentare i materiali e i prodotti (sulla cattedra). Egli invita due studenti a realizzare un esperimento per ogni SP.
I due allievi concludono:
A4: io trovo pH 8 [per l’acetato di sodio]
Classe: ambiente basico
A5: io trovo pH 4 [per il solfato di alluminio]
Classe: ambiente acido
Quarta fase: istituzionalizzazione
Il docente negozia la conclusione riportando gli studenti ai prerequisiti. Ma né lui né gli studenti sono abituati a gestire una SP, perciò questa fase risulta quasi trasmissiva.
I: (scrive l’equazione incompleta) la soluzione acquosa di CH3COONa è basica (è una base ottenuta all’equivalenza della reazione CH3COOH + NaOH) con pH = 8, come possiamo constatare; completate questa equazione che è la definizione di che cosa [quale modello]?
Classe:
I: allora, tenendo conto di quanto abbiamo appreso in precedenza, quando possiamo parlare di neutralizzazione?
Classe: in occasione della titolazione di HCl e di NaOH
I: quindi all’equivalenza della titolazione di un acido forte e una base forte
Classe: si.
I: per la SP2, scrivete le formule della molecola di acqua, degli ioni solfato e alluminio e dite come si realizza l’acidificazione?
Classe: solo le molecole di acqua
Pur avendo scritto le formule richieste (H2O, SO42-, Al3+), quest’ultima affermazione della classe indica che gli allievi non si sono spinti a formulare alcuna equazione chimica esplicativa del processo di acidificazione. Essi hanno risposto alla domanda “come si realizza l’acidificazione?” semplicemente affermando che il trasferimento di protoni deve essere a carico delle molecole di acqua. In seguito a ciò, l’insegnante introduce il modello di Lewis, confermando che il trasferimento di protoni avviene a partire da una delle molecole di acqua che circondano lo ione alluminio, Al3+ , ione piccolo e fortemente carico.
Questa sessione ha permesso la manifestazione e la destabilizzazione del concetto di neutralizzazione. Negli scambi all’interno dei gruppi, l’idea di eseguire un calcolo mostra che gli alunni non sono abituati all’esperimento come mezzo di validazione delle ipotesi, conformemente alla disciplina di riferimento. Quando il docente ha invitato gli studenti a riflettere, non l’ha fatto con l’intenzione di incoraggiarli a proporre una validazione sperimentale: ciò mostra che egli stesso non è abituato a questa fase del processo di indagine. Il colloquio che ha seguito il suo intervento in classe ha evidenziato - a sua difesa – l’obbligo di rispettare l’orario del sovraccarico programma ufficiale per una classe che dovrà sostenere l’esame finale nazionale (N.d.T. esame di maturità ). Ciò spiega la riduzione del processo istruttorio a quattro fasi. Questa fase dovrebbe portare gli studenti a comprendere il ruolo dell’esperimento e il suo statuto come possibile mezzo per verificare le ipotesi. Il calcolo rappresenta un altro mezzo. Per il momento si tratta quindi di un’introduzione all’approccio scientifico, che favorisce lo sviluppo delle competenze degli studenti in relazione alla risoluzione della SP, prima competenza disciplinare nei programmi ufficiali. La sessione è stata un’opportunità per l’insegnante principiante di “concretizzare la chimica”, secondo le sue stesse parole.
Per quanto riguarda l’ostacolo, esso si manifesta nel ragionamento degli studenti quando cercano di risolvere la SP1.
Per rispondere correttamente sarebbe stato necessario considerare i dati del problema, sale di un acido disciolto in acqua, e scrivere le due equazioni seguenti, utilizzando l’equazione acido-base (2):
| (1) | |
| (2) |
Gli studenti avrebbero quindi reperito, secondo il modello di Brönsted, il diagramma generico:
| (3) |
Gli alunni, invece, hanno sostituito questo ragionamento con il principio secondo il quale un sale si ottiene a partire da un acido e una base:
| (4) |
Essendo il cloruro di sodio il tipico esempio di sale conosciuto dagli allievi, essi proiettano il loro ragionamento sul diagramma della sua dissoluzione:
| (5) |
È il modello di Arrhenius che viene dunque mobilitato, nella misura in cui AH + BOH → AB + H2O (acido + base → sale + acqua). Ciò porta a considerare tutti i sali come neutri: da qui l’ostacolo. Questo mostra chiaramente i limiti del modello di Arrhenius rispetto a quello di Brönsted. Grazie ai prerequisiti, l’insegnante ha collocato il ragionamento degli studenti all’interno di un modello acido-base forte la cui generalizzazione abusiva li mette di fronte all’ostacolo durante la titolazione tra l’acido debole e la base forte.
Poiché la prima istituzionalizzazione avrebbe potuto suggerire un’altra concezione, per il proseguimento del percorso di apprendimento si è resa necessaria una seconda SP. La concezione consisterebbe nel considerare neutra la soluzione di solfato di alluminio a causa degli ioni solfato che sono indifferenti in soluzione acquosa. Ma, proprio come nel caso della CO2, lo ione Al3+ è un acido di Lewis. L’acidità deriva dal fatto che gli ioni alluminio si circondano di sei molecole d’acqua, una delle quali trasferisce lo ione H+, portando allo ione idronio H3O+.
Durante il colloquio, l’insegnante principiante ha suggerito delle migliorie per ottimizzare il processo e sviluppare l’autonomia degli alunni e le loro capacità: esecuzione di tante esperienze quanti sono i gruppi, utilizzo di un pH-metro portatile, presentazione successiva delle due SP, proposta di più SP.
Questo lavoro è consistito nell’implementazione di due SP sul concetto di neutralizzazione, da parte di un insegnante principiante in una classe di Scienze sperimentali con studenti di17-18 anni non abituata a risolvere problemi di questo tipo. Ciò ha permesso la manifestazione e la destabilizzazione della concezione secondo la quale la reazione di neutralizzazione porta a un pH neutro qualunque sia la titolazione acido-base. Ha inoltre consentito di precorrere l’attitudine ad attribuire proprietà acide solo a quei composti che contengono un protone trasferibile, permettendo una migliore comprensione dei modelli. Per l’insegnante, la SP e la sua risoluzione sono stati sia oggetto di insegnamento e apprendimento, sia un’opportunità per conformarsi con i programmi ufficiali.
Infine, questo lavoro mostra che lo sviluppo delle competenze sia per gli insegnanti che per gli studenti diventa una realtà quando l’insegnante riceve la formazione necessaria e opera nelle condizioni materiali opportune. Da qui la necessità di una formazione continua per trasformare gli insegnanti in veri attori per il successo dell’innovazione curriculare.
(ultimo accesso ai link: agosto 2022)
[1] F. Cros et al., Étude sur les réformes curriculaires par l’approche par compétences en Afrique, [Rapport de recherche], Centre international d’études pédagogiques (CIEP) , 2009, 222 ( https://halshs.archives-ouvertes.fr/halshs-00523433 ).
[2] OCSE, Résultats du PISA 2018 (Volume I): Savoirs et savoir-faire des élèves , PISA, Éditions OCDE, Paris, 2019 ( https://doi.org/10.1787/ec30bc50-fr ).
[3] P. Perrenoud, Des savoirs aux compétences De quoi parle-t-on en parlant de compétences, Actes du 15e colloque de l’AQPC , 1995 ( http://www.cdc.qc.ca/actes_aqpc/1995/perrenoud_9B71_actes_agpc_1995.pdf ).
[4] M. Soudani, Le concept d’oxydoréduction: Analyse épistémologique et didactique , Editions universitaires européennes, Paris, 2014.
[5] J-F. Le Maréchal, R. Naïja, La mesure dans l’enseignement de la chimie: Cas d’une approche des titrages par pH-métrie et conductimétrie. Aster , 2008, 47 , 103-130.
[6] M.B. Nakhleh, J.S. Krajcik, The Effect of Level of Information as Presented by Different Technologies on Students’ Understanding of Acid, Base, and pH Concepts, in Annual meeting of the National Association for Research in Science Teaching, Geneva Lake, 1991 ( ED347062.pdf ).
[7] K. Sheppard, High school students’ understanding of titrations and related acid-base phenomena, Chem. Educ. Res. Pract. , 2006, 7, 32-45.
[8] T. Pinarbasi, Turkish undergraduate students’ misconceptions on acids and bases, J. Baltic Sci. Educ. , 2007, 6 , 23–33.
[9] L. Ouertatani, L’enseignement-apprentissage des acides et des bases en Tunisie: une étude transversale du lycée à la première année d’université , Thèse de doctorat, Université de Bordeaux, France, 2009.
[10] H. R. Widarti et al., Students’ Misconceptions on Titration, J. Physics: Conf. Series, 2017, 812 , 012016, DOI:10.1088/1742-6596/812/1/012016
[11] P. I. Çetingül, Ö. Geban, Understanding of acid-base concept by using conceptual change approach. H. U. Journal of Education , 2005, 29 , 69-74 [ 766-published.pdf (hacettepe.edu.tr) ].
[12] S. M. Tounkara, M. Soudani, Ressource sur la modélisation du titrage pH-metrique et sa mise en œuvre en situation ordinaire. Eur. J. Educ. studies , 2020, 7 , 336-352, DOI: 10.46827/ejes.v7i8.3225 ( https://oapub.org/edu/index.php/ejes/article/view/3225 ).
[13] N. Duroisin et al., Au carrefour du curriculum prescrit et du currriculum implanté: polémique et polysémie autour du terme de compétence en Fédération Wallonie Bruxelles, 24e colloque de l’Adméé - Europe. L’évaluation des compétences en milieu scolaire et en milieu professionnel , Luxembourg, Luxembourg. 2011, pp.11-19 ffhal-00985355f.
[14] N. Sylla, L’approche par compétences: quelle place dans la formation initiale et la professionnalisation des enseignants de sciences? Education & Formation , 2013, e-298-02 , 105-119.
[15] J-L. Martinand, Point de vue V – Didactique des sciences et techniques, didactique du curriculum, Éducation et didactique , 2014, 8 , 65-76 ( https://doi.org/10.4000/educationdidactique.1886 ).
[16] F. Halbwachs, La pensée physique chez l’enfant et le savant. Editions Delachaux & Niestlé, France, 1974.