 |
Una panoramica sulle reazioni chimiche oscillanti
Rinaldo Cervellati
Gruppo Nazionale di Fondamenti
e Storia della Chimica, GNFSC
e-mail: rinaldo.cervellati@unibo.it
Indice
2. La reazione di Bray, oggi detta di Bray-Liebhafsky (reazione BL)
3. La reazione di Belousov-Zabotinsky (reazione BZ)
4. Reazioni oscillanti e termodinamica
5. Il meccanismo semplificato per la reazione BZ
6. La reazione di Briggs-Rauscher (reazione BR)
7. La reazione di Orbàn detta anche di Orbàn-Epstein 89
Abstract: In this overview, the conditions under which a chemical system can exhibit “complexity” in a closed thermodynamic system, i.e., a beaker, a flask or a Petri dish, are presented. Four oscillating systems by Bray-Liebhafsky, Belousov-Zabotinsky, Briggs-Rauscher and Orbàn-Epstein are then examined, also from a historical point of view. Two cases of “exotic” phenomena are proposed: the intermittences and the chemical patterns. There is also a link to Thermodynamics, since at the beginning the phenomenon was ignored by chemists as they argued that it contradicted the second law. Only after the Thermodynamics of irreversible systems had been elucidated, the oscillating chemical systems began to be studied in detail.
Keywords: reazione di Bray-Liebhafsky; reazione di Belousov-Zabotinsky; reazione di Briggs-Rauscher; reazione di Orbàn-Epstein; reazioni oscillanti e Termodinamica; eccitabilità e dinamica caotica in Chimica
Il termine “complessità”, riferito a un fenomeno fisico o comunque materiale, richiama alla mente un tutto costituito da diverse parti che dipendono le une dalle altre in modi molto diversi. Una caratteristica dei sistemi cosiddetti complessi è che in generale, quando le loro parti interagiscono, fanno emergere proprietà dell’insieme che, oltre a non essere riconducibili a una somma delle proprietà delle singole parti, sono del tutto nuove rispetto a quelle che avrebbe la semplice somma di tali parti. In Chimica l’esempio tipico di fenomeno complesso sono le reazioni oscillanti. Una delle principali caratteristiche di queste reazioni è la variazione periodica delle concentrazioni degli intermedi e dei catalizzatori nel tempo. Tuttavia, in certe condizioni le reazioni, o meglio i sistemi chimici oscillanti, manifestano tutta una serie di comportamenti che vanno dalle oscillazioni aperiodiche, alla multistabilità, alla formazione di “onde” spaziali di concentrazione, fino all’andamento “caotico”. Ciò dipende dal fatto che la cinetica dei sistemi chimici oscillanti è governata da equazioni non lineari, che nel meccanismo di reazione sono compresi stadi autocatalitici e autoinibitori e che tali sistemi possono trovarsi nelle stesse condizioni sperimentali in due diversi stati stazionari quasi stabili [1]. Inoltre, per manifestare comportamenti oscillanti i sistemi chimici devono essere lontani dal loro stato di equilibrio. Questo articolo vuole essere un excursus scientifico correlato da cenni storici sulle più note reazioni chimiche oscillanti.
2. La reazione di Bray, oggi detta di Bray-Liebhafsky (reazione BL)
La prima reazione chimica oscillante in fase omogenea è stata riportata nel 1921 dal chimico americano William Crowell Bray [2]. Egli stava studiando la decomposizione del perossido di idrogeno (acqua ossigenata) in ambiente acido con iodato di potassio come catalizzatore:
5H2O2 + I2 → 2IO3– + 2H+ + 4H2O (1)
5H2O2 + 2IO3– + 2H+ → I2 + 5O2 + 6H2O (2)
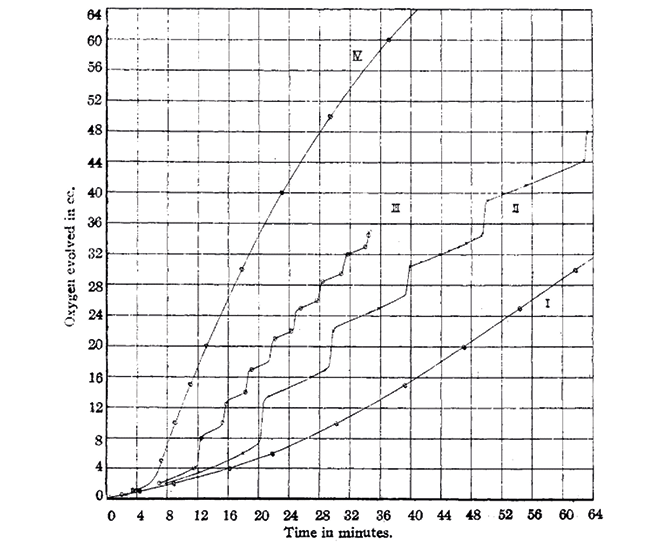
In entrambe le reazioni compare la coppia redox IO3–,H+/I2. In base a calcoli termodinamici, egli si aspettava che la coppia di reazioni catalizzasse la decomposizione del perossido di idrogeno, infatti la somma (1 + 2)/10 dà: H2O2 → H2O + 1/2O2. Il fenomeno interessante osservato da Bray era che, date le concentrazioni di perossido di idrogeno e iodato e con una concentrazione di H2SO4 compresa tra 0,055 < N < 0,110, lo sviluppo di ossigeno non aumentava gradualmente ma per impulsi periodici (Figura 1).
 |
Figura 1. Andamento dell’ossigeno sviluppato (in mL) in funzione del tempo (minuti); concentrazioni iniziali: [H2O2] = 0,190 M, [KIO3] =0,095 M, [H2SO4] = 0,055 N (curva I), 0,073 N (curva II), 0,0916 N (curva III), 0,110 N (curva IV); temperatura = 60 °C [2]
Bray scrisse di aver scoperto una reazione oscillante in fase omogenea, ma per fugare ogni dubbio sull’omogeneità del sistema, eseguì un esperimento a una temperatura inferiore (25 °C) per seguire l’evoluzione dello iodio. In tali condizioni, l’ossigeno si genera così lentamente da diffondersi all’esterno della soluzione senza formare bolle (Figura 2).
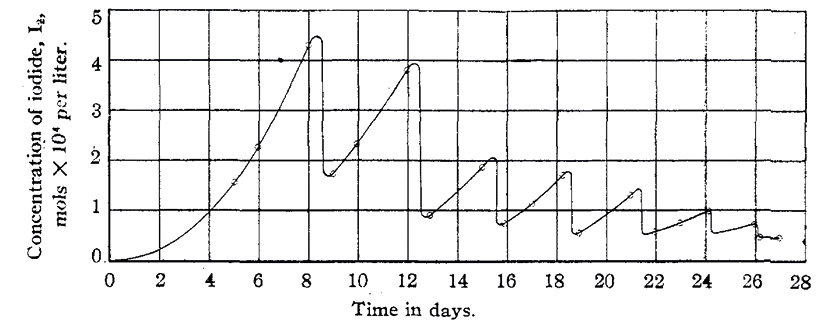 |
Figura 2. Evoluzione della concentrazione di I2 (mol L−1 × 104) nel tempo (giorni); concentrazioni iniziali: [H2O2] = 0,0327 M, [HIO3] = 0,0090 M; temperatura = 25 °C [2]
Bray concluse: “The reaction (1) is strictly autocatalytic. However, until further experimental evidence has been presented, the writer prefers not to discuss possible mechanisms” [2].
Il suo lavoro, pubblicato nel prestigioso Journal of the American Chemical Society, fu accolto con generale indifferenza. Alcuni sostennero che le oscillazioni non avrebbe avuto luogo se il perossido di idrogeno fosse stato accuratamente distillato per rimuovere polvere e stabilizzanti. Molti hanno sostenuto l’ipotesi che, per la presenza di polvere o per altre cause, il sistema di Bray era effettivamente eterogeneo (le oscillazioni erano state osservate dal 1903 in sistemi eterogenei). In breve, l’impossibilità dei fenomeni periodici in soluzione è stata supportata da questioni “empiriche” piuttosto che termodinamiche.
Intorno al 1927, Bray tornò a lavorare al suo sistema insieme all’allievo e collaboratore Herman A. Liebhafsky. Lo scopo era quello di indagare la cinetica dei sottosistemi e di identificare possibili intermedi. Tra il 1931 e il 1933, Bray e Liebhafsky, in seguito solo Liebhafsky (a volte in collaborazione), pubblicarono sul Journal of the American Chemical Society una sequenza di otto articoli sulla cinetica dei sottosistemi delle reazioni (1) e (2). Oltre alla determinazione di molte costanti di velocità, il risultato importante è stato il riconoscimento che gli ioni ioduro e le specie ossiiodio avevano un ruolo importante nel meccanismo di reazione. Tuttavia, non fu possibile identificare un meccanismo che potesse spiegare le oscillazioni nell’intero sistema (a quel tempo, non esistevano tecniche strumentali per rilevare la presenza di radicali liberi o altre specie altamente reattive), quindi Liebhafsky concentrò la sua attenzione su altre ricerche fino al 1969, periodo in cui cominciò a svilupparsi la Termodinamica dei sistemi lontani dall’equilibrio dovuta a I. Prigogine e alla sua scuola.
3. La reazione di Belousov-Zabotinsky (reazione BZ)
Sono occorsi più di trent’anni per la scoperta della seconda reazione oscillante, la reazione di Belousov-Zhabotinsky (reazione BZ), oggi la più nota e studiata, e circa altri venti prima che i chimici e i chimico-fisici si occupassero seriamente di questi fenomeni [1][3].
Attorno al 1950 il chimico sovietico Boris Pavlovich Belousov, particolarmente interessato alla biochimica, era impegnato nel tentativo di elucidare il meccanismo catalitico del ciclo di Krebs.
Il ciclo di Krebs è una parte fondamentale e universale del metabolismo cellulare di ossidazione dei residui acetilici a CO2 che avviene nei mitocondri. Esso è chiamato “ciclo” non perché conduca a oscillazioni di concentrazione nel tempo, quanto perché la sequenza di reazioni conduce a un ciclo, come accade, ad esempio, nei cicli geochimici (ciclo dell’azoto, dell’acqua. ecc.).
Per riprodurre in provetta un’analogia del ciclo di Krebs, Belousov pensò di utilizzare come catalizzatore di ossidazione dell’acido citrico lo ione metallico Ce4+, invece dei complessi proteina-ione metallico che catalizzano il ciclo nelle cellule degli organismi viventi. Con molta sorpresa di Belousov, la sua analogia chimica del ciclo di Krebs, e cioè una soluzione acquosa di acido citrico addizionata di una soluzione acidificata di bromato di potassio come ossidante e contenente, come catalizzatori, ioni cerici colorati intensamente in giallo, diventava incolore e tornava a diventare gialla periodicamente. Il fenomeno continuò per più di un’ora (a temperatura ambiente), mentre si sviluppava la CO2. Ciò mostrava chiaramente che la concentrazione degli ioni Ce4+ (come pure quella degli ioni Ce3+, incolori) variava periodicamente nel tempo. Belousov intraprese seri studi su questo “stravagante” fenomeno misurando, ad esempio, gli effetti della temperatura e dell’acidità sul periodo di oscillazione. Egli notò che la reazione smetteva di “oscillare” quando o l’ossidante (bromato) o il substrato organico (acido citrico) venivano rimossi e ricominciava quando si aggiungeva nuovamente la sostanza mancante. Egli propose anche uno schema-tentativo per il meccanismo di reazione. Il suo collega Safronov gli suggerì poi di perfezionare la “ricetta” sostituendo gli ioni cerici con il complesso ferro-fenantrolina Fe(fen)32+ (ferroina), che funzionava meglio sia come catalizzatore che come “indicatore” delle oscillazioni: la forma ridotta del complesso (ferroina) è rossa, quella ossidata (ferrina) è blu. In seguito, fu osservato che si poteva efficacemente sostituire l’acido citrico con composti partecipanti al ciclo di Krebs, o strettamente analoghi (ad esempio, l’acido malonico, MA).
Purtroppo, la rivista a cui Belousov inviò un primo articolo nel l951, lo rifiutò. L’editore gli scrisse che la sua “supposta scoperta” era praticamente impossibile perché “in contrasto con la teoria esistente” e che, quindi, l’articolo avrebbe potuto essere pubblicato solo se accompagnato da una dimostrazione che la teoria esistente fosse invalidata dalla scoperta.
La scelta di Belousov fu, allora, quella di tornare in laboratorio per effettuare ulteriori esperimenti al fine di decifrare il meccanismo di reazione. Sei anni dopo sottopose uno studio molto dettagliato della reazione a un’altra rivista di chimica, ottenendo un secondo netto rifiuto. Molto contrariato, Belousov decise di non pubblicare più nulla sulle reazioni oscillanti. Per molti anni l’unica traccia stampata della reazione di Belousov furono due paginette (in russo) sugli Atti di un Congresso di medicina tenutosi nel 1958 [4].
Queste paginette riportavano la “ricetta” con poche scarne congetture sul meccanismo di reazione, senza alcuna dimostrazione dell’attività oscillante e senza citazioni bibliografiche.
Alla fine del 1961, Anatol M. Zhabotinsky, dottorando in biochimica all’Università di Mosca, fu invitato dal suo professore, S. E. Schnoll, a occuparsi di questa strana “ricetta” di incerta origine. Nella primavera del 1962 egli discusse i suoi risultati con Schnoll e, dopo aver ritrovato gli Atti del Congresso di medicina del 1958, inviò una copia dei suoi risultati a Belousov. Belousov rispose con una lettera molto gentile. Esprimendo soddisfazione per lo sviluppo di quel suo lavoro originale, accluse una copia del suo manoscritto non pubblicato. Zhabotinsky tenne costantemente informato Belousov dei progressi delle sue ricerche e tentò molte volte di combinare un incontro che, però, questi declinò sempre con diverse scuse. I due non si incontrarono mai.
I risultati del lavoro di Zhabotinsky furono pubblicati nel 1964 su Biofizika [5]. In un’intervista concessa alla rivista The Chemical Intelligencer (July 1996, 19-23) Zhabotinsky sostenne che: “all’epoca, i chimici ritenevano che comportamenti oscillanti fossero in contraddizione con il secondo principio della Termodinamica, mentre i biofisici erano inconsapevoli di ciò”. A questo proposito vale la pena ricordare che molte reazioni biochimiche oscillanti furono riportate negli anni Sessanta del secolo scorso come, ad esempio, la glicolisi enzimatica (1964) e l’ossidazione aerobica in vitro della coppia NADH/NAD+ catalizzata dalla perossidasi (1965) [6].
4. Reazioni oscillanti e termodinamica
Riguardo alla reazione di Bray occorre riconoscere che il sistema non era facilmente riproducibile ed era, quindi, comprensibile per gli scettici considerare le oscillazioni come “incidenti” dovuti a impurezze di vario genere presenti in soluzione. È, invece, incredibile che si siano voluti chiudere gli occhi davanti a lavori così documentati come quello che Belousov sottopose a riviste di chimica nel 1951 e nel 1957. Ciò dipese probabilmente dal fatto che un sistema oscillante sembrò inizialmente un fenomeno che contraddiceva il secondo principio della Termodinamica. In base all’interpretazione classica di tale principio, il verificarsi di un’oscillazione implica che l’evoluzione spontanea del processo si alterni con l’evoluzione inversa, durante la quale si scambiano i ruoli di stato iniziale e finale del sistema. Essendo l’entropia una funzione di stato, la sua variazione globale risulterebbe perciò nulla, in contrasto con il secondo principio. Come ricordato, furono Ilya Prigogine (Premio Nobel Chimica, 1977) e la sua scuola a riconoscere che l’interpretazione classica richiede non solo che i sistemi siano isolati, ma anche che siano vicini al loro stato di equilibrio. In seguito, lo studio termodinamico di sistemi in condizioni di non equilibrio ha permesso di risolvere l’apparente contrasto fra il regime oscillatorio e il secondo principio della Termodinamica. In particolare, Ilya Prigogine e collaboratori hanno mostrato che la diminuzione di entropia causata dalle variazioni periodiche nelle concentrazioni degli intermedi è più che compensata da un aumento di entropia dovuto ad altri processi che avvengono contemporaneamente e tali per cui la variazione totale di entropia dell’universo risulta positiva [7]. Sicché, la concentrazione degli intermedi in una reazione può aumentare e diminuire nel tempo (e questo non è un andamento monotòno), mentre l’energia libera della reazione diminuisce monotònicamente. Fra i motivi per cui le reazioni oscillanti sono state scoperte abbastanza tardi, c’è il fatto che uno dei requisiti è la lontananza dall’equilibrio, sicché in generale, in condizioni termodinamiche chiuse, l’equilibrio si raggiunge tanto rapidamente che le eventuali oscillazioni, e in generale qualsiasi altro comportamento “esotico”, sono un fenomeno transiente, tale che non c’è il tempo sufficiente per osservarle. La reazione di Bray, quella di Belousov-Zhabotinsky, nonché la reazione di Briggs-Rauscher e quella di Orbàn-Epstein (in cui il meccanismo ancora oggi non è stato soddisfacentemente chiarito), descritte di seguito, sono tra le poche che in condizioni termodinamiche chiuse raggiungono l’equilibrio in un tempo sufficientemente lungo per osservare i comportamenti oscillanti. Le numerose famiglie di oscillatori chimici e biochimici sono state, pertanto, scoperte lavorando in condizioni termodinamiche aperte e utilizzando reattori a flusso e agitazione continui (CSTR).
5. Il meccanismo semplificato per la reazione BZ
La reazione classica di Belousov-Zhabotinsky consiste nella bromurazione e ossidazione di un substrato organico (generalmente acido malonico) da parte di ioni bromato in soluzione acida, catalizzata da uno ione complesso del ferro. In certe condizioni la reazione mostra andamenti oscillanti di concentrazione degli intermedi e del catalizzatore. I principali intermedi sono Br2, Br–, HOBr, HBrO2, i radicali BrO2• e diversi radicali inorganici e organici. L’effetto sperimentale più spettacolare del comportamento oscillante di questa reazione si ha quando il catalizzatore ha un colore diverso nei due stati di ossidazione n+ e (n + 1)+. Se si usa il complesso ferroina (Fe(phen)32+, rosso) si noterà una variazione periodica di colore dal rosso al blu (colore della ferrina, Fe(phen)33+). Gli andamenti oscillanti della concentrazione degli intermedi possono essere seguiti in maniera quantitativa per via elettrochimica potenziometrica, utilizzando un elettrodo al platino lucente per la coppia redox o un elettrodo iono-sensibile allo ione Br– per tale intermedio. In figura 3 sono riportate le registrazioni potenziometriche simultanee utilizzando i due tipi di elettrodo.
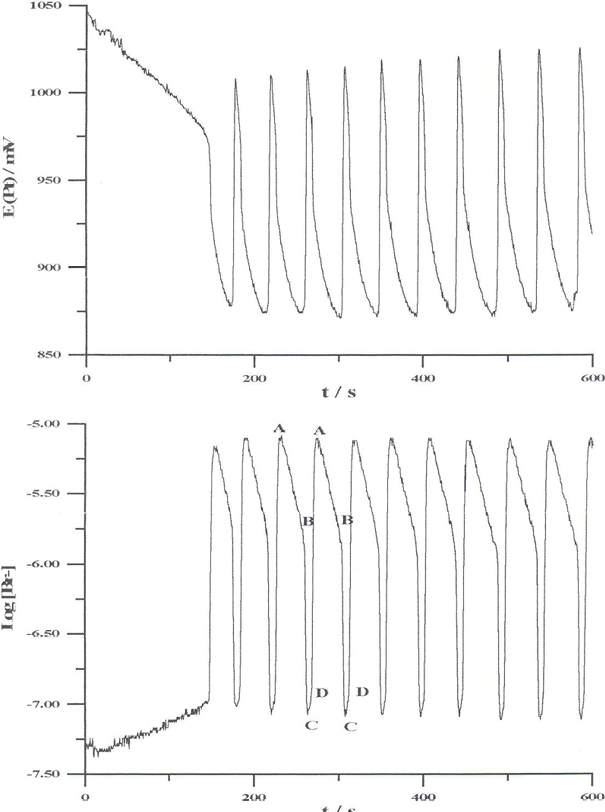 |
Figura 3. Registrazioni potenziometriche simultanee del potenziale all’elettrodo di Pt e del log[Br–] in funzione del tempo in una miscela BZ; condizioni iniziali: [BrO3–] = 0,10 M; [MA] = 0,30 M; [Ce4+] = 2,0 × ١٠–3 M; [H2SO4] = 1,0 M (fonte: R. Cervellati, La Chimica e la Società, https://ilblogdellasci.wordpress.com/2015/04/03/le-reazioni-chimiche-oscillanti-1-parte/)
Le prime ricerche molto dettagliate su un meccanismo cinetico che interpretasse gli andamenti oscillanti furono effettuate nell’università dell’Oregon da R. M. Noyes e collaboratori, nei primi anni Settanta del secolo scorso [8]. Il meccanismo proposto comprende 18 step elementari e 21 intermedi ed è noto come “meccanismo FKN” (dal nome degli autori: Field, Koros e Noyes).
Senza entrare nei dettagli, il punto centrale del meccanismo è l’ossidazione di Ce3+ a Ce4+ svolta autocataliticamente dal radicale BrO2•. Infatti, la produzione autocatalitica di HBrO2 ha questo radicale come intermedio, ma la sua crescita esponenziale è poi limitata da un suo disproporzionamento (autocatalisi e inibizione). A questo punto è necessario che intervenga un terzo processo che riduca il Ce4+ a Ce3+ e contemporaneamente faccia aumentare la concentrazione degli ioni Br–. Queste condizioni si realizzano attraverso l’intervento del substrato organico (acido malonico, MA). Quanto detto è riportato nello schema 1 in cui il meccanismo FKN è stato per comodità suddiviso in tre processi.
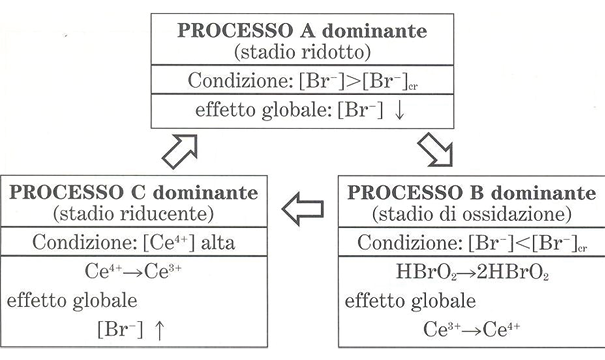 |
Schema 1. Meccanismo semplificato per la reazione BR (fonte: R. Cervellati, La Chimica e la Società, https://ilblogdellasci.wordpress.com/2015/04/03/le-reazioni-chimiche-oscillanti-1-parte/)
Con riferimento alla figura 3, il processo A ha inizio quando la concentrazione degli ioni Br– è alta (punto A della figura). Questo processo consuma ioni bromuro e quando la loro concentrazione si è sufficientemente ridotta fino a un valore critico ha inizio il processo B (punto B della figura). La concentrazione degli ioni Br– continua a calare raggiungendo il punto C della figura. Interviene, quindi, il processo C che riduce il catalizzatore e fa aumentare la concentrazione degli ioni bromuro fino al punto A della figura, così che il ciclo si ripete. Ovviamente nel sistema reagente tutte le reazioni avvengono contemporaneamente, la suddivisione dei tre processi sequenziali A, B e C è soltanto una rappresentazione utile per illustrare il comportamento oscillante degli intermedi e del catalizzatore.
6. La reazione di Briggs-Rauscher (reazione BR)
Nel 1973 due docenti della Galileo High School di San Francisco, Thomas Briggs e Warren Rauscher, mescolando soluzioni di iodato di potassio, perossido di idrogeno, acido malonico e ioni Mn2+ in soluzione acida per acido perclorico a temperatura ambiente ottennero una reazione oscillante che, in presenza di salda d’amido come indicatore, passava alternativamente da incolore a giallo a blu per un tempo dipendente dalla composizione della miscela (Figura 4) [9].
 |
Figura 4. Variazioni periodiche di colore nella reazione BR
Questa reazione, che può essere considerata “ibrida” con quella di Bray, è stata intensivamente studiata da Stanley D. Furrow, (Penn State University Reading, USA), dal gruppo di Lijliana Kolar-Anic e Zeljko Cupic (University of Belgrade), da Guy Schmitz (University Libre Bruxelles) e dal sottoscritto (Università di Bologna).
La reazione globale è:
IO3– + 2H2O2 + CH2(COOH)2 + H+ → ICH(COOH)2 + 2O2 + 3H2O
che avviene sinteticamente in due processi radicalici e non radicalici:
IO3– + 2H2O + H+ → HIO + 2O2 + 2H2O (I)
HIO + CH2(COOH)2 → ICH(COOH)2 + H2O (II)
Il meccanismo dei due processi implica la presenza di specie radicali all’ossigeno, come HO•, HOO•, O2•–, e di radicali organici.
Oltre che visivamente, la reazione BR può essere seguita usando due elettrodi (uno di Pt o ionosensibile agli ioni I– e uno di riferimento al calomelano) collegati a un multimetro (Figura 5).
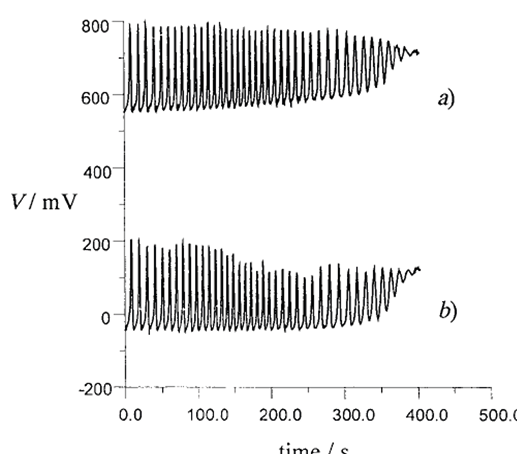 |
Figura 5. Registrazioni simultanee dei potenziali a) dell’elettrodo di platino e b) dell’elettrodo selettivo agli ioni I– rispetto al tempo per una tipica miscela BR; condizioni iniziali: [H2O2] = 1,20 M, [HClO4] = 0,0266M, [IO3–] = 0,0667M, [MA] = 0,050M, [Mn2+] = 0,00667M [10]
Si potrebbero descrivere altri aspetti delle reazioni chimiche oscillanti, qui ne riporterò uno studiato in dettaglio molto recentemente, chiamato “intermittenze” e rilevato nella reazione di Briggs-Rauscher[11]. Senza entrare troppo nei dettagli, la reazione viene monitorata per via potenziometrica con un elettrodo al platino lucente. Nella figura 6, a sinistra, è riportata la registrazione del potenziale elettrico dell’elettrodo di Pt in funzione del tempo per una miscela BR imperturbata in condizioni aperte. A destra la registrazione della stessa miscela alla quale è stata aggiunta inizialmente una piccolissima quantità di fenolo.
Come si può osservare, la piccola perturbazione provocata dal fenolo ha effetti eclatanti, una serie di treni di oscillazioni che si ripetono con una certa regolarità per lungo tempo. La perturbazione ha provocato un cambiamento sostanziale e inaspettato nel comportamento del sistema. É questa una caratteristica dei sistemi complessi: sottoposti a perturbazioni anche molto piccole cambiano completamente la loro evoluzione rispetto a quanto ci si aspetterebbe (citando Lorenz, “Può il batter d’ali di una farfalla in Brasile provocare un tornado in Texas?”). Il fenomeno dei treni di oscillazioni (intermittenze o “scoppi” intermittenti, scoperto dal Prof. S. D. Furrow), è stato verificato e studiato in dettaglio in tre laboratori indipendenti (Università di Bologna, di Belgrado e di Reading) sia in condizioni aperte sia chiuse e ne sono state riportate due possibili interpretazioni [11], ma quella più ragionevole è ancora oggetto d’indagine.
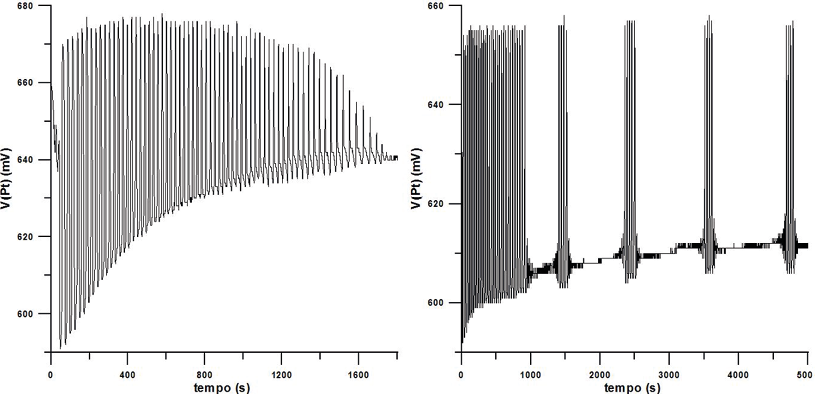
Figura 6. A sinistra, condizioni iniziali in miscela: [HClO4] = 0,10 M, [KIO3] = 0,020 M, [MnSO4] = 0,0020 M, [MA] = 0,016 M, [H2O2] = 1,20 M; a destra, con aggiunta iniziale di fenolo, 3,0 × 10–5 M [11]
7. La reazione di Orbàn detta anche di Orbàn-Epstein
Nel 1986 Miklòs Orbàn pubblicò la scoperta di una nuova reazione oscillante abbastanza lontana dall’equilibrio per essere osservata anche in condizioni chiuse [12]. Il sistema è costituito da perossido di idrogeno, tiocianato di potassio (KSCN) e solfato rameico (CuSO4) come catalizzatore in ambiente alcalino per idrossido di sodio (NaOH). Poiché il suo meccanismo fu elucidato dal gruppo di Irving Epstein tre anni dopo, attraverso 30 reazioni e 26 specie intermedie, questa reazione è anche nota come reazione di Orbàn-Epstein.
Nel 2014 a Bologna, insieme a Zeljko Cupic ed Emanuela Greco, abbiamo rivisitato la reazione di Orbàn-Epstein per cercare anzitutto le condizioni iniziali che conducessero al maggior numero di oscillazioni [13]. Utilizzando una coppia elettrodo di Pt-elettrodo di riferimento, è stato ottenuto il treno di oscillazioni mostrato in figura 7.
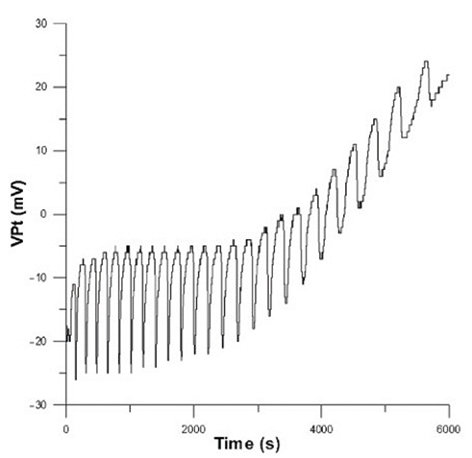 |
Figura 7. Il treno più numeroso di oscillazioni nel tempo a T = 25°C; condizioni iniziali: [H2O2 ] = 0,20M, [NaOH] = 0,050M, [KSCN] = 0,060M, [CuSO4] = 3,0 × 10−4M [13]
Ovviamente nella ricerca è stato incluso un modello di meccanismo che è in buon accordo con i dati sperimentali.
Una reazione chimica si può quindi schematizzare come segue [1]:
R1 + R2 + ... + Cn+ 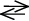 X, Y, ... Cn+/C(n+1)+
X, Y, ... Cn+/C(n+1)+  P1 + P2 + ... + Cn+
P1 + P2 + ... + Cn+
dove Ri rappresentano i reagenti (che scompaiono), X, Y e C, rispettivamente gli intermedi e il catalizzatore (che possono raggiungere uno stato stazionario o oscillare), e Pi i prodotti (che si formano). Nelle reazioni oscillanti al perossido di idrogeno, fra gli intermedi vi sono le specie radicaliche idroperossile HOO•. Un’evidenza dell’effetto di questo radicale nell’evoluzione della reazione BR si è avuta per la prima volta nel 2000, aggiungendo una soluzione contenente malonil daidzeina e malonil genisteina (antiossidanti contenuti nella farina di soia) dopo la terza oscillazione di un sistema BR. L’effetto consiste in una immediata cessazione delle oscillazioni che riprendono dopo un tempo che dipende dalla concentrazione della sostanza aggiunta, con ampiezza e periodo diversi da quelli della miscela di riferimento. Il periodo di interruzione delle oscillazioni viene chiamato tempo di inibizione che, entro certi limiti, dipende linearmente dalla concentrazione della sostanza aggiunta, comunemente nota come antiossidante.
In figura 8 è mostrato un esempio di inibizione per un sistema BR a cui è stato aggiunto un antibiotico [14].
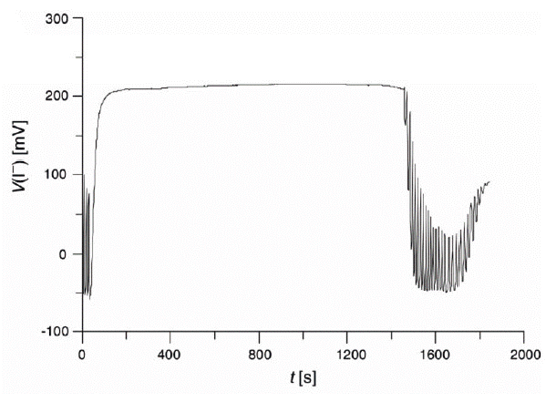 |
Figura 8. Effetto dell’aggiunta di 1,00 ml di soluzione di un antibiotico β-lattamico a una miscela BR; concentrazioni: [MA] = 0,050 M, [Mn2+] = 0,0067M, [IO3–] = 0,0667M, [HClO4] = 0,0266M, [composto] = 23,58 μM [13]
L’attività antiossidante (rac) relativa di un campione rispetto a una sostanza scelta come standard viene determinata in base ai tempi di inibizione. Usando come standard il resorcinolo (1,3-benzendiolo), nel caso dell’antibiotico il risultato medio su quattro concentrazioni è stato rac = 0,28 ± 0,08 [13].
Allo stesso modo è stata studiata una serie di antiossidanti naturali e sintetici e il metodo della reazione oscillante è stato adottato da altri laboratori [14].
Poiché quasi tutti gli antiossidanti hanno −OH o residui fenolici il meccanismo inibitorio è stato descritto con le due seguenti reazioni, dove Ar(OH)n rappresenta un generico antiossidante:
Ar(OH)n + HOO• → Ar(OH)n−1O• + H2O2
Ar(OH)n → Prodotti
La prima reazione rappresenta la modalità tipica di sottrazione di un radicale da parte di un antiossidante: il trasferimento dell’atomo H da un gruppo OH fenolico al radicale. Il radicale arossile così formatosi è abbastanza stabile e può reagire con un altro radicale o con ossigeno per formare composti diamagnetici stabili. La seconda reazione rappresenta, invece, la possibile degradazione dell’antiossidante a prodotti non specificati.
Inserendo queste reazioni in un opportuno schema di meccanismo si è ottenuto un ottimo accordo fra i tempi di inibizioni calcolati e quelli sperimentali.
Dal punto di vista didattico si può anche evitare il metodo elettrochimico, usando solo un contasecondi aggiungendo al sistema salda d’amido come indicatore. In questo modo il tempo di inibizione si calcola facendo partire il contasecondi al momento dell’aggiunta dell’antiossidante alla comparsa del secondo blu, le oscillazioni di colore cesseranno per un certo tempo e si fermerà il contasecondi al momento della loro ripresa [15].
9. Eccitabilità e dinamica “caotica” in Chimica
I sistemi chimici oscillanti possono essere “eccitati”. Si definisce eccitabile un sistema che rimane inerte fino a che non è sottoposto a perturbazioni anche di piccola entità. Quando un sistema eccitabile viene perturbato oltre tale entità, si sposta dallo stato inerte e per ritornare a una situazione inerte passa continuamente attraverso un ampio intervallo di stati.
Supponiamo di avere un sistema BZ catalizzato da ferroina nello stato quasi stazionario rosso e immaginiamo di perturbarlo in un punto in modo che la perturbazione inneschi in questo punto la reazione oscillante. Si possono riprodurre queste condizioni in uno strato sottile della miscela, per esempio in una capsula Petri, in modo da ricoprirne il fondo per circa 1 mm di spessore. Tocchiamo ora la superficie con la punta di un capillare Pasteur: s’innescheranno in varie zone della superficie liquida le oscillazioni e si allargheranno formando “onde” di colore azzurro che incontrandosi daranno luogo a una varietà di bellissime immagini. In figura 9 è mostrato un esempio di questo fenomeno ottenuto nel laboratorio di Bologna.
 |
Figura 9. Esempio di “onde stimolate” che danno origine a figure spaziali in uno strato sottile di una miscela BZ; composizione iniziale della miscela: [BrO3–] = 0,27 M, [Br–] = 0,045 M, [MA] = 0,018 M, [Fe(phen)32+] = 2,2 × 10–2 M, [H2SO4] = 0,32 M (fonte: R. Cervellati, La Chimica e la Società, https://ilblogdellasci.wordpress.com/2015/04/03/le-reazioni-chimiche-oscillanti-2-parte/)
La formazione delle “onde stimolate” (chiamate anche “onde di materia” o “onde spaziali”) può essere spiegata nel modo seguente: inizialmente la miscela BZ è omogenea nello stato quasi stazionario in cui il catalizzatore si trova tutto o quasi nella forma ridotta rossa, ma in seguito alla perturbazione in uno o più punti della miscela si forma un piccolo eccesso di HBrO2 segnalato dai circoletti azzurrognoli (immagine a). Non è ben chiaro se ciò accada a causa di una fluttuazione spontanea di concentrazioni all’interno della soluzione o eterogeneità dovute a particelle di polvere. Probabilmente tutti questi effetti concorrono al fenomeno. Poiché la produzione di HBrO2 è autocatalitica, la sua concentrazione aumenta nei dintorni dei circoletti, e si avvia così il processo B (Schema 1) con formazione di anelli di ossidazione azzurrognoli (immagine b). Gli anelli si espandono quindi radialmente dai punti iniziali di perturbazione perché sui loro fronti l’autocatalisi di HBrO2 viene stimolata formando così una serie di “onde” (immagine c). Le onde che si incontrano si “annichilano”, ma la propagazione del fronte prosegue come mostra l’immagine d. Alla fine il sistema viene a trovarsi, per diffusione, nello stato quasi stabile azzurro e se si mescola il tutto ritorna nello stato rosso. Il fenomeno delle “onde spaziali” non è soltanto spettacolare: lo studio della loro propagazione ha permesso di determinare le costanti di velocità di alcuni degli step del meccanismo cinetico della BZ, in particolare quella dello stadio autocatalitico. Va infine puntualizzato che le onde chimiche nel sistema BZ si comportano in modo diverso dalle usuali onde “liquide” che si formano gettando un sassolino in uno specchio d’acqua. Ad esempio, quando un’onda azzurrina di ossidazione incontra una parete del recipiente non si osserva alcuna riflessione: l’onda, semplicemente, si “spegne”. Inoltre, quando due onde di ossidazione si incontrano, non si ha il fenomeno dell’interferenza, ma esse tendono ad annullarsi l’una con l’altra, formando così le caratteristiche figure. Pertanto, invece di “onde chimiche” sarebbe più giusto chiamarle “figure” o “disegni” chimici, dall’inglese “chemical patterns”.
A questo punto mi preme far notare una sostanziale differenza fra fenomeni complessi (strettamente) fisici come quelli meteorologici e quelli chimici. Quello che li accomuna è che una perturbazione anche piccola nelle condizioni iniziali provoca effetti enormi, quello che li differenzia è che nei secondi le perturbazioni sono “riproducibili” e, quindi, gli effetti diventano prevedibili.
Il problema della complessità, coinvolgendo tutte le discipline scientifiche e possedendo quindi rilevanti implicazioni epistemologiche, ha dato lo spunto per dibattiti culturali anche molto accesi. C’è chi ha sostenuto che la comprensione dei fenomeni complessi richiederebbe un radicale cambiamento nel paradigma scientifico su cui si sono basate finora le discipline, altri invece sostengono che la complessità è descrivibile con strumenti e procedimenti matematici esistenti senza necessità di cambi di paradigma. Nel nostro Paese un lungo dibattito su tale questione vide come principali protagonisti il chimico-fisico Enzo Tiezzi e il fisico Carlo Bernardini che si “scontrarono” sulle pagine dedicate alla scienza dei principali quotidiani. Al dibattito hanno poi partecipato altri scienziati compreso il Premio Nobel per la Chimica Ilya Prigogine. Gli articoli sono stati ripubblicati in un volume edito da l’Unità (Api o architetti – Quale universo. Quale ecologia, Editrice l’Unità S.p.A., Roma, 1990, volume fuori commercio).
Personalmente ritengo più ragionevole il punto di vista di Carlo Bernardini e, almeno per quanto riguarda la Chimica, contro il parere opposto di un collega [16] l’ho sostenuto [17], senza però dimenticare che “Ci sono più cose in Cielo e in Terra, Orazio, di quante ne sogni la tua filosofia”.
Riferimenti
1 R. J. Field, F. W. Schneider, Oscillating Chemical Reactions and Non-linear Dynamics, J. Chem. Educ., 1989, 66, 195-204.
2 W. C. Bray, A Periodic Reaction in Omogeneous Solution and its Relation to Catalysis, J. Amer. Chem. Soc., 1921, 43, 1262-1267.
3 H. Degn, Effects of Bromine Derivatives of Malonic Acid on the Oscillating Reaction of Malonic Acid, Cerium Ions and Bromate, Nature, 1967, 213, 589-590.
4 P. Belousov, Sb. Ref. Radiats Med.za 1958, Medgiz, Mosca, 1959, 1, 145-146, in russo
5 A. M. Zhabotinsky, Biofizica, 1964, 9, 329-335 (in russo)
6 (a) A. Gosh, B. Chance, Oscillations in Glycolytic Intermediates in Yeast Cells, Biochem. Biophys. Res. Commun., 1964, 16, 174-181; (b) L. Yamazaki, K. Yokota, R. Nakajima, Oscillatory Oxidation and Reduced Pyridine Nucleotide by Peroxidase, Biochem. Biophys. Res. Commun., 1965, 21, 582-586.
7 R. M. Noyes, J. Field, E. Koros, Oscillations in Chemical Systems. I. Detailed Mechanism in a System Showing Temporal Oscillations, J. Am. Chem. Soc., 1972, 94, 8649-8664.
8 R. M. Noyes, J. Field, E. Koros, Oscillations in Chemical Systems. I. Detailed Mechanism in a System Showing Temporal Oscillations, J. Am. Chem. Soc., 1972, 94, 8649-8664.
9 T. S. Briggs, W. C. Rauscher, An Oscillating Iodine Clock, J. Chem. Ed., 1973, 50, 496.
10 R. Cervellati, K. Hoener, S. D. Furrow, C. Neddens, S. Costa, The Briggs-Rauscher Reaction as a Test to Measure the Activity of Antioxidants, Helv. Chim. Acta, 2001, 84, 3533-3546.
11 Z. Cupic, L. Z. Kolar-Anic, S. Anic, S. R. Macesic, J. P. Maksimovic, M. S. Pavlovic, M. C. Milenkovic, I. N. Bubanja, E. Greco, S. D. Furrow, R. Cervellati, Regularity of Intermittent Bursts in Briggs-Rauscher Oscillating Systems with Phenol, Helv. Chim. Acta, 2014, 97, 321-333.
12 M. Orbàn, Oscillations and bistability in the copper(II)-catalyzed reaction between hydrogen peroxide and potassium thiocyanate, J. Am. Chem. Soc., 1986, 108, 6893-6898.
13 G. Cainelli, C. Angeloni, R. Cervellati, P. Galletti, D. Giacomini, S. Hrelia, R. Sinisi, New Polyphenolic β-Lactams with Antioxidant Activity, Chemistry & Biodiversity Acta, 2008, 5, 811-828.
14 (a) L. I. Csepey, C. Bolla, Study on the Inhibition of Briggs-Rauscher Oscillating Reaction, Chemia, 2009, 4, 249-259. (b) E. Prenesti, S. Toso, S. Berto, Redox chemistry of red wine. Quantification by an oscillating reaction of the antioxidant power as a function of the temperature, J. Agric. Food Chem., 2005, 53, 4220-4227.
15 K. Hoener, R. Cervellati, La visualizzazione dell’effetto di sostanze sottrattrici di radicali liberi sulla reazione di Briggs-Rauscher, CnS-Chimica nella Scuola, 2000, 2, 44-46.
16 P. Manzelli, Entro quali limiti la scienza ha capito i processi di reazione chimica? Didattica delle Scienze, 1995, XXX(177), 10-15.
17 R. Cervellati, La comprensione delle reazioni chimiche, Didattica delle Scienze, 1997, XXXII(189), 16-26.