Indice
Abstract: The late 1800s and early 1900s saw the emergence of a revolutionary new model of the atom. An atom that could no longer be conceived as having no structure of its own, but it had to be understood as a complex of particles. Of these particles, the electron was the one that precisely marked the affirmation of the atomic model of matter. Indeed, the belief in the electron as a particle also presupposed a firm belief in the existence of atoms. The existence of ions, evoked in Arrhenius’ theory of electrolytic dissociation, confirmed the presence of positive and negative charges due to the transfer of electrons from atom to atom.
Keywords: ione; elettrone; elettricità; atomo; soluzioni; acidi; basi; sali
Questo contributo non è e non vuole essere una puntuale ricostruzione storica degli eventi che portarono alla nascita di un nuovo modo (modello) per interpretare e rappresentare le reazioni chimiche (redox), né, tanto meno, vuole ripercorrere tutte le vicende che portarono alla nascita del concetto di elettrone (su questo argomento rimandiamo ai tanti articoli e libri che sono stati pubblicati). Si tratta, invece, di un tentativo per mettere in luce alcuni aspetti, quelli che noi riteniamo più significativi per una trasposizione didattica che abbia al centro anche il “come e il perché dei cambiamenti concettuali intervenuti all’interno della disciplina”, in altre parole i “processi e non solo i prodotti conoscenza”. Ci collochiamo in un periodo storico a cavallo fra l’800 e i primi anni del ’900 del secolo scorso, un periodo che determinò una svolta nell’interpretazione di fenomeni, come quelli che avvengono in una cella elettrochimica. Una svolta che fa perno sul modello dell’elettrone “corpuscolo” ipotizzato e sviluppato da Thomson negli anni 1897-1899 (una particella materiale caratterizzata da una carica e da una massa ben definite). Un modello di elettrone che, visto con gli occhi di oggi, non esiteremmo a considerare assolutamente inadeguato per rappresentare una realtà così complessa, ma che rimane, pur sempre, una pietra miliare nel processo, ancora oggi in corso, di comprensione e di interpretazione della struttura intima della materia. Un processo contrassegnato da un magnifico articolo di Thomson del 1897[1] che, a ragione, viene ritenuto un vero e proprio “spartiacque nella storia della scienza nonché uno straordinario modello di chiarezza. Un’enorme quantità di scienza del XX secolo prende le mosse da questo articolo e si può affermare che merita pienamente il plauso che ha ricevuto nel tempo...”.[2] Ricordiamo che in questo lavoro Thomson non solo dimostra la natura particellare dei raggi catodici, ma determina il rapporto carica/massa di tali corpuscoli e ipotizza che siano particelle subatomiche.
Dal punto di vista storico, come citato prima, ci collochiamo a cavallo fra l’800 e il ’900. Un periodo che segnò, non a caso, anche l’affermazione di un nuovo e rivoluzionario modello di atomo. Un atomo che non poteva più essere concepito come privo di una sua struttura, ma doveva essere inteso come un “complesso edificio costituito da un certo numero di particelle uguali, agenti l’una sull’altra secondo una qualche legge di forza”.[3] Di queste particelle, l’elettrone è stato non solo quello primigenio, ma quello che ha segnato proprio l’affermazione del modello atomico della materia, perché la credenza dell’elettrone come particella presupponeva anche una ferma convinzione nell’esistenza degli atomi. Infatti, all’inizio del secolo scorso, la questione della realtà degli atomi era strettamente connessa a quella dell’esistenza degli elettroni e, conseguentemente, a un nuovo modello di atomo.
Se dal punto di vista storico, non c’è ombra di dubbio che “la nascita della fisica dell’atomo [primi anni del ’900] fu un evento rivoluzionario per gli effetti che produsse non solo sulle scienze fisiche, ma anche su quelle chimiche e biologiche” e che “la credenza nella realtà della struttura discreta della materia, nel volgere di una quindicina d’anni, fu rafforzata da una serie impressionante di nuovi risultati teorici e sperimentali”.[4]
Siamo in presenza di un vero e proprio cambio di paradigma nell’interpretazione dei fenomeni, segnato dal passaggio da un modello di atomo indivisibile, che ha caratterizzato la nascita e lo sviluppo dell’atomismo chimico per tutto l’800, a un nuovo modello di atomo divisibile rappresentato dall’atomo elettrico.
Dal punto di vista didattico nascono alcune domande:
Oggi ha ancora senso dare spazio a questioni, a teorie, a modelli ormai ampiamente superati?
Perché dovremmo insegnare qualcosa che, in seguito, dovrà essere disappreso?
Non c’è il rischio di indurre idee fuorvianti nello studente alle prime armi?
Non è meglio puntare, fin da subito, su un insegnamento che sia contenutisticamente più aggiornato?
La questione del come si è arrivati alla conoscenza di… è importante? Oppure riteniamo che sia una questione del tutto secondaria rispetto ai contenuti della conoscenza medesima?
Sono questioni assolutamente sensate, centrali non solo nell’insegnamento dell’elettrochimica, ma delle scienze in generale, e che per questo meritano un’attenta considerazione.
A tal riguardo, riportiamo una prima, breve ma significativa riflessione, tratta da un testo di uno dei più grandi pedagogisti del secolo scorso, che cercheremo poi di calare nel contesto della Scuola di Ricerca Educativa e Didattica Chimica “Ulderico Segre” che si è tenuta nel 2022 e che aveva come tema “Osservabili e modelli nella didattica dell’elettrochimica”. Il libro è “Come pensiamo” e l’autore è John Dewey. Proprio in riferimento all’insegnamento scientifico, Dewey sottolinea un aspetto importante, spesso sottovalutato: “Quella specie di elaborazione logica che contrassegna la materia trattata nello stadio della maturità non è l’unica possibile e quella la specie di organizzazione che si trova nel materiale scientificamente elaborato [manuale/libro di testo] è di fatto indesiderabile finché la mente non abbia raggiunto un grado di maturità capace di comprendere perché si adotta proprio questa forma piuttosto che un’altra. In realtà, ciò che è strettamente logico dal punto di vista della materia trattata rappresenta le conclusioni di una mente esperta ed educata”.[5] Questa mente non è certo quella di studenti che sono all’inizio di un percorso di studi (poco importa che sia scuola o università). Dal punto di vista degli studenti, è preferibile possedere un modello in grado di accrescere la loro capacità di comprensione e di interpretazione dei fenomeni, anche se lo si dovrà abbandonare o modificare più avanti, piuttosto che dover imparare, fin da subito, delle idee più raffinate, più profonde, ma difficilmente assimilabili. I modelli dell’elettrone “corpuscolo” di Thomson e dell’atomo “elettrico” (Lewis, Thomson, Rutherford, Bohr), in una situazione di approccio iniziale al mondo subatomico, rappresentano il terreno ideale per introdurre un livello della struttura della materia che va oltre quello degli atomi e delle molecole. Quello che era sembrato, fino ad un certo punto, il fondo dell’infinitamente piccolo, ora non lo è più:
Siamo in presenza di un nuovo stato della materia, uno stato in cui la suddivisione della materia è portata al di là di quanto accade nel comune stato gassoso: uno stato in cui tutta la materia è di un solo genere. E questa materia è la sostanza con cui sono costituiti tutti gli elementi.[6]
Thomson non utilizza il termine elettrone, anche se nel 1897 la parola “elettrone” esisteva già ‒ essa era stata coniata da G. Stoney nel 1891 ‒ ma parla genericamente di “corpuscoli negativi” di cui, come detto prima, calcola il rapporto carica/massa. Un rapporto dal valore insolitamente anomalo che lo spinge a determinare la carica e successivamente la massa per poter meglio caratterizzare questi corpuscoli.
Va comunque precisato che Stoney aveva già stimato la carica di quelli che lui definì “elettroni” partendo dalle leggi dell’elettrolisi di Faraday. Leggi che costituiscono, senza ombra di dubbio, il contributo più importante dello scienziato inglese all’elettrochimica. Nel 1834, a conclusione delle sue indagini sui processi elettrolitici, Faraday giunse alle seguenti conclusioni.
Le quantità delle sostanze che si consumano o che si formano nel corso dell’elettrolisi sono proporzionali alla quantità di corrente che attraversava il circuito.
Per ogni peso equivalente delle sostanze prodotte/consumate viene impiegata una quantità fissa di elettricità (un “faraday” pari a 96.496 coulomb).
Le leggi di Faraday vengono spesso considerate come una dimostrazione dell’esistenza di un’unità di carica di tipo atomico. Va, comunque, ricordato che Faraday non era un atomista “alla Dalton” e anche se il termine 'atomo' compare, occasionalmente, nelle sue opere, l’idea dell’atomo come corpuscolo solido indivisibile e impenetrabile che si muove nello spazio vuoto gli appariva oltremodo dubbia. “Devo confessare ‒ scriveva Faraday in proposito nelle “Experimental researches in electricity” ‒ che diffido del termine atomo; poiché sebbene sia assai facile parlare di atomi, è molto difficile farsi un’idea precisa della loro natura”. La critica principale di Faraday riguardava, per l’appunto, l’ipotesi del vuoto, che contrastava con l’idea, fortemente radicata nelle sue convinzioni religiose, di un Universo pervaso di forze fisiche, in cui si manifestava la potenza di Dio. Egli privilegiò il modello degli atomi puntiformi intesi come centri di forze, piuttosto che come particelle materiali (Faraday concepiva la legge come una conferma dell’idea secondo cui l’affinità chimica non era che una conseguenza dell’attrazione elettrica tra le particelle di diverse sostanze), contrariamente a quanto ipotizzato da Stoney e da Helmholtz, i quali, atomisti convinti, vedevano l’insieme dei fatti quantitativi dell’elettrolisi in modo nettamente diverso da Faraday.
La ricostruzione degli eventi, che ne fa Stoney in un articolo del 1894, chiarisce sinteticamente e molto bene, le loro posizioni, nonché la sequenza temporale delle loro teorizzazioni.
Nel 1881, Hermann von Helmholtz, giunse a queste conclusioni: Il risultato più stupefacente della legge di Faraday è forse questo: se accettiamo l’ipotesi secondo cui le sostanze elementari sono composte da atomi, non possiamo non concludere che anche l’elettricità, sia positiva che negativa, è divisa in definite porzioni elementari che si comportano come “atomi di elettricità”. Se facciamo di questa quantità definita di elettricità, che chiameremo E, la nostra unità di misura dell’elettricità ‒ aggiunge Stoney ‒ probabilmente avremo fatto un passo molto importante nello studio dei fenomeni molecolari.[7]
Questo perché secondo Stoney a ogni legame chimico rotto all’interno di un elettrolita corrisponde sempre una stessa carica (E) associata allo ione (+) e allo ione (‒) monovalenti. Idee che Stoney, in effetti, aveva già espresso nel 1874. Infatti, collegandosi al processo di revisione delle unità di misura elettriche avviato dalla British Association (1860), Stoney propose di costruire un nuovo sistema di unità di misura a partire da “unità fondamentali” (costanti fisiche fondamentali). Due grandezze erano già state individuate: c e G. Nella ricerca di una terza grandezza che riguardasse i fenomeni elettrici, egli giunse a una particolare lettura delle leggi di Faraday sull’elettrolisi, che lo portò ad individuare “una singola definita quantità di elettricità, sempre presente e invariante rispetto al tipo di reazione elettrolitica”, che proprio per essere “invariante”, si prestava a essere “l’unità di carica elettrica” → elettrone (1891).
Avendo così individuato una “definita quantità di elettricità” tramite la quale, o tramite multipli di essa, gli atomi sembravano combinarsi chimicamente tra di loro, Stoney ne ricavò il valore: E ≈ 10−20 C. A questa carica unitaria (quantità definita di elettricità) Stoney, come ricordato prima, darà il nome di elettrone.
Come mai J. J. Thomson nel 1897 non utilizzò questo valore di carica elettrica per ricavare la massa dei suoi corpuscoli, visto che aveva già ricavato il valore del rapporto carica/massa? In altri termini: come mai Thomson chiamò le particelle dei raggi catodici “corpuscoli” e non “elettroni”? Questo gli avrebbe permesso facilmente di avvalorare l’ipotesi di considerare i corpuscoli come particelle subatomiche.
Un conto era pensare, come sino a quel momento si era pensato, che gli atomi o le molecole contenessero una o più cariche unitarie e che queste, come per primo aveva suggerito Stoney, stessero alla base dei legami chimici e dei fenomeni elettrolitici. L’atomo, in questo modo, risultava certamente una struttura complessa, ma pur sempre indivisibile. Un altro conto, invece, era supporre, come fece Thomson nel 1897, che l’atomo non solo fosse costituito da particelle materiali cariche – i corpuscoli – ma che esso potesse rompersi e scindersi in questi corpuscoli: in questo caso l’indivisibilità dell’atomo, che, fino a quel momento, non era mai stata messa in discussione, veniva a cadere. Ribadiamo che questo è un passaggio cruciale, che andrebbe adeguatamente puntualizzato e valorizzato in ambito didattico; non solo la fisica, ma anche la chimica dopo Thomson volta pagina: non solo i fenomeni vengono interpretati e reinterpretati in un’ottica completamente diversa, ma ad esempio, vengono formulate le prime teorie sul legame chimico (si ricorda che la prima formalizzazione della teoria di Lewis è del 1901-1902). Da questo ben si capisce che elettrone da un lato e corpuscolo dall’altro, erano nati e continuavano a presentarsi come due entità non necessariamente legate fra loro e come tali dovevano essere trattate.
Pertanto, tra il 1897 e il 1899 Thomson intraprese un intenso programma di ricerca con l’obiettivo di ottenere una misura diretta della carica del corpuscolo (conseguentemente anche la massa). Non essendo riuscito in questo intento con i raggi catodici, Thomson prese in esame nuove fenomenologie in cui erano coinvolti corpuscoli con lo stesso rapporto carica/massa di quelli dei raggi catodici, ma che, a differenza di questi, consentivano una misura diretta della carica. Le fenomenologie studiate riguardarono principalmente il comportamento:
di un gas investito da una radiazione di raggi X
di una superficie metallica colpita da una radiazione ultravioletta
di un filamento metallico o di carbone portato all’incandescenza
La tecnica innovativa che permise tali misure si basò sulla cosiddetta “camera a nebbia di Wilson”,[8] una metodica che si è rilevata fondamentale nello studio delle particelle subatomiche e che, per ragioni di tempo, non possiamo trattare.
Solo alla fine di questo programma di ricerca Thomson poté verificare che il suo corpuscolo e l’elettrone di Stoney erano la stessa cosa, unendo così due aspetti della realtà che fino ad allora erano sembrati due entità distinte. Particolarmente interessanti e pregnanti sono le conclusioni dei suoi lavori, che Thomson trasse nell’articolo del 1899 e delle quali riportiamo quelle che ci riguardano più da vicino.
Gli esperimenti appena descritti, presi congiuntamente ai precedenti sul valore di m/e per i raggi catodici, mostrano che nei gas a basse pressioni l’elettricità negativa, anche se prodotta con mezzi diversi, è costituita da unità dotate ciascuna di una determinata carica negativa; l’entità di questa carica negativa è di circa 6 × 10 −10; elettrostatiche [1,8 × 10 −19 C] ed è uguale alla carica positiva trasportata dall’atomo di idrogeno nell’elettrolisi delle soluzioni. Nei gas a bassa pressione queste unità di carica elettrica negativa sono sempre associate a portatori di una determinata massa. Questa massa è estremamente piccola, essendo solo circa 1,4 × 10 −3 di quella dello ione idrogeno, la massa più piccola finora riconosciuta come capace di un’esistenza separata.
Da quel momento in poi le misurazioni della carica del corpuscolo, utilizzando la camera a nebbia, si affinarono sempre più, sia per migliorare la misura della carica sia per ricavare altre costanti universali, come il numero/costante di Avogadro. A tal riguardo, il contributo teorico e sperimentale di Millikan risultò fondamentale. Nel 1913 Millikan, utilizzando una camera a nebbia opportunamente modificata, ottenne per la carica elementare, e quindi anche per l’elettrone, un valore medio di 1,592 × 10 −19 ± 0,003 × 10 −19 C (un valore che differisce di meno del 1% da quello attuale che è 1,6021892 × 10 −19 ± 0,0000046 × 10 −19 C) e, conseguentemente, ricavò un valore della costante di Avogadro con un’accuratezza mai vista prima.
La produzione di elettrificazione negativa comporta quindi la scissione di un atomo, poiché da un insieme di atomi si stacca qualcosa la cui massa è inferiore a quella di un singolo atomo… i corpuscoli distaccati si comportano come ioni negativi, portando ciascuno una carica negativa costante, che chiameremo per brevità carica unitaria ... I cambiamenti nella carica elettrica su un atomo sono dovuti ai corpuscoli che si spostano dall’atomo quando la carica positiva aumenta, o ai corpuscoli che si spostano verso di esso quando la carica negativa aumenta. Così quando anioni e cationi vengono liberati agli elettrodi nell’elettrolisi delle soluzioni, lo ione con carica positiva viene neutralizzato da un corpuscolo che si sposta dall’elettrodo allo ione, mentre lo ione con carica negativa viene neutralizzato da un corpuscolo che passa dallo ione all’elettrodo. I corpuscoli sono i veicoli attraverso i quali l’elettricità viene trasportata da un atomo all’altro.[9]
Nessuno prima di Thomson si era espresso in questi termini. Come ebbe a dire Bohr (1926), Thomson, concependo l’elettrone come parte integrante di una teoria della struttura della materia, “ha aperto le porte a una terra sconosciuta alla scienza” e ha determinato una svolta epocale nella lunga ricerca per comprendere la “struttura della materia e la natura dell’elettricità”. Una svolta che ha gettato una luce completamente nuova e feconda anche sui fenomeni elettrochimici.
Il concetto di “trasferimento di elettroni fra atomo e atomo” nasce e prende corpo da queste idee, scaturite, per l’appunto, dal lavoro di Thomson. Non da ultimo, in questo articolo risulta ancor più evidente il carattere innovativo del significato che egli attribuì al termine “elettrone” rispetto a Stoney e che, per certi versi, ne giustifica anche la paternità della “scoperta”.
Da tale nuova visione dei processi elettrochimici, nel volgere di pochi anni, si affermò anche un nuovo modo per bilanciare le reazioni basato sulla conservazione degli “elettroni corpuscolo”, cioè degli elettroni atomici. Un modo che si aggiunse ad altri metodi già messi a punto dai chimici nel corso della seconda metà del 1800, come ad esempio, il metodo della conservazione della valenza.
A seguito della generalizzazione dell’ossidazione come aumento di valenza e la riduzione come diminuzione della valenza, la quantità conservata diviene ora il cambiamento di valenza:3Cu(s) + 8HNO3(aq) → 3Cu(NO3)2(aq) + 2NO(g) + 4H2O(l)
ossidazione: [Cu0 → CuII (NO3)2] guadagno di valenza = ΔV = 2
riduzione: [H(NVO3) → NIIO] perdita di valenza = ΔV = 3
Da cui:
ossidazione: 3[Cu0 → CuII (NO3)2] guadagno di valenza netto = 3 × ΔV = 3 × 2 = 6
riduzione: 2[H(NVO3) → NIIO] perdita di valenza netta = 2 × ΔV = 2 × 3 = 6
Questo approccio fu per la prima volta articolato dal chimico americano Otis Coe Johnson nel 1880.[10]
La proposta di Johnson[11] è, per certi versi, sbalorditiva nella sua attualità:
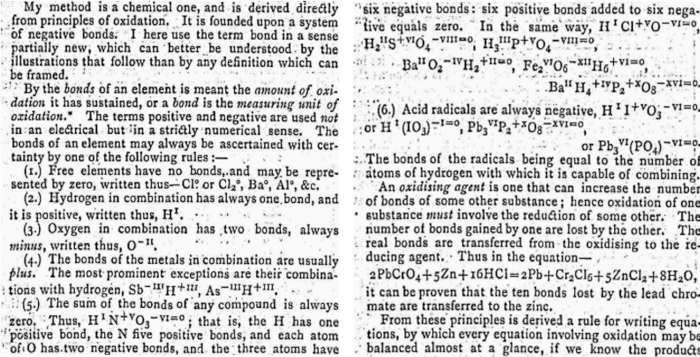 |
Dopo Thomson, il bilanciamento delle reazioni redox con il metodo delle due semi-reazioni basato sulla conservazione degli elettroni atomici, si impose a quello proposto da Johnson, basato invece sulla conservazione della valenza, come dimostrato da una serie di importanti contributi pubblicati all’inizio del 1900 (Fry 1912, Fry 1914, Fry 1915, Brinkley 1925, Jette e La Mer 1927, Hall 1929). Per brevità, ne citiamo uno (quello che, in poche battute, chiarisce molto bene questo punto):[12]
La teoria di Johnson della riduzione e dell’ossidazione è sorprendentemente simile alle visioni più moderne; tanto è vero, infatti, che quando la teoria elettronica fu enunciata per la prima volta, ogni insegnante che aveva usato il metodo di scrittura delle equazioni di Johnson vide subito l’applicazione della teoria elettronica alle reazioni di ossido-riduzione. A dire il vero, Johnson ha enfatizzato i legami negativi, ma quello che ha detto sui legami negativi si può dire di quelli che oggi chiamiamo elettroni.[13]
Completiamo ora questa presentazione soffermandoci ad analizzare un ultimo contributo, che è una parte molto importante della nostra narrazione e che non è stato ancora affrontato. Ci riferiamo alla Teoria della dissociazione elettrolitica di Arrhenius (1884 - 1887). Una teoria che rappresenta un tassello fondamentale del contesto che stiamo delineando. Se Thomson nel 1899 è giunto alle conclusioni che abbiamo visto prima e parla di “trasferimento di elettroni fra atomo e atomo”, è stato grazie anche al contributo decisivo di Arrhenius il fatto di aver chiarito, ad esempio, che gli ioni Na+ e Cl– sono già presenti nella soluzione acquosa di NaCl e non vengono, invece, generati dalla d.d.p. che viene applicata alla cella contenente la soluzione salina, come fino a quel momento si era pensato. Questo è un passaggio cruciale che verrà approfondito nella parte che segue.
Dagli esperimenti di Michael Faraday era noto che una parte positiva e una parte negativa di una molecola potessero migrare verso gli elettrodi a carica opposta della cella elettrolitica sotto l’influenza dell’elettricità. La teoria della dissociazione elettrolitica fu pubblicata da Svante Arrhenius nel 1887 e si riferisce al discioglimento in acqua di acidi, basi e sali che si dividono spontaneamente in ioni carichi positivamente e negativamente.[14] Già nella sua tesi di dottorato del 1884 aveva fatto cenno alla teoria, ma a causa della contrarietà del suo mentore, il Professor Teodor Cleve, scelse di parlare di parti attive e inattive della molecola. Le prove raccolte da Arrhenius a sostegno della sua teoria sono presenti nella pubblicazione del 1887 e sono poi ampiamente argomentate nel suo libro di testo sull’elettrochimica,[15] nella Nobel Lecture del 1903 e nella sua conferenza Silliman a New Haven.[16]
I risultati di queste prove sono ben sintetizzati da Kevin De Berg[17] e riguardano esperimenti di conducibilità elettrica, di depressione del punto di congelamento, di pressione osmotica e di abbassamento della pressione di vapore.
La conducibilità elettrica
Il fatto che le soluzioni saline conducano elettricità per Arrhenius era di supporto all’esistenza di specie cariche. Particolarmente significativa era la relazione fra la conduttività e il grado di diluizione del sale.
A mano a mano che la diluizione aumentava, la conducibilità molare aumentava fino a raggiungere un valore limite. Arrhenius propose che esistesse una parte attiva e una parte inattiva e la proporzione della parte attiva aumentasse con la diluizione secondo lo schema:
AB → A+ + B-
A diluizione infinita esistono solo le due specie dissociate e il grado di dissociazione può essere calcolato come il rapporto fra la conduttanza molare a qualsiasi concentrazione e quella a diluizione infinita (Figura 1).
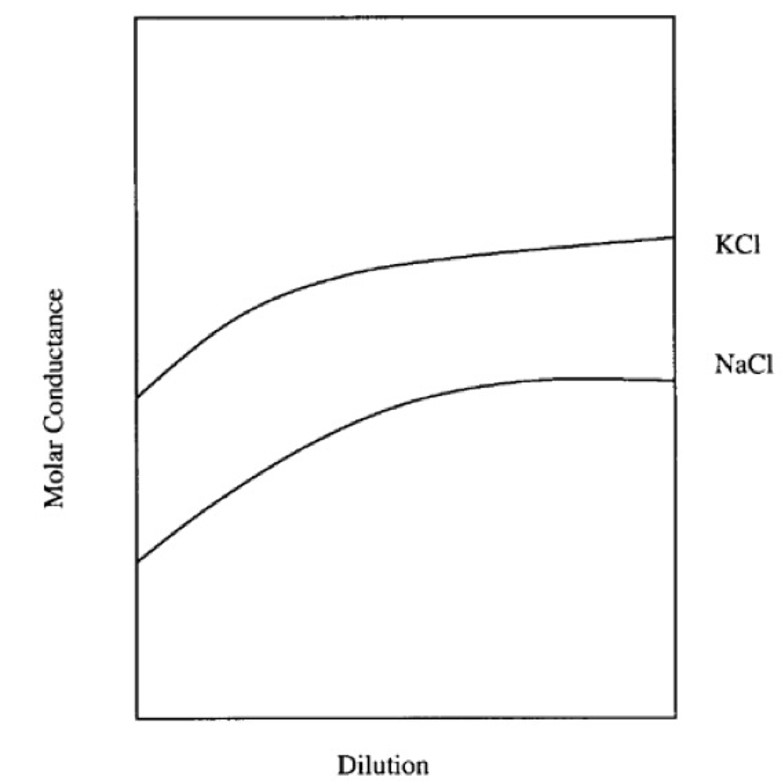 |
Figura 1. Forma generale del
grafico della conduttanza molare contro la diluizione per due
soluzioni saline, NaCl e KCl (nessuna unità di misura indicata da
Arrhenius); tratto da De Berg, 2003
Wilhelm Ostwald diede un gran sostegno ad Arrhenius e alle sue idee sulla dissociazione elettrolitica (Legge della diluizione di Ostwald). Nel 1888 applicò la legge dell’equilibrio all’equazione di ionizzazione parziale:
AB ⇄ A+ + B-
E dedusse che il rapporto α2c/(1-α) doveva essere una costante, dove α è il grado di dissociazione e c la concentrazione dell’elettrolita in acqua.
Come si evince dalla figura 2, su una variazione di concentrazione di 15000, i valori della costante cambiano di circa il 14% e non è, quindi, irragionevole supporre che il rapporto sia effettivamente costante. Questo significa che il grado di dissociazione aumenta con la diluizione.
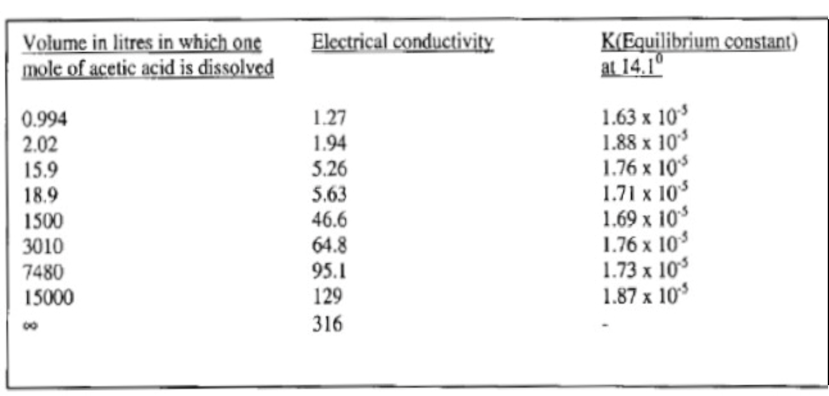 |
Figura 2. Dati sulla costante di
equilibrio per l’acido acetico basati sui risultati di van’t Hoff;
tratto da De Berg, 2003
La depressione del punto di congelamento
Arrhenius studiò i dati di Raoult sull’abbassamento del punto di congelamento (Figura 3). Rispetto a un fattore di abbassamento molecolare calcolato di 18,6 per molecole non dissociate in soluzione, notò che un certo numero di soluzioni davano valori molto diversi da quelli attesi (da 1,66 a 2,10 volte superiori al valore calcolato). Arrhenius attribuì alla dissociazione in ioni gli effetti anomali sul punto di congelamento.
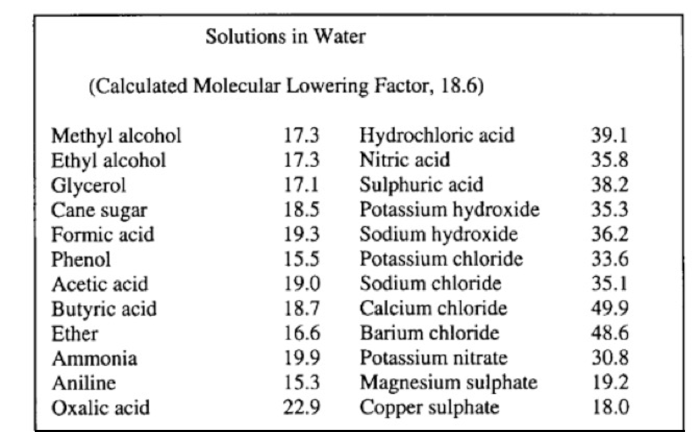 |
Figura 3. Risultati ottenuti da
Raoult relativi all’abbassamento molecolare del punto di congelamento
per soluzioni in acqua; tratto da De Berg, 2003
La pressione osmotica
Van’t Hoff, contemporaneo di Arrhenius, osservò che la pressione osmotica soddisfaceva un’equazione simile all’equazione del gas ideale con le moli di gas sostituite dalle moli di soluto e il volume del recipiente del gas sostituito dal volume della soluzione:
P = (n/V) × RT π = c × RT
Le soluzioni saline come il cloruro di sodio davano pressioni osmotiche quasi doppie rispetto a quelle previste e Arrhenius notò che questo poteva essere spiegato sulla base della dissociazione ionica.
Nel suo libro del 1902 Arrhenius utilizzò i risultati di De Vries del 1888, riguardanti i coefficienti isotonici che rappresentano le concentrazioni di soluzioni richieste per pressioni osmotiche uguali, basate su un valore di 3 per il nitrato di potassio (Figura 4). Una soluzione di 3 mol/L di glicerolo avrebbe, pertanto, la stessa pressione osmotica di una soluzione di nitrato di potassio contenente 1,78 mol/L.
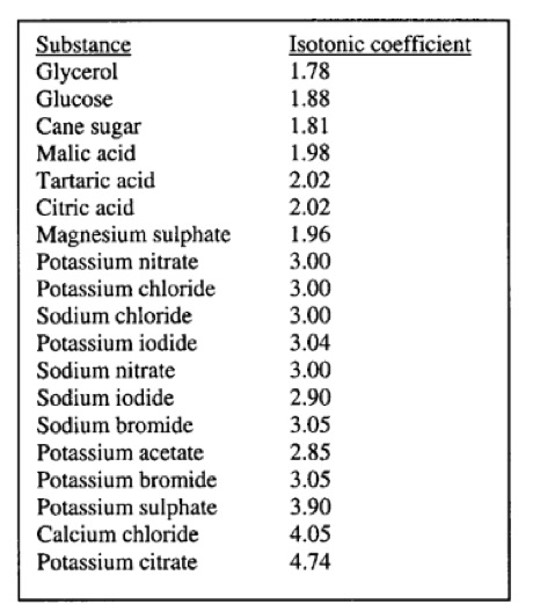 |
Figura 4. Coefficienti isotonici
per differenti soluzioni, assumendo valore 3 per la soluzione di
nitrato di potassio; tratto da De Berg, 2003)
L’abbassamento della pressione di vapore
Nella tabella riportata da Arrhenius nel 1902[18] sali monovalenti abbassano la pressione di vapore di quasi il doppio rispetto a ciò che ci aspetterebbe senza dissociazione e sali trivalenti, come ad esempio CaCl2, la abbassano di circa 2,5 volte (Figura 5).
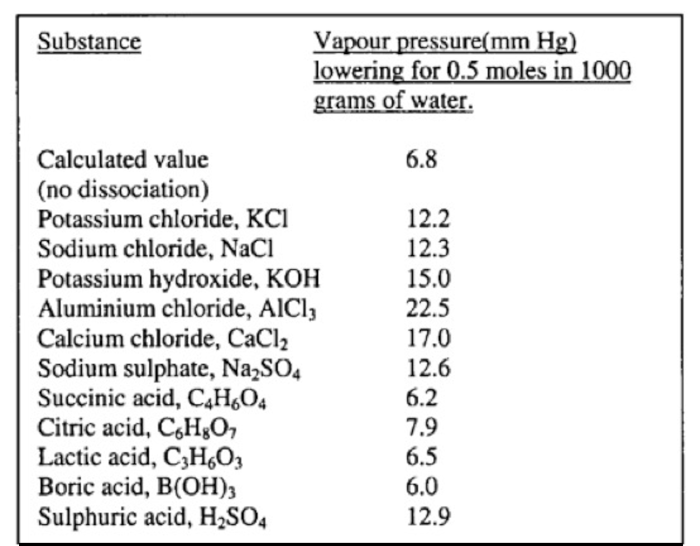 |
Figura 5. Abbassamento della
pressione di vapore (mmHg) per 0,5 moli di sostanza dissolta in 1000 g
di acqua; tratto da De Berg, 2003
Arrhenius, Ostwald e van’t Hoff si convinsero che tutte le proprietà citate (conducibilità elettrica, depressione del punto di congelamento, pressione osmotica, abbassamento della pressione di vapore) dipendessero dalla dissociazione parziale in ioni.
Anche altre proprietà, come ad esempio il calore di neutralizzazione acido/base (quantità equivalenti di calore indipendenti dall’entità dell’acido e della base), venivano considerate importanti per giustificare l’ipotesi della dissociazione elettrolitica.
In generale si notava in queste proprietà una dipendenza dal numero di specie in soluzione.
Le obiezioni alla teoria della dissociazione elettrolitica, come sintetizzato da De Berg,[19] riguardavano principalmente l’esistenza in soluzione degli ioni di carica opposta che avrebbero dovuto in qualche modo ricombinarsi.
Scrive E. F Herroun nel 1896 “Perché gli ioni, se liberi di muoversi sotto l’influenza di forze elettriche esterne, non si attraggono con forze immense se sono carichi di tali enormi quantità di elettricità positiva e negativa…da dove hanno preso queste cariche in primo luogo?”
E Pickering si chiede: “Possono gli atomi, per esempio il cloro e l’idrogeno, uniti così saldamente insieme, volare via spaventati l’uno dall’altro al solo avvicinarsi di alcune molecole d’acqua, che sono rappresentate come più o meno inerti e prive di qualsiasi forte attrazione per gli atomi dissociati? [Possono questi atomi] così fortemente carichi di elettricità di segno opposto, vagare nel liquido con un supremo disprezzo per i loro precedenti associati e le cariche attrattive che essi portano?”
Del resto, Armstrong nel 1896[20] aveva chiamato la nuova teoria “l’ipotesi non sensata della dissociazione ionica” (che asserisce che il cloruro di idrogeno e alcuni altri composti cadano a pezzi quando si dissolvono in acqua). L’idea di Armstrong (1896) e di Pickering (1897) era che la soluzione riguardasse un fenomeno di associazione con l’acqua piuttosto che un fenomeno di dissociazione in ioni.
Le proprietà della pressione di vapore, del punto di congelamento e dell’osmosi erano imputabili al numero di molecole di “idrone” libero (H2O). Quindi la depressione della pressione di vapore era dovuta a un minor numero di molecole di idrone libere disponibili nel liquido.
Nel caso della soluzione con acido cloridrico, secondo Armstrong, una molecola di HCl immobilizza due molecole d’acqua, con conseguente abbassamento della pressione di vapore.
Il ruolo del solvente era, quindi, considerato diverso dagli oppositori della teoria della dissociazione in ioni. Armstrong, tuttavia, rivendicava correttamente il ruolo dell’acqua nel processo di soluzione.
È interessante la posizione di W. Dampier Whetham: “La dissociazione degli ioni l’uno dall’altro non vieta l’ipotesi che gli ioni siano legati ad una o più molecole di solvente”.
Armstrong fu critico nei confronti di questa posizione considerata diplomatica e di compromesso.
L’idratazione degli ioni forniva un modo per conciliare le due teorie e un motivo per giustificare la dissociazione elettrolitica di un sale.
È curioso come Armstrong mise in discussione l’uso della misurazione fisica e delle formule chimiche derivate dagli esperimenti in una disciplina come la chimica.
Armstrong nel 1928, citando Sir Oliver Lodge, disse che “i chimici si sono lasciati ingannare da un’infarinatura di quasi matematica e da un eccesso di formule empiriche” e che “il chimico fisico non è stato né chimico, né fisico nel cuore. La mutazione da chimico a chimico fisico sembra aver certamente comportato la perdita del fattore primario della chimica: il sentimento chimico”. Aggiunse anche che Pickering (verso la fine della sua carriera) “cadde vittima della malattia moderna, la misurazione fisica, inevitabile, senza dubbio, come il morbillo”.[21]
Armstrong rimase un acerrimo oppositore anche quando W. L. Bragg pubblicò i risultati del suo studio a raggi X del cloruro di sodio e concluse che non esistevano molecole di cloruro di sodio, NaCl, ma ioni sodio e cloruro distribuiti a scacchiera in un reticolo tridimensionale. Infatti, nel 1927 sentenziò definitivamente che questo modello “è ripugnante al senso comune, assurdo all’ennesima potenza … La chimica non è né scacchi, né geometria, qualunque sia la fisica dei raggi X”.
Il modello di Bragg dava grande sostegno alla teoria della dissociazione ionica, poiché si poteva concludere che gli ioni esistevano già nel solido e il processo di soluzione semplicemente li separava.
De Berg nel 2004[22] ha citato proprio l’esempio della storia della dissociazione elettrolitica, per illustrare la differenza fra la storia della scienza e il suo utilizzo nell’insegnamento. Ha chiamato storia pedagogica la contestualizzazione storica che permette di capire lo sviluppo delle idee scientifiche.
Una storia pedagogica si differenzia dai casi di storia della scienza (HOS) pubblicati da Klopfer… in quanto include informazioni relative all’insegnamento e all’apprendimento di un particolare concetto tratte dalla letteratura di ricerca. Lo scopo dello sviluppo di una storia pedagogica di un concetto chimico è quello di mostrare agli studenti come un’idea chimica sia stata sviluppata da informazioni rudimentali a un concetto sostanziale, utilizzando importanti informazioni sulle concezioni alternative che gli studenti hanno dimostrato di possedere e combinandole con importanti considerazioni storiche e filosofiche tratte dalla letteratura. La storia e la filosofia sono state concepite per ridare vita a ciò che Norman Robert Campbell (1953) ha definito "le ossa secche della conoscenza da cui è partito il respiro". La conoscenza di concezioni alternative ha lo scopo di aiutare gli studenti a passare da quelle che spesso sono conoscenze di senso comune a conoscenze scientifiche.
[1] J. J. Thomson, Cathode rays, Philosophical Magazine, 1897, 44, 293-316.
[2] G.E. Smith, J. J. Thomson and the electron: 1897-1899. An Introduction, The chemical Educator, 1997, 2, 1-42.
[3] J. J. Thomson, Cathode rays, Philosophical Magazine, 1897, 44, 293-316.
[4] R. Maiocchi, La “Belle epoque” dell’atomo, Franco Angeli, 1988.
[5] J. Dewey, Come pensiamo, La Nuova Italia, 1999.
[6] J. J. Thomson, Cathode rays, Philosophical Magazine, 1897, 44, 293-316.
[7] G. J. Stoney, Of the “electron”, or atom of electricity, Philosophical Magazine, 1894, 38, 418-420.
[8] Per questa invenzione, C. R. T. Wilson verrà insignito del premio Nobel per la Fisica nel 1927.
[9] J. J. Thomson, On the masses of the ions in gases at low pressures, Philosophical Magazine, 1899, 48, 547-567.
[10] W. B. Jensen, Balancing redox equation, Journal of Chemical Education, 2009, 86, 681-682.
[11] O. C. Johnson, Negative bonds and rule for balancing equations, Chem News, 1880, 42, 51.
[12] Occorrerà però aspettare la ponderosa opera di W. M. Latimer del 1938 sugli stati di ossidazione degli elementi e sui potenziali di ossidazione per una definizione più puntuale di stato di ossidazione e numero di ossidazione.
[13] W. T. Hall, Oxidation-reduction reactions, Journal of Chemical Education, 1929, 6, 479-485.
[14] S. Arrhenius, Über die dissociation der in wasser gelösten stoffe, Zeitschrift fur Physicalische Chemie, 1887, 631-648.
[15] S. Arrhenius, Textbook of Electrochemistry (translated by John McCrae), Longmans, London, 1902.
[16] S. Arrhenius, Electrolytic dissociation, Journal of the American Chemical Society,1912, 34, 353-364.
[17] K. C. De Berg, The development of the theory of electrolytic dissociation, Science & Education, 2003, 12, 397-419.
[18] S. Arrhenius, Textbook of Electrochemistry (translated by John McCrae), Longmans, London, 1902.
[19] K. C. De Berg, The development of the theory of electrolytic dissociation, Science and Education, 2003, 12, 397-419.
[20] H. E. Armstrong, Letters to the editor, Nature, 1896, 55, 78-79.
[21] H. E. Armstrong, The nature of solutions, Nature, 1928, 121, 48-51.
[22] K. C. De Berg, The development and use of a pedagogical history for a key chemical idea: the case of ions in solution, Australian Journal of Education in Chemistry, 2004, 64, 16-19.