Indice
- Premessa
- Introduzione
- Il significato di elemento secondo il Gold Book della IUPAC
- Il Punto di Vista di Paneth
- L’Errore di Paneth
- Interpretazione microscopica del molteplice significato di elemento
- Un curioso dilemma in chimica
- Un’applicazione diretta del concetto astratto di elemento alla risoluzione della questione del gruppo 3
- Un argomento conclusivo a favore di Sc, Y, Lu, Lr
- Conclusioni
- Ringraziamenti
- Riferimenti
Abstract: This contribution takes up some problems exposed in the first chapter of the book “What is a Chemical Element?”, edited by Eric Scerri and Elena Ghibaudi, and published in 2020 by the Oxford University Press. It concerns a series of still open questions relating to chemical elements starting from the double meaning of the term “element”, which goes back to Lavoisier who identified the element with the simple substance and Mendeleev who considered the element as something present in simple substances and compounds but not detectable by our senses. These two meanings were later highlighted by Paneth in his double definition of simple substance and basic substance respectively. Paneth argued that these two meanings must remain separate if the fundamental principle of chemistry that elements persist in their compounds is to be affirmed. Unfortunately, IUPAC admits the double definition of element, thus fostering conceptual confusion between simple substance and element, which must necessarily be recognized a formal character expressed by its symbol and atomic number (which replaced Mendeleev's atomic weight after the discovery of isotopes). Chemists know how handle these double meanings of element, but this is not the case for students who encounter difficulties. We sincerely hope that these may help readers to better understand this concept, also considering that this problem is usually overlooked in textbooks who often speak of elements as simple substances with all their macroscopic properties, not present in their compounds, to the detriment of the more important formal meaning that underlie the periodic table.
Keywords: elemento chimico; elemento astratto; sostanza semplice; sostanza di base
Nel 2020 la Oxford University Press pubblica il libro “What is a Chemical Element?”, una raccolta di 14 articoli sul concetto di elemento chimico a cura di Eric Scerri ed Elena Ghibaudi. La domanda che si pone il libro deriva dal fatto che, nonostante la definizione di elemento sia un tema ampiamente dibattuto da chimici, filosofi della chimica, storici della chimica e docenti di chimica, ad oggi non c’è ancora un accordo.
Questo contributo riprende alcune problematiche esposte nel primo capitolo del libro: si tratta di questioni aperte relative al duplice significato del termine “elemento” che nasce con Lavoisier e Mendeleev.
Sulla questione concettuale di elemento chimico potrebbe nascere una sfida tra il chimico e il filosofo della chimica, che potrebbe risultare vincitore evidenziando i limiti di una visione positivista della chimica, prevalente ma non dichiarata. Per superare alcuni ostacoli il filosofo della chimica comincia a informare il chimico sulla duplice natura del concetto di elemento: da un lato elemento è la sostanza familiare, l’ultimo stadio della decomposizione chimica (Lavoisier); dall’altro è un portatore astratto di proprietà, privo di per sé di proprietà chimiche (cosa abbastanza strana per il chimico).
Il filosofo deve cercare di spiegare meglio tale concetto al chimico, ricorrendo a esempi. Quando si indica un elemento particolare della Tavola Periodica, ad esempio il carbonio, non si intende nessun particolare allotropo, sia esso grafite o diamante o anche fullerene. Il chimico capisce subito che ci si sta riferendo agli allotropi e non alla nozione astratta o più generale di carbonio, cioè il significato filosofico di elemento. A questo punto il chimico potrebbe iniziare a prestare più attenzione, contrariamente alla sua consueta abitudine di pensare che i filosofi della chimica non sono d’aiuto alla comprensione scientifica. Utilizzando sempre il carbonio come esempio, il filosofo della chimica chiede al collega se parlando di 12C, 13C o 14C ci riferiamo all’elemento carbonio della Tavola Periodica. Ciò̀ a cui si fa riferimento è qualcosa come un atomo medio dell’elemento carbonio e non un particolare isotopo.[1]
A questo punto il chimico sarebbe portato a concordare su tutto quanto affermato dal filosofo, concludendone però che ciò non giustifica il pensare all’elemento chimico in senso astratto. È colpa della Tavola Periodica se gli allotropi e gli isotopi non sono in essa contemplati.
Per cercare di convincere il chimico della necessità di una concezione astratta di elemento, il filosofo della chimica considera allora la reazione tra sodio (metallo velenoso) e cloro (gas velenoso) che genera cloruro di sodio (sostanza non velenosa, ma anzi essenziale per la vita):
2 Na + Cl2 → 2 NaCl
Dove sono presenti, nel cloruro di sodio, il metallo sodio e il gas cloro? Di sicuro non come sostanze elementari, quindi sarebbe meglio pensare all’elemento in senso astratto. Il chimico potrebbe però obiettare, appellandosi a una spiegazione ultra-microscopica, dicendo che sodio e cloro sono presenti come ioni. In genere, i chimici sono completamente ignari del duplice significato di elemento, nonostante se ne siano interessati chimici come Mendeleev, Urbain e Paneth, le cui opinioni sono considerate antiquate dai chimici contemporanei. Malgrado questo rifiuto, molti chimici ammettono di essere turbati dall’attuale definizione di “elemento” presente nel Gold Book.
Il Gold Book pubblicato dalla IUPAC (Unione Internazionale di Chimica Pura e Applicata) contiene una grande quantità di informazioni su nomenclatura e definizioni, soprattutto di chimica inorganica.[2] Alla voce elemento si trova:
una specie di atomi; tutti gli atomi con lo stesso numero di protoni nel nucleo atomico;
una sostanza chimica pura composta da atomi con lo stesso numero di protoni nel nucleo atomico. Talvolta questo concetto è chiamato sostanza elementare distinta dall’ele-
mento chimico definito sopra, ma per lo più il termine elemento chimico è usato per entrambi i concetti.
La definizione assume una duplice forma: la prima parte richiede pochi chiarimenti e sembra essere un semplice richiamo ai componenti microscopici così da poter identificare qualsiasi specifico elemento mediante il numero atomico, come introdotto da Van den Broek e da Moseley nei primi anni del Novecento.[3] La seconda parte della definizione è molto più problematica: il riferimento a una sostanza pura sembrerebbe riferirsi a campioni macroscopici di elementi come sostanze semplici, in possesso di proprietà come il colore, il punto di fusione e così via. Tuttavia, questo apparente richiamo a sostanze semplici è subito collegato in modo disagevole alla prima definizione e al numero di protoni nel nucleo di tali elementi. La frase finale crea una confusione ancora maggiore tracciando, a questo punto, una distinzione tra ciò che viene semplicemente definito elemento e ciò̀ che i filosofi chiamano elemento astratto. Infine, si aggiunge che entrambi i concetti sono generalmente indicati con il termine elemento chimico, il che ovviamente fa nascere la domanda: cosa è un elemento chimico? Si poteva sperare in una definizione che distinguesse i due concetti il più chiaramente possibile, ma la definizione del Gold Book sembra sfiorare la questione, senza fare molta chiarezza su di essa. Per riassumere la definizione del Gold Book, si potrebbe dire che per i chimici il significato astratto di elemento è identificato solo microscopicamente, tramite il suo numero atomico, mentre l’elemento come sostanza semplice è identificato con l’essere una sostanza chimica pura. Come si può notare per il Gold Book, le sostanze semplici non sembrano meritare una definizione indipendente da quella microscopica data nella prima definizione.[4]
L’ultimo tentativo del filosofo della chimica di convincere il chimico fa riferimento al lavoro di Dimitrij Mendeleev, il principale scopritore della Tavola Periodica (Figura 1), che molto scrisse sulla natura degli elementi.[5]
 |
Figura 1. Tavola Periodica di
Mendeleev del 1871 che mostra gli elementi previsti con pesi atomici
di 44, 68, 72 e 100; questi elementi furono tutti scoperti in seguito
e chiamati rispettivamente scandio, gallio, germanio e tecnezio
(Fonte: Zhurnal Russkeo Fiziko-Khimicheskogo
Obshchestva, 1871, 3,
25-56)
L’interesse dei filosofi della chimica per il significato astratto di elemento ha origine con il lavoro di Mendeleev e con un articolo su questo argomento del filosofo-chimico Fritz Paneth, scritto nel 1931 [3] e tradotto in inglese dal figlio Heinz Post nel 1962 [4].
Ecco alcune citazioni di Mendeleev riguardanti il duplice significato del concetto di elemento:
È utile in questo senso fare una netta distinzione tra la concezione di elemento come sostanza omogenea separata, e come parte materiale ma invisibile di un composto. L’ossido di mercurio non contiene due corpi semplici, un gas e un metallo, ma due elementi, mercurio e ossigeno, che, quando sono liberi, sono un gas e un metallo. Né il mercurio come metallo né l’ossigeno come gas è contenuto nell’ossido di mercurio; quest’ultimo contiene solo la sostanza dell’elemento, proprio come il vapore contiene solo la sostanza del ghiaccio, ma non il ghiaccio stesso, o come il mais contiene la sostanza del seme, ma non il seme stesso [5].
L’ultima parte di questa citazione suggerisce che Mendeleev stia richiamando la distinzione aristotelica tra atto e potenza. Paneth vuole evidenziare il punto di vista di Mendeleev, ossia che la Tavola Periodica sia principalmente una classificazione degli elementi in questo secondo significato astratto, non nel significato di corpi semplici, quando scrive: “Pertanto, nei termini della distinzione qui introdotta, possiamo riferirci solo a un sistema naturale [sistema periodico] di sostanze di base (basic substances) non di sostanze semplici (simple substances)” [4, p. 152].
Mendeleev sostiene anche che gli elementi in senso più astratto siano caratterizzati solo dal loro peso atomico e che non abbiano “proprietà” nel senso comune del termine. In precedenti pubblicazioni è stato suggerito che questo è il motivo per cui Mendeleev potè superare i suoi competitori nel fare le sue previsioni su eka-boro, eka-alluminio, eka-silicio, eka-manganese, che una volta scoperti furono chiamati scandio, gallio, germanio, tecnezio [6].
Mendeleev ebbe la meglio su Lothar Meyer perché per primo si rese conto che gli elementi astratti dovevano essere considerati più fondamentali rispetto alle sostanze semplici poiché, in quanto astratti, persistono nei loro composti e, di conseguenza, se il sistema periodico doveva essere di fondamentale importanza, avrebbe dovuto classificare principalmente elementi astratti. Poiché l'astrazione è essenziale per la generalizzazione, Mendeleev fu naturalmente portato a dare maggiore importanza alla concezione astratta di elemento piuttosto che a quella più concreta di elemento come sostanza semplice.
Le previsioni fatte da Mendeleev furono quindi concepite con in mente gli elementi astratti. Se i dati osservazionali disponibili sulle sostanze semplici puntavano in una certa direzione, queste caratteristiche potevano essere trascurate, confidando che le proprietà̀ dei più fondamentali elementi astratti avrebbero potuto essere diverse da quanto osservato fino a quel momento nella forma di una particolare sostanza semplice. Naturalmente, qualsiasi previsione alla fine avrebbe dovuto essere realizzata isolando una corrispondente sostanza semplice, poiché gli elementi, nel significato più sottile del termine, sono al di là dell’osservazione, tranne che per la proprietà misurabile del peso atomico.
Poiché Mendeleev cercava di classificare elementi astratti, non sostanze semplici, egli non fu ingannato da nessuna proprietà chimica non essenziale. Ad esempio, gli elementi del gruppo degli alogeni (fluoro, cloro, bromo e iodio) sembrano essere piuttosto diversi l’uno dall’altro quando ci si concentra su di essi come sostanze semplici isolabili, poiché, rispettivamente, due sono allo stato gas, uno è un liquido e un altro è solido. Le somiglianze tra i membri del gruppo sono più evidenti se si considerano i composti che ciascuno di essi forma, per esempio con il sodio, che sono tutti polveri bianche cristalline. Il punto è che in questi composti, fluoro, cloro, bromo e iodio, sono presenti non come sostanze semplici, ma in forma latente, o essenziale, come sostanze di base.
Questa visione degli elementi ha permesso a Mendeleev di sostenere la validità della legge periodica anche nei casi in cui le evidenze sperimentali sembravano puntare contro di essa. Tali convinzioni potevano essere il risultato della credenza, profondamente radicata, che la legge periodica si applicasse agli elementi astratti come sostanze di base e che questa legge fosse fondamentale e di pari status delle leggi della meccanica di Newton [6]. Se fosse stato più positivista, Mendeleev avrebbe facilmente perso di vista l’importanza della legge periodica e avrebbe potuto nutrire dubbi sulle sue previsioni e correzioni che coinvolgevano gli elementi conosciuti.
Mendeleev espresse i suoi punti di vista filosofici generali sulla natura della scienza quando scrisse sulla relazione tra “materia, forza e spirito”. Sosteneva che i problemi filosofici contemporanei derivassero da una tendenza a cercare un principio unificante, mentre egli prediligeva tre componenti fondamentali della natura: materia (sostanza), forza (energia) e spirito (anima). Tutto era composto da queste tre componenti e nessuna categoria poteva essere ridotta a nessuna delle altre. Secondo Michael Gordin, l’uso del termine spirito da parte di Mendeleev è un appello alla moderna nozione di essenzialismo, o a ciò che è irriducibilmente peculiare all’oggetto in questione. Gordin afferma anche che la posizione di Mendeleev è metafisica e lo allontana dalla “compagnia dei positivisti” [7].
Viene presentato ora un breve resoconto sulla duplice concezione di elemento da parte di Paneth già trattata ampiamente in precedenza da Scerri [8-13].
Negli anni Venti del secolo scorso, Paneth ricorse all’essenza metafisica degli elementi come sostanze di base al fine di salvare il sistema periodico da una grave crisi che stava affrontando in quanto erano stati scoperti molti nuovi isotopi degli elementi, il che significava che il numero di atomi o di unità più fondamentali improvvisamente sembrava essersi moltiplicato. La questione era se il sistema periodico dovesse continuare a ospitare gli atomi tradizionalmente considerati di ciascun elemento, o se dovesse essere ristrutturato per accogliere gli isotopi appena scoperti, che ora avrebbero potuto essere considerati i veri atomi. Paneth rispose che il sistema periodico doveva continuare a ospitare gli atomi chimici tradizionali e non i singoli isotopi degli elementi. Paneth probabilmente considerava gli isotopi come sostanze semplici caratterizzate dal loro peso atomico, mentre le sostanze di base erano caratterizzate dalla grandezza più fondamentale del numero atomico. Questo sarebbe coerente con l’idea che non sono le sostanze semplici a essere rappresentate principalmente nella Tavola Periodica, così come non lo sono i singoli isotopi degli elementi. Ecco alcuni passi rilevanti dei suoi scritti:
Ho suggerito di usare il termine sostanza di base (basic substance) ogni volta che vogliamo designare ciò che è indistruttibile nei composti. … e che dovremmo parlare di sostanza semplice (simple substance) quando ci riferiamo alla forma in cui tale sostanza di base, non combinata con nessun’altra, si presenta ai nostri sensi [14, pag. 65].
Non si possono attribuire qualità particolari a un elemento come sostanza di base, poiché contribuisce alla produzione di un’infinita varietà di qualità che esibisce sia da solo che in combinazione con altre sostanze di base [14, p.65].
Con il concetto di sostanza semplice, possiamo rimanere nel regno del realismo ingenuo. Quando si tratta della sostanza di base, tuttavia, non possiamo ignorare la sua connessione con il mondo trascendente senza cadere in contraddizione [14, p. 65].
Anche Paneth potrebbe essere considerato colpevole di aver seminato confusione su un dibattito già complicato quando scrive: “Ho preferito parlare di sostanza di base e di sostanza semplice come aspetti diversi del concetto chimico di elemento” [4, p. 155].
Questa affermazione potrebbe essere interpretata nel senso che l’elemento sia l’entità fondamentale, mentre la sostanza di base e la sostanza semplice siano in qualche modo secondarie, il che sarebbe sicuramente errato (Figura 2).
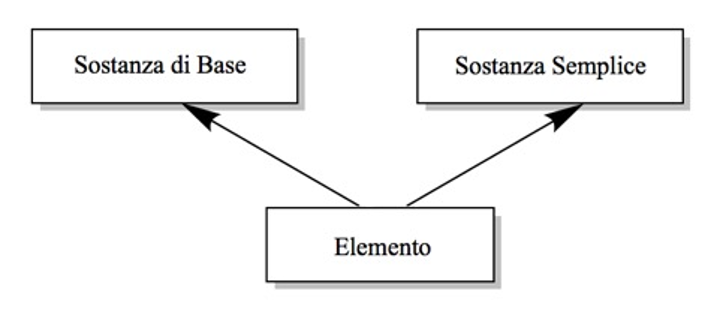 |
Figura 2. Una rappresentazione di
quella che sembra essere la visione errata di Paneth sulla relazione
tra sostanza di base (basic substance), elemento
e sostanza semplice (simple substance) (Fonte: E.
R. Scerri, Found. Chem., 2012,
14, 69-81)
In un lavoro precedente Scerri ha proposto una relazione a tre vie, allo scopo di chiarire questo particolare problema [13]. La sostanza di base nel senso di elemento non sta sullo stesso livello epistemologico della sostanza semplice, ma la assorbe, nello stesso modo in cui assorbe la sostanza semplice, quando è presente in combinazione con altre sostanze semplici (Figura 3). Lo schema mostrato assicura che sia questo il caso, ma al prezzo di avere ora tre tipi di elemento con cui misurarsi!
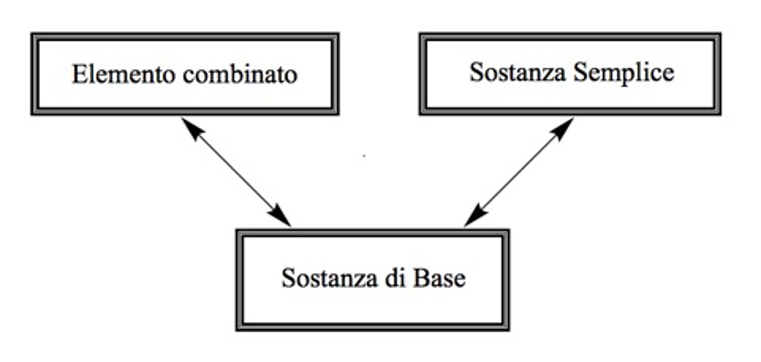 |
Figura 3. Proposta di relazione a
tre vie tra elemento combinato, sostanza di base e sostanza semplice
Anche se alcuni chimici contemporanei accettano la dualità filosofica per quanto riguarda il concetto di elemento, essi tendono a vedere la situazione in modo microscopico, invece che in modo macroscopico. Esaminiamo la possibilità di una interpretazione microscopica delle distinzioni tra il significato astratto di elemento, di elementi come sostanze semplici e, infine, come elementi combinati. Poiché il nucleo è la parte dell’atomo che rimane completamente invariata nel corso delle reazioni chimiche, esso sembrerebbe la scelta naturale per la controparte microscopica di elemento come sostanza di base. Allo stesso modo, il fatto che l’identità degli elementi risieda nel nucleo, piuttosto che negli elettroni che lo accompagnano, sembrerebbe supportare ulteriormente l’idea che il nucleo debba essere identificato con l’elemento come sostanza di base (Figura 4).
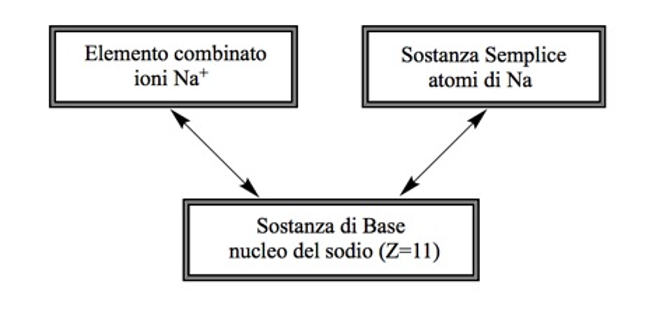 |
Figura 4. Proposta di
interpretazione microscopica della definizione a tre vie del concetto
di elemento
Quanto all’elemento come sostanza semplice, questo potrebbe essere identificato con l’intero atomo neutro, ovvero il nucleo con il relativo numero di elettroni orbitanti.[6] Ciò lascia da definire la nozione di elemento combinato, come introdotto nella sezione precedente, il quale nella sua forma microscopica deve sicuramente essere uno ione di qualsiasi elemento in questione, almeno nel caso del legame ionico. Una così semplice identificazione non può essere fatta nel caso di composti covalenti, anche se forse la nozione di Richard Bader di atomi nelle molecole potrebbe essere scelta per svolgere un tale ruolo [15].
Se si tentasse di fare affermazioni quantitative, o anche solo di eseguire calcoli sugli atomi di un qualsiasi elemento, con un insieme così semplicistico di identificazioni si potrebbe incorrere in seri problemi. Infatti, un approccio quantomeccanico al calcolo delle proprietà degli elementi e composti è condotto attraverso l’equazione di Schrödinger indipendente dal tempo, che a sua volta si occupa dell’interazione tra nuclei ed elettroni in ogni particolare caso atomico o molecolare.
Si potrebbe allora modificare la nostra precedente proposta, in modo che gli elementi come sostanze di base vengano identificati con l’intero atomo invece che solo con il nucleo. Inoltre, limitare la caratterizzazione degli atomi al solo loro numero di protoni ed elettroni sottovaluta pesantemente il comportamento chimico e fisico degli atomi. Parlando più in generale, non è il semplice numero di elettroni, né come occupano i vari tipi di orbitali, che fa sì che questi atomi si comportino in un certo modo. Dopotutto, come potrebbe solo un cambiamento di numero portare alle sottili differenze qualitative osservate e in alcuni casi a cambiamenti piuttosto inattesi che si verificano, per esempio, passando dall’oro solido (elemento 79) al mercurio liquido (elemento 80)?
Quindi, la nozione di configurazione elettronica di per sé non regge a un esame accurato e si rivela un esempio ultra-semplicistico di ciò che causa il comportamento chimico, supponendo che si voglia parlare in primo luogo di causalità.[7] Un moderno resoconto microscopico degli elementi come sostanze semplici deve, pertanto, fare molto di più che affermare semplicemente il numero di particelle elementari negli atomi di uno specifico elemento.
La causa delle proprietà di ogni atomo risiede nella complessa dinamica che esiste tra un particolare numero di elettroni e protoni nel nucleo in questione. Si consideri, ad esempio, la differenza tra un atomo di idrogeno e uno di elio. Nel caso dell’idrogeno vi è un solo contributo al termine dell’energia potenziale, quello di attrazione tra nucleo ed elettrone, vale a dire – e2/r, dove e rappresenta la carica dell’elettrone e r la distanza tra il nucleo e l’elettrone orbitante.[8] Nel caso dell’atomo di elio ci sono due elettroni e di conseguenza ci sono due termini rispetto a quello che è presente nell’idrogeno.[9] Ma in aggiunta c’è un termine importantissimo di repulsione elettrone-elettrone dato da +e2/r12.
Idrogeno: energia potenziale = – e2/r
Elio: energia potenziale = − 2e2/r1 − 2e2/r2 + e2/r12
Considerare il passaggio dall’atomo di idrogeno a quello di elio come dovuto a un passaggio da uno a due elettroni, o da una configurazione 1s1 a 1s2, significa non riuscire a riconoscere il termine di repulsione elettrone-elettrone. La chimica non riguarda solo un particolare numero di elettroni, ma le forze all’interno di un particolare atomo, che non sono correlate esattamente al semplice numero di elettroni. Detto in termini diversi, una formalizzazione delle particelle elementari che sono presenti in un atomo, o anche la sua configurazione elettronica come dispositivo causale o esplicativo, rappresenterebbe una grossolana semplificazione dei fatti. Una spiegazione più profonda si trova nella dinamica tra le forze, che è fissata nell’equazione di Schrödinger indipendente dal tempo dell’atomo in questione.[10] Ecco perché spiegazioni rigorose in chimica e fisica richiedono la meccanica quantistica.
Questo è anche il motivo per cui, in generale, i chimici potrebbero essere d’accordo nel dire che la meccanica quantistica fornisce spiegazioni chimiche, mentre le configurazioni elettroniche sono una generalizzazione utile, ma grossolana. Le configurazioni elettroniche degli atomi sono più utili nell’insegnamento della chimica che nella chimica reale. Quando un chimico vuole prevedere il comportamento di un elemento o di un composto, o stabilire l’angolo di legame di una molecola, o addirittura risalire a un numero qualsiasi di proprietà, cerca nel suo computer il programma di meccanica quantistica. Conoscere la configurazione elettronica dell’atomo o della molecola è di utilità piuttosto limitata, a parte fare confronti con altri elementi.
Quindi, se si desidera davvero discutere l’elemento come sostanza di base, o anche come sostanza semplice, in termini microscopici, è richiesta una conoscenza delle particelle elementari presenti in un atomo insieme con l’uso dell’equazione di Schrödinger indipendente dal tempo. Questo suggerisce che qualsiasi tentativo di identificare il duplice significato del concetto di elemento come è stato fatto nella Figura 4 è destinato a fallire.
Nel contesto dei dibattiti riguardanti la duplice natura di elemento alcune questioni non sono mai state discusse, come sa bene chiunque abbia insegnato chimica sia al liceo che a livelli più avanzati.
Il fatto che l’identità di un elemento risieda nel suo nucleo, o nel suo numero atomico, sembrerebbe essere un chiaro riferimento agli elementi come sostanze di base. Questa situazione è del tutto coerente con l’idea che il nucleo non cambia nel corso delle reazioni chimiche. Nella filosofia generale, discussioni di identità personale sono legate a una o più caratteristiche che non cambiano con il tempo o qualsiasi cosa accada all’individuo in questione [17]. Allo stesso modo sembrerebbe che la discussione sull’identità degli elementi debba essere collegata al nucleo che non cambia. D’altra parte, il modo in cui un elemento reagisce è strettamente associato agli elettroni che orbitano attorno al nucleo di un atomo. Le disposizioni degli elettroni sono suscettibili di cambiamento, senza che si verifichi un corrispondente cambiamento nell’identità di un atomo. Ad esempio, la perdita o il guadagno di elettroni provoca la formazione di ioni positivi o negativi, ma senza modificare l’identità dell’atomo in questione.
Un’altra dualità che si può trovare nello studio o nell’insegnamento della chimica è che la quantità di un elemento che reagisce è associata al suo peso atomico, che è quasi interamente dovuto al nucleo.[11] Ci riferiamo ai calcoli stechiometrici con cui, per esempio, gli studenti imparano a calcolare come si ottiene un composto facendo reagire insieme due elementi. Tuttavia, come un elemento reagisce per formare composti, vale a dire la questione qualitativa piuttosto che quantitativa, è affrontata con riferimento solo agli elettroni posseduti da un atomo, o in modo più specifico alle configurazioni elettroniche degli atomi. Ad esempio, gli elementi i cui atomi presentano un elettrone nel guscio esterno, come il sodio e il potassio, reagiscono perdendo i loro elettroni più esterni, mentre gli elementi i cui atomi presentano sette elettroni esterni, come il cloro o il bromo, reagiscono acquistando un elettrone. Questi aspetti relativi all’insegnamento della chimica rappresentano un’altra forma di dualità riguardante il comportamento degli elementi che merita di essere ulteriormente esaminata nel contesto del dibattito generale a cui è rivolto il libro “What is a Chemical Element?”, a cura di E. R. Scerri e E. Ghibaudi.
La questione di quali elementi debbano precisamente essere inseriti nel gruppo 3 della Tavola Periodica è stata dibattuta a più riprese, apparentemente fino a oggi senza alcuna soluzione [18-21]. Questo problema è di notevole importanza sia per i chimici che per i fisici, così come per gli studenti di chimica, tanto è vero che la IUPAC nel 2015 ha convocato un gruppo di lavoro, attualmente presieduto da Eric Scerri, proprio per esaminare tale questione.[12]
Erroneamente da più parti si considera che la IUPAC sostenga la tradizionale Tavola Periodica con lantanio e attinio nel gruppo 3, opinione confutata da Jeffrey Leigh che ha chiarito come la IUPAC per tradizione non consideri la correttezza dell’una o dell’altra Tavola Periodica; in effetti non esiste una Tavola Periodica IUPAC ufficialmente approvata [22].
Dopo l’avvento della meccanica quantistica e la determinazione delle configurazioni elettroniche degli atomi c’è stata una generale convinzione che un tale approccio avrebbe risolto tutte le restanti questioni che hanno a che fare con i dettagli della Tavola Periodica. La prima determinazione delle configurazioni degli elementi itterbio (70) e lutezio (71) sembrava indicare per i loro atomi le seguenti configurazioni elettroniche:
[Yb] = [Xe] 4f13 5d1 6s2
[Lu] = [Xe] 4f14 5d1 6s2
Il lutezio, quindi, avrebbe dovuto segnare la fine della serie dei lantanidi. Inoltre, il lutezio, essendo scoperto insieme a molti altri elementi delle terre rare, veniva generalmente considerato un elemento delle terre rare [23].
Nel 1937 Meggers e Scribner [24] pubblicarono un articolo in cui riportavano che, contrariamente a quanto osservato in precedenza, la configurazione dell’itterbio avrebbe dovuto essere assegnata come:
[Yb] = [Xe] 4f14 6s2
Se l’itterbio possiede 14 elettroni f, anziché 13 come si credeva in precedenza, può essere davvero pensato come l’ultimo elemento delle terre rare. Di conseguenza, l’elemento successivo, il lutezio, può essere considerato come un elemento del blocco d, ponendolo così sotto lo scandio e l’ittrio nel gruppo 3. Negli anni successivi a questa scoperta alcuni libri e Tavole Periodiche incorporarono la configurazione dell’itterbio appena assegnata, astenendosi però dal discutere la possibile ricollocazione del lutezio. Nel noto testo sulla meccanica quantistica di Landau e Lifshitz è riportato per la prima volta che queste configurazioni fornivano motivi per considerare il lutezio come un elemento del blocco d piuttosto che un elemento del blocco f [25]: “Nei libri di chimica, il lutezio è ancora collocato tra gli elementi delle terre rare. Questo, tuttavia, non è corretto, poiché nel lutezio il guscio 4f è completo”.
Tale semplice nozione è stata poi riscoperta separatamente da un certo numero di autori, operanti in diverse sotto-discipline, sebbene nessuna di queste proposte sembrò avere alcun impatto sul modo in cui veniva presentata la Tavola Periodica [26-27].
Nel 1982 un chimico, William Jensen, pubblicò un articolo, ampiamente citato, in cui passava in rassegna le prove precedenti e faceva, forse, il primo concordato appello alla comunità chimica affinché le Tavole Periodiche fossero modificate in modo che il lutezio potesse sostituire il lantanio e il laurenzio potesse sostituire l’attinio nel gruppo 3 [19]. Questo articolo, tuttavia, non sembra aver convinto molti autori perché la maggior parte delle Tavole Periodiche è rimasta invariata e il dibattito è proseguito. Sebbene l’articolo di Jensen rappresenti un passo importante verso la riassegnazione degli elementi lutezio e laurenzio al gruppo 3, la proposta presenta alcune limitazioni che l’hanno portata a non avere l’impatto che avrebbe potuto avere [28].
Ciò che è richiesto per stabilire l’appartenenza al gruppo 3 sembra essere un argomento categoriale. Tale argomentazione diventa immediatamente disponibile se si prende in considerazione il concetto astratto di elemento e in particolare la proprietà che caratterizza ciascun elemento, ovvero la carica atomica. L’unica caratteristica di un elemento astratto è il suo numero atomico e su questo tutti sembrano essere d’accordo.
L’approccio proposto per risolvere la questione del gruppo 3 si basa principalmente sull’uso del numero atomico e si compone di due requisiti semplici e incontrovertibili. Il primo è presentare la Tavola Periodica con il formato lungo a trentadue colonne, piuttosto che con quello medio-lungo, più frequentemente visualizzato, a diciotto colonne. La forma lunga è una rappresentazione più corretta del sistema periodico, dato che incorpora il blocco f nel corpo principale della Tavola Periodica. Al contrario, la tavola più familiare a diciotto colonne presenta il blocco f come una nota disconnessa a piè pagina, un formato che sopravvive per ragioni pratiche, in quanto quella a trentadue colonne, piuttosto ampia, è difficile da rappresentare su poster o su singola pagina stampata.
Il secondo e fondamentale requisito è presentare gli elementi in modo tale da mostrare un aumento graduale del numero atomico a mano a mano che si procede lungo la Tavola Periodica da sinistra a destra in ogni periodo. Se queste due raccomandazioni sono seguite, diventa abbastanza chiaro che il gruppo 3 debba contenere il lutezio e il laurenzio, anziché il lantanio e l’attinio. Come si vede in figura 5, questa disposizione crea una sequenza fluida e regolare dei numeri atomici di tutti gli elementi.
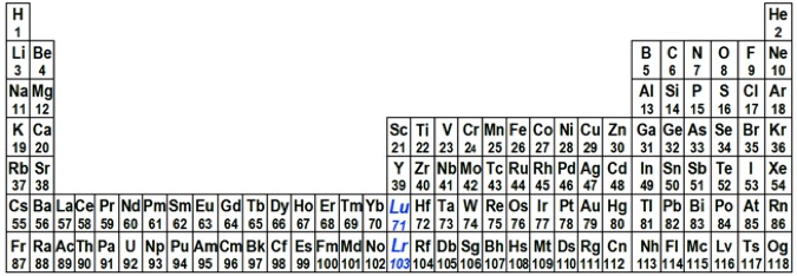 |
Figura 5. Tavola Periodica a 32
colonne con il lutezio e il laurenzio nel gruppo 3; tutti gli elementi
sono mostrati in ordine di numero atomico crescente
D’altra parte, se si insiste a mantenere il lantanio e l’attinio nel gruppo 3, la sequenza dei numeri atomici crescenti diventa altamente anomala come evidenziato in figura 6.
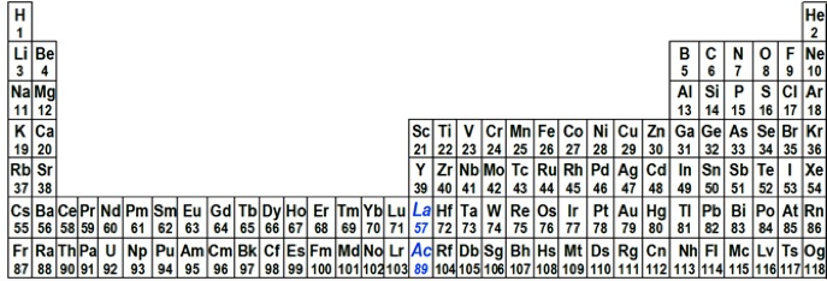 |
Figura 6. Tavola Periodica a 32
colonne con il lantanio e l’attinio nel gruppo 3; il numero atomico
non aumenta più in modo regolare, il che implica che il lantanio e
l’attinio sono fuori posto
Questioni aperte sul duplice significato di elemento
Secondo il resoconto fatto nell’introduzione a questo articolo potrebbe sembrare che i filosofi della chimica siano d’accordo sui due significati del concetto di elemento: in realtà, non è così. Forse l’unico punto su cui i filosofi della chimica possono concordare è la necessità di un concetto duplice, mentre qualsiasi altro aspetto sembra suscitare profondi disaccordi. Saranno ora esposte chiaramente le differenze di opinione nella speranza di favorire proficue discussioni. Naturalmente il chimico deve rimanere all’oscuro di tutto, perchè potrebbe essere predisposto all’idea che due filosofi non possono essere d’accordo su niente.
Ecco un breve elenco delle questioni controverse, molte delle quali sono affrontate nel volume edito da Scerri e Ghibaudi.
1. I due significati di elemento sono coestensivi, o uno è contenuto all’interno dell’altro?
2. Fino a che punto Lavoisier ha abbandonato il significato astratto degli elementi promuovendo il suo significato più positivo degli elementi come sostanze semplici?
3. Quali proprietà, ammesso che ne abbiano, possiedono gli elementi, nel significato astratto più generale, oltre al numero atomico (o peso atomico in Mendeleev)?
4. Quanto astratto dovrebbe essere considerato il significato di elemento di Mendeleev?
5. Quali influenze hanno indotto Mendeleev ad attribuire tanta importanza al significato astratto di elemento?
6. Quale uso fece Mendeleev del suo significato di elemento nella scoperta della sua versione di Tavola Periodica?
7. La questione terminologica se il Grundstoff di Paneth, tradotto come sostanza di base, sia davvero una forma di sostanza.
1. In che modo i due significati di elemento sono collegati tra loro?
Per evitare le insidie di cui al punto 7, si propone di utilizzare il termine “elemento-1” ed “elemento-2”, rispettivamente, per designare einfacher Stoff e Grundstoff di Paneth [9].
Un possibile modo di concepire questi due significati è che siano coestensivi e che appartengano allo stesso livello epistemologico. Un attimo di riflessione, tuttavia, rivela che non può essere così. È possibile che l’aspetto più concreto di “elemento” rappresenti un sottoinsieme del concetto più generale e più profondo di elemento-2 (Grundstoff)? Viceversa, potrebbe anche avere senso considerare la questione dal punto di vista opposto: l’elemento-2 potrebbe essere pensato come sussistente all’interno dell’elemento-1, nel senso che l’essenza di un elemento potrebbe essere contenuta all’interno dell’aspetto più tangibile e sensibile dell’elemento, o elemento-1, per rimanere all'interno della terminologia proposta. In alternativa, la natura concettuale di elemento-2 sembrerebbe precludere tale inclusione, oppure all’opposto che esso, elemento-2, includa al suo interno l’elemento-1.
Sono problemi mereologici di non facile soluzione, affrontati più ampiamente da Rom Harré e Jean-Pierre Llored [29].
2. Fino a che punto Lavoisier ha abbandonato il significato astratto di elemento promuovendo il significato piùpositivo degli elementi come sostanze semplici?
All’inizio i filosofi greci pensavano agli elementi come portatori astratti di proprietà, sebbene di per sé privi di qualsiasi proprietà tangibile. Come è noto, questa visione potrebbe aver avuto una notevole influenza filosofica nei secoli a venire, ma non anticipava la scienza moderna in quanto aveva un carattere eccessivamente metafisico.
Generalmente si ritiene che la chimica come scienza abbia cominciato a prendere forma per mano di Antoine Lavoisier, che promosse una visione degli elementi come stadio finale della decomposizione chimica. Tali elementi potevano essere isolati e ciascuno possedeva numerose proprietà che potevano essere osservate sperimentalmente, un primo passo nella direzione di una filosofia positivista. Naturalmente Lavoisier non abbandonò il concetto astratto di elemento come portatore di proprietà o come principio. In accordo con quanto sottolineano molti autori, il famoso elenco di sostanze semplici (elemento-1) di Lavoisier contiene una serie di principi come il calore e la luce. Mendeleev fece un successivo passo decisivo per l’evoluzione del concetto di elemento scrivendo in dettaglio su questo tema. Egli inizia i suoi Principi di Chimica evidenziando la necessità di un duplice concetto di elemento, dando la netta impressione che ritenesse più fondamentale il concetto astratto, dal momento che si spinge ad affermare che la sua classificazione periodica degli elementi si basava sul significato astratto di elemento, piuttosto che su quello di elemento come sostanza semplice. L’atteggiamento sempre più positivistico della scienza del ventesimo secolo ha quasi sradicato la nozione astratta di elemento nonostante alcuni chimici più riflessivi come Urbain e Soddy abbiano continuato ad occuparsene. Uno dei pochi resoconti che discute apertamente dei due significati di elemento, scritto da Fritz Paneth negli anni Trenta del Novecento [3], chimico inorganico incline alla filosofia, è stato tradotto in inglese solo nel 1962 [4].
Molte domande nascono da questo breve resoconto sullo sviluppo del concetto di elemento. Ad esempio, fu Lavoisier a dare origine alla nozione di elemento come sostanza semplice e quanto egli è debitore a precedenti chimici francesi? Ci si potrebbe anche chiedere fino a che punto Lavoisier stesso avesse una doppia nozione di elemento, o se abbia privilegiato gli elementi come sostanze semplici non essendo in grado di scrollarsi di dosso i resti della visione metafisica più astratta.
3. Quali proprietà̀, ammesso che ne abbiano, possiedono gli elementi nel loro significato più generale, oltre al numero atomico (o peso atomico in Mendeleev)?
Mendeleev pensava che un elemento astratto fosse anche un costituente materiale, per usare la sua terminologia. Tuttavia, il significato preciso di questo punto di vista resta da chiarire. Mendeleev sottolinea con forza la differenza “tra il concetto di corpo semplice come una singola sostanza omogenea, e come materiale costitutivo, non percepibile ai sensi, di un corpo composto” [4].
Mendeleev credeva anche che ogni elemento avesse un attributo distintivo, vale a dire il suo peso atomico, ma paradossalmente nessuna proprietà in quanto tale. Perché il possesso di un peso atomico non dovrebbe contare come una proprietà dell’elemento in questione? Il concetto aggiornato di Paneth di elemento astratto tiene conto della scoperta di Moseley che il numero atomico è un criterio migliore del peso atomico per ordinare gli elementi. Secondo Paneth, gli elementi astratti sono identificati attraverso il loro univoco numero atomico, ma anche questo non è da considerarsi come una proprietà dell’elemento astratto, poiché uno dei loro principali attributi è che essi sono privi delle proprietà tipiche degli elementi intesi come sostanze semplici isolate e, come per Mendeleev, questa posizione sembrerebbe sollevare questioni non ancora risolte.
4. Quanto è astratto l'astratto?
La nozione di elemento astratto solleva l’ovvia questione della scala di astrazione che si intende usare, problema ulteriormente complicato da alcuni autori, come Paneth, che riferendosi agli elementi usano il termine “trascendentale”. A un estremo della scala abbiamo il completamente astratto nel senso kantiano della cosa in sé, che deve rimanere nascosto alla vista [30-32], come una visione metafisica, nel senso letterale di trovarsi oltre il fisico, o addirittura al di fuori del regno del mondo fisico.
Klaus Ruthenberg, che ha condotto uno studio dell’influenza kantiana su Paneth, così commenta:
In termini filosofici moderni, le sostanze semplici sono osservabili, le sostanze di base sono non osservabili. Qui si vede un accenno ai fenomeni (gli osservabili) e noumena (i non osservabili) kantiani. Paneth ha affermato: "per comprendere il cambiamento delle proprietà delle sostanze abbiamo bisogno di ipotesi trascendentali". Quindi, ha ampliato il suo precedente punto di vista meramente fenomenologico e ha aggiunto il regno delle idee trascendentali alla sua filosofia della chimica [30].
Mendeleev, noto per essere stato fermamente contrario a qualsiasi forma così letterale di metafisica, dedicò notevoli sforzi a criticare l’interesse per lo spiritualismo e le sedute spiritiche che calamitavano l’attenzione della società europea durante il periodo vittoriano.[13] Per quanto riguarda Paneth, è noto che era in sintonia con la filosofia kantiana, sebbene fosse una varietà del Kantismo abbracciata dal filosofo tedesco Eduard von Hartmann e da lui definita realismo trascendentale.
Nel dibattito contemporaneo Robin Hendry insiste nell’interpretare la nozione di elemento astratto in maniera fisicalista, affermando che il senso astratto di elemento deve essere localizzato nello spazio e nel tempo e sostenendo una forma robusta di astrattezza.[14]
5. Cosa ha indotto Mendeleev ad attribuire una tale importanza al significato astratto di elemento?
Secondo Scerri il profondo attaccamento di Mendeleev al significato astratto di elemento sembra provenire dal nulla: come ha fatto Mendeleev ad arrivare a un tale punto di vista? Cosa lo ha portato, reinterpretando l’attitudine di Lavoisier, a porre quasi tutta l’attenzione sulla sostanza semplice? Sappiamo molto poco del motivo per cui Mendeleev ha adottato il punto di vista che è al centro di molti altri articoli del volume curato da Scerri e Ghibaudi. Per maggiori chiarimenti bisognerebbe affidarsi a studiosi di storia in grado di leggere la letteratura russa originaria come Michael Gordin e Nathan Brooks (che è rappresentato nel volume appena citato). Va anche ricordato il fatto che gli studiosi russi di Mendeleev non hanno ancora partecipato al dibattito condotto all’interno della comunità dei filosofi della chimica. Si pensi ad autori come Igor Dmitriev o Eugene Babaev (che ha partecipato ad alcuni degli incontri della Società Internazionale per la Filosofia della Chimica). Possiamo sperare che ci possa essere un riavvicinamento tra queste comunità a seguito della Conferenza Internazionale organizzata a San Pietroburgo per celebrare i 150 anni dalla nascita della Tavola Periodica di Mendeleev, avvenuta appunto nel 1869.
6. Le sostanze di base hanno proprietà oppure no?
Come può Mendeleev affermare che la Tavola Periodica riguardi principalmente gli elementi come sostanze di base, dal momento che si suppone che essi non abbiano proprietà, eccetto il peso atomico crescente? Il riconoscimento della periodicità o della somiglianza chimica comporta il confronto fra le proprietà delle sostanze semplici e anche fra quelle degli elementi in forma combinata, in ogni caso proprietà osservabili. Si suppone che gli elementi non abbiano proprietà in quanto sostanze di base: potrebbe allora essere che Mendeleev non abbia in realtà basato il suo sistema periodico così fermamente sulla nozione più astratta di elementi privi di proprietà, come egli sembra affermare di aver fatto? Il riconoscimento della periodicità chimica da parte di Mendeleev sembra al contrario dipendere dall’interpretazione degli elementi come sostanze semplici, così come dalle proprietà degli elementi nella loro forma combinata, soprattutto perché Mendeleev si riferiva spesso agli andamenti della valenza quando ci si spostava nella Tavola Periodica.
Questa domanda è chiaramente correlata a quanto astrattamente dovrebbe essere considerato il significato di elemento di Mendeleev e se la distinzione debba essere considerata macroscopicamente o microscopicamente.
7. La questione terminologica
Secondo l’autorevole articolo di Paneth del 1931, i due significati di elemento sono riferiti a einfacher Stoff e Grundstoff. Tuttavia, la versione più conosciuta di questo articolo è stata tradotta in inglese con i due termini chiave “simple substance” (sostanza semplice) e “basic substance” (sostanza di base).
Il chimico-filosofo Joseph Earley si è opposto a questa traduzione [33-34]: “Il senso principale dell’articolo di Paneth era che … la designazione elemento appartiene propriamente a ciò che egli chiama Grundstoff – un costituente ultimo di una sostanza chimica – piuttosto che a sostanze stabili che non possono essere decomposte (einfache Stoffe). … Su questa base, una traduzione inglese più appropriata (sebbene meno letterale) dell’einfacher Stoff di Paneth dovrebbe essere il termine elementary substance (sostanza elementare), piuttosto che simple substance (sostanza semplice), o element (elemento) per materiali stabili contenenti un solo elemento. … La parola element (elemento) sarebbe, quindi, disponibile per uso esclusivo come traduzione inglese di Grundstoff” [34].
Alcune lingue sono più adatte a fare questa distinzione. Ad esempio, nella lingua francese gli elementi come sostanze semplici sono noti come substances simples, mentre gli elementi come sostanze di base sono noti come eléments. Nella lingua inglese a entrambi i significati viene dato il nome element, il che provoca molta confusione. Sfortunatamente, gran parte del recente dibattito sul duplice concetto del termine element (elemento) è stato ovviamente condotto in lingua inglese. Rimane ancora del lavoro da fare per decidere, o concordare, una terminologia comune che consentirebbe una discussione più fruttuosa della questione dell’elemento tra i filosofi della chimica contemporanei. Infine, sulla questione della traduzione e della terminologia, i lettori dovrebbero vedere l’interessantissima analisi di Boyce [35].
Sono state passate in rassegna le sfaccettate discussioni su una questione fondamentale in chimica, vale a dire la natura degli elementi. Si passa da una nozione astratta (filosofi greci) a una nozione più concreta (Lavoisier) e di nuovo a una nozione astratta (Mendeleev e Paneth). Si è cercato di conciliare le opinioni dei filosofi della chimica con quelle dei chimici e dei docenti di chimica. Inoltre, si è applicato il concetto astratto di elemento, caratterizzato dal numero atomico, per risolvere la questione di quali elementi collocare nel gruppo 3 della Tavola Periodica.
In definitiva molto resta da chiarire: forse si rimane più confusi di quando questa questione è stata affrontata per la prima volta; si spera però di poter apprezzare meglio la profondità nel campo della chimica ancora carente di serie questioni filosofiche.
Si ringraziano Elena Ghibaudi dell’Università di Torino e Giovanni Stegel dell’Università di Sassari per l’attenta lettura del manoscritto e per i loro commenti e suggerimenti.
[1] E. R. Scerri, A Tale of Seven Scientists and a New Philosophy of Science, Oxford University Press, New York, 2016.
[2] R. MacLeod, R.G. Egdell, E. Bruton, For Science, King and Country: The Life and Legacy of Henry Moseley, Unicorn, London, 2018.
[3] F. A. Paneth, Über die erkenntnistheoretische Stellung des chemischen Elementbegriffs, Schriften der Königsberger Gelehrten Gesellschaft, Naturwissenschaftliche Klasse, Heft 4, Halle, Max Niemeyer Verlag, 1931.
[4] F. A. Paneth, The Epistemological Status of the Chemical Concept of Element, British Journal for the Philosophy of Science, 1962, 13, 1-14 e 144-160. Reprinted in Foundations of Chemistry, 2003, 5, 113-145.
[5] D. I. Mendeleev, Principles of Chemistry, vol. 1; 1st English edition translated by G. Kamensky, Longmans Green & Co, London, 1891.
[6] E. R. Scerri, The Periodic Table, Its Story and Its Significance, Oxford University Press, New York, 2007.
[7] M. Gordin, A Well-Ordered Thing, Basic Books, New York, 2004.
[8] E. R. Scerri, Naive Realism, Reduction and the ‘Intermediate Position, in Of Minds and Molecules (eds. N. Bhushan, S. Rosenfeld), Oxford University Press, 51-72, New York, 2000.
[9] E. R. Scerri, Response to Vollmer’s Review of Minds and Molecules, Philosophy of Science, 2003, 70, 391-398.
[10] E. R. Scerri, Some Aspects of the Metaphysics of Chemistry and the Nature of the Elements, Hyle-International Journal for Philosophy of Chemistry, 2005, 11, 127-145.
[11] E. R. Scerri, On the Continuity of Reference of the Elements, A Response to Hendry, Studies in History and Philosophy of Science, 2006, 37, 308-321.
[12] E. R. Scerri, The Dual Sense of the Term Element, Attempts to Derive the Madelung Rule and the Optimal Form of the Periodic Table, if any, International Journal of Quantum Chemistry 2009a, 109, 959-971.
[13] E. R. Scerri, What Is an Element? What Is the Periodic Table? And What Does Quantum Mechanics Contribute to the Question?, Foundations of Chemistry, 2012, 14, 69-81.
[14] F. A. Paneth, in Chemistry & Beyond: Collected Essays of F.A. Paneth (eds. H. Dingle, G.R. Martin), Wiley, New York, 1965.
[15] R. F. W. Bader, Atoms in Molecules: A Quantum Theory, Oxford University Press, New York, 1994.
[16] J. D. Stemwedel, Explanation, Unification, and What Chemistry Gets from Causation, Philosophy of Science, 2004, 71(5), 1060-1070.
[17] E. T. Olson, Personal Identity, in Stanford Encyclopedia of Philosophy (https://plato.stanford.edu/entries/identity-personal/)
[18] R. W. Clark, G. D. White, The Fly-Leaf Periodic Table, Journal of Chemical Education 2008, 85, 497.
[19] W. B. Jensen, The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table, Journal of Chemical Education, 1982, 59, 634-636.
[20] L. Lavelle, Response to the Fly-Leaf Periodic Table, Journal of Chemical Education, 2008, 85,1491.
[21] E. R. Scerri, Which Elements Belong to Group 3?, Journal of Chemical Education, 2009, 86, 1188.
[22] J. Leigh, Chemistry International, 2009, no. 1 (January-February). (http://www.iupac.org/publications/ci/2009/3101/1_leigh.html).
[23] C. H. Evans, Episodes from the History of the Rare Earth Elements, Springer, Berlin, 1996.
[24] W. F. Meggers, B. F. Scribner, Arc and Spark Spectra of Ytterbium, Journal Research National Bureau of Standards, 1937, 19, 651-664.
[25] L. D. Landau, E. M. Lifshitz, Quantum Mechanics, Pergamon, London, 1959.
[26] D. C. Hamilton, M. A. Jensen, Mechanism for Superconductivity in Lanthanum and Uranium, Physical Review Letters, 1963, 11, 205-207.
[27] B. T. Matthias, W. H. Zacharisen, G. W. Webb, J. J. Englehardt, Melting-Point Anomalies, Physical Review Letters, 1967, 18, 781-783.
[28] E. R. Scerri, W. Parsons, What Elements Belong in Group 3 of the Periodic Table?, in Mendeleev to Oganesson: A Multidisciplinary Perspective on the Periodic Table (eds. E. R. Scerri, G. Restrepo), 140-151, Oxford University Press, New York, 2018.
[29] R. Harré, J.-P. Llored, Molecules and Mereology, Foundations of Chemistry, 2013, 15, 127-144 (https://doi.org/10.1007/s10698-013-9181-5).
[30] K. Ruthenberg, Paneth, Kant, and the Philosophy of Chemistry, Foundations of Chemistry, 2009, 11, 79-91.
[31] K. Ruthenberg, The Kantian Response in Paneth’s Philosophy of Chemistry, Kant Studien, 2010, 101, 465-479.
[32] F. Mahootian, Paneth’s Epistemology of Chemical Elements in Light of Kant’s Opus Postumum, Foundations of Chemistry, 2013, 15, 171-184.
[33] J. E. Earley, Why There Is No Salt in the Sea, Foundations of Chemistry, 2005, 7, 85-102 (https://doi.org/10.1023/B:FOCH.0000042881.05418.15).
[34] J. E. Earley, How Chemistry Shifts Horizons: Element, Substance, and the Essential, Foundations of Chemistry, 2009, 11, 65-77.
[35] C. Boyce, Mendeleev’s Elemental Ontology and Its Philosophical Renditions in German and English, HYLE-International Journal for Philosophy of Chemistry, 2019, 25, 49-70.
[1] Il peso atomico della maggior parte degli elementi, come rappresentato su qualsiasi Tavola Periodica, è una media ponderata dei pesi secondo le abbondanze naturali dei vari isotopi di ciascun elemento. Eccezioni a questo stato di cose includono gli elementi mono-isotopici come fluoro, manganese e oro.
[2] Gold Book della IUPAC, s. v. “element” (https://goldbook.iupac.org/html/C/C01022.html).
[3] Per Van den Broek, vedere [1]; per Moseley e Van den Broek, vedere [2].
[4] Un’interpretazione più benevola della definizione del Gold Book è che identifica solo le sostanze semplici come sostanze e non confonde la questione riferendosi anche all’elemento astratto come a una “sostanza”. Questo punto è ripreso più avanti nel presente articolo nel contesto del lavoro di Earley e la sua risposta alla traduzione di Post del termine Grundstoff.
[5] Se i chimici contemporanei siano influenzati da qualsiasi cosa abbia scritto Mendeleev è ovviamente un’altra questione.
[6] Questo punto di vista rappresenta ovviamente un approccio piuttosto riduzionista. Inoltre, il lettore potrebbe obiettare alla terminologia, poiché una vera sostanza potrebbe non essere riducibile solo alle sue particelle fondamentali componenti. Tuttavia, è stata mantenuta la terminologia di Post nel discutere la questione principale dell’esistenza di almeno due concezioni del termine elemento.
[7] Numerosi articoli hanno discusso il ruolo della causalità in chimica, tra cui Stemwedel [16].
[8] L’elettrone ha una carica –e, mentre il nucleo di idrogeno ha una carica +e. Il prodotto tra le due cariche dà –e2, dove la carica negativa risultante denota un’attrazione tra le due particelle.
[9] Un’altra differenza è la carica nucleare sul nucleo dell’elio che è + 2e.
[10] Ci sono altri approcci che non fanno appello all’equazione d’onda di Schrödinger, come l’approccio ai calcoli del funzionale densità.
[11] La virtuale piccolezza degli elettroni nell’esecuzione di calcoli stechiometrici deriva dalla grande discrepanza di massa tra protoni e neutroni, da un lato, ed elettroni, dall’altro. Mentre la massa del protone e del neutrone è circa 1,67 × 10–27 kg, quella dell’elettrone è circa 9,1 × 10–31 kg, con un rapporto di 1835 a 1. Tuttavia, i calcoli stechiometrici non trascurano le masse degli elettroni, poiché queste piccole quantità sono incluse nelle masse atomiche relative che appaiono nelle Tavole Periodiche, o nelle tabelle di pesi atomici.
[12] Gruppo di lavoro IUPAC per il gruppo 3 della Tavola Periodica (https://iupac.org/project/2015-039-2-200).
[13] Non si intende insinuare un’identità tra spiritualismo e metafisica, ma semplicemente sollevare questo punto nell’intento di aprire ulteriormente il dibattito.
[14] Robin Hendry ha sottolineato questo punto in più di un incontro della Società Internazionale per la Filosofia della Chimica.