La complessità chimica del mondo biologico
Elena Ghibaudi
Le nanoscienze e le nanotecnologie, ossia lo studio delle proprietà caratteristiche dei sistemi strutturati di dimensioni nanometriche e delle loro varie applicazioni pratiche, rappresentano una frontiera recente dell’indagine scientifica e necessitano di un approccio multidisciplinare. Questi aspetti rendono l’argomento assai stimolante per la fantasia e la voglia di futuro di studenti della scuola secondaria. Nello stesso tempo, il patrimonio di concetti e conoscenze necessari per trattare questo tema in modo corretto e didatticamente efficace ne rendono difficile l’inserimento nel percorso scolastico.
Per la scuola secondaria intravvedo due approcci possibili a questi temi: i) approccio informativo-divulgativo , che si pone l’obiettivo di rendere gli allievi edotti in merito all’esistenza di fenomeni e sistemi strettamente correlati con dispositivi e tecnologie di comune utilizzo nella vita quotidiana, senza entrare nel merito della loro trattazione concettuale; ii) approccio didattico-concettuale , che fa leva su conoscenze e concetti già in possesso degli allievi per riesaminarli in un nuovo contesto, quello delle nanoscienze, e farli progredire.
Entrambi gli approcci hanno dei pro e dei contro.
L’approccio informativo-divulgativo evidenzia l’impatto del sapere scientifico-tecnologico sulla realtà e la nostra vita quotidiana; tocca problematiche attuali e pubblicamente dibattute; evidenzia il fatto che il corpus delle conoscenze scientifiche è in continua espansione, ossia è dinamico; promuove l’approccio interdisciplinare alla realtà. D’altra parte, l’aspetto concettuale passa largamente in secondo piano, perché troppo avanzato rispetto alle conoscenze medie degli allievi; inoltre c’è il rischio che gli studenti percepiscano gli aspetti spettacolari, senza comprendere la logica che li sostiene.
L’approccio didattico-concettuale ha il merito di porre il focus sulla comprensione; si focalizza sui concetti di base necessari a comprendere queste applicazioni; sfrutta attività laboratoriali sia in modalità esplorativa che confermativa; permette di lavorare in modalità interdisciplinare e di sfruttare materiali video disponibili on line. D’altra parte, esso sacrifica (almeno in parte) la spettacolarità e consente di progettare attività (laboratoriali e non) focalizzate su sistemi con un grado di complessità moderato.
Se ci poniamo nella prospettiva didattico-concettuale, sorgono immediate alcune domande:
Abbiamo visto che un aspetto caratteristico dei nanosistemi (e in particolare delle nanoparticelle) risiede nelle peculiari proprietà che si originano dal rapporto volume/superficie, con conseguenze che si manifestano nelle proprietà ottiche, di adsorbimento, catalitiche, ecc. Una conseguenza immediata di questo approccio è la considerazione che la ‘strutturazione’ microscopica di una sostanza può modulare significativamente le proprietà della sostanza stessa. E così, ad esempio, sospensioni di nanoparticelle di oro avranno colori (e dunque spettri ottici) dipendenti dalla granulometria delle particelle medesime.
Un altro aspetto che vale la pena di esplorare è il seguente: la prospettiva nanometrica può servire a ripensare il mondo microscopico atomico-molecolare in modo originale? In particolare, che tipo di sguardo propongono le nanoscienze sui sistemi di natura biologica? È possibile utilizzarle in chiave interdisciplinare per presentare aspetti e problematiche del mondo biologico? È possibile utilizzarle a scuola per riconsiderare concetti di base della chimica e della biochimica in una prospettiva supramolecolare?
Possiamo tentare un percorso interdisciplinare, facendoci guidare da alcune domande.
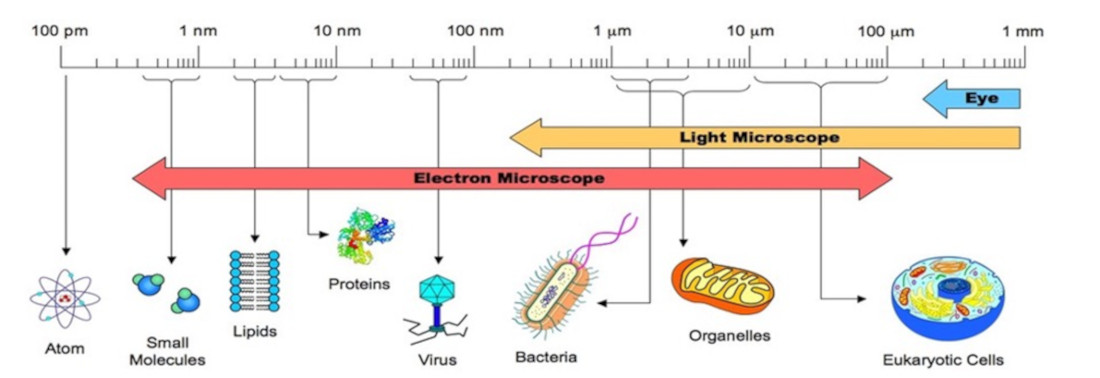
Una prima riflessione riguarda le scale dimensionali del mondo microscopico. Una cellula, un virus, una molecola sono tutti ‘piccoli’, ma appartengono a scale dimensionali molto diverse: gli allievi hanno tendenza a confondere il livello microscopico della chimica e della biologia appiattendo le differenze dimensionali fra enti di interesse chimico e biologico. È allora possibile esplicitare la questione, facendo uso di rappresentazioni come la figura 1 o di applicazioni disponibili in rete (ad esempio, https://learn.genetics.utah.edu/content/cells/scale/ ) che consentono di avere una percezione immediata delle diverse scale dimensionali e dei loro rapporti.

Figura 1 . La scala (multidimensionale) del mondo microscopico chimico-biologico
Moltissime molecole o aggregati molecolari di interesse/significato biologico sono a tutti gli effetti nanoparticelle: macromolecole biologiche come le proteine e gli acidi nucleici hanno dimensioni simili a quelle di nanoparticelle non biologiche. Esistono anche nanoparticelle artificiali, assemblate a partire da biomolecole e utilizzate a vari scopi: ad esempio, il trasporto di farmaci, la realizzazione di agenti teranostici, la progettazione di farmaci a lento rilascio, ecc.
Anche se il concetto di “nanosistema” è relativamente recente, le nanoparticelle naturali esistono da sempre! Conosciamo moltissimi esempi di sistemi naturali che rientrano in questa categoria: ad esempio, una sospensione proteica esibisce l’effetto Tyndall esattamente come una sospensione di nanoparticelle artificiali. Le ‘sospensioni colloidali’ sono sistemi che presentano al loro interno particelle di dimensioni nanometriche: pensarle come nanosistemi apre la strada a nuove chiavi interpretative del loro comportamento e a nuovi approcci di indagine scientifica (Figura 2).
In campo didattico, è possibile utilizzare la sezione didattica del Protein Data Bank (PDB-101 https://pdb101.rcsb.org/ ) per illustrare e discutere esempi di proteine, complessi proteici, acidi nucleici, virus, macchine molecolari biologiche, ecc., in relazione al loro ruolo, comparandone le dimensioni e ragionando sul rapporto tra struttura e funzione. Queste pagine interattive possono aiutare ad apprezzare la varietà dimensionale associata al livello microscopico, permettendo agli allievi di mettere a fuoco il gap dimensionale esistente, per esempio, tra una cellula e una macromolecola. Inoltre, consentono di discutere il significato di tali varietà di dimensioni e di forme (Figura 3).
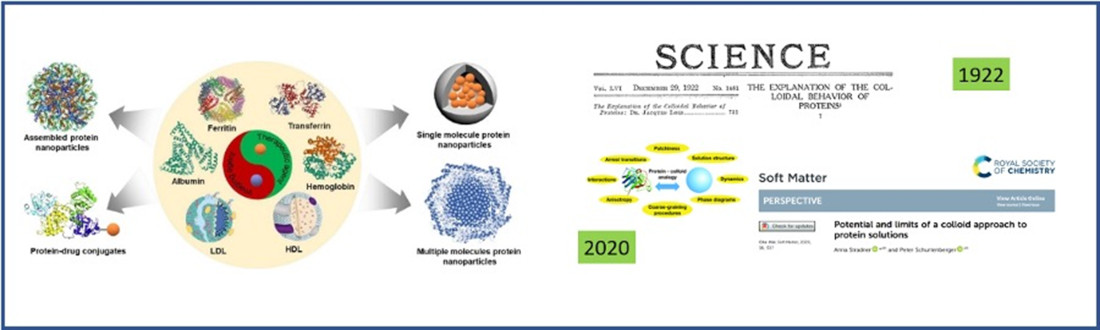
Figura 2 . A sinistra, esempi di nanosistemi di interesse biologico e biomedico (da Iqbal et al, J. Controlled Release , 2021, 329 , 997-1022); a destra, due diversi modi di ‘pensare’ le sospensioni proteiche
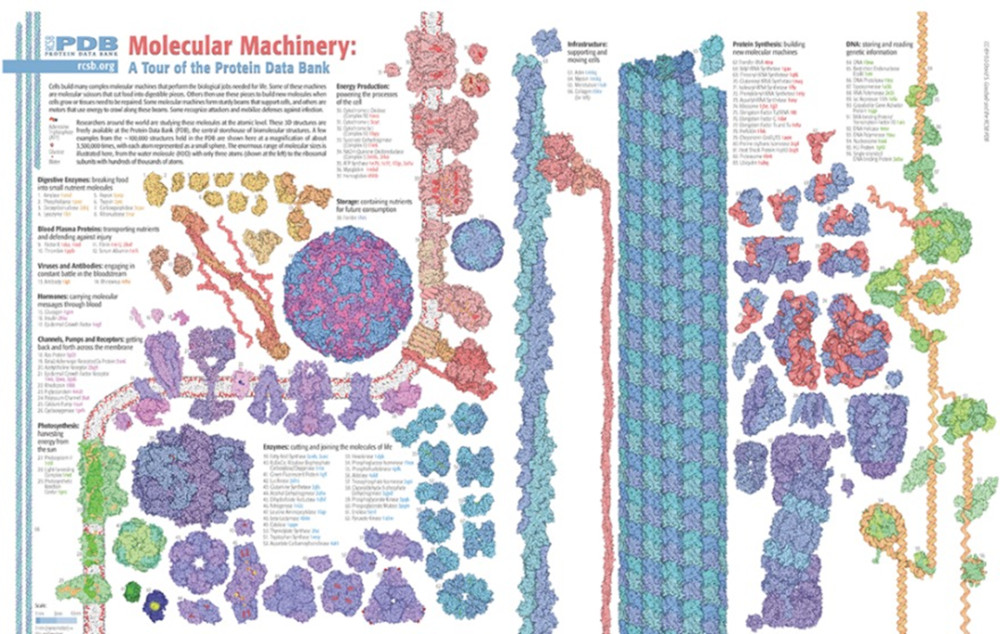
Figura 3
. Pagina didattica del Protein Data Bank, liberamente accessibile all’URL:
https://pdb101.rcsb.org/learn/flyers-posters-and-other-resources/flyer/molecular-machinery-a-tour-of-the-protein-data-bank
L’applicazione delle nanoscienze al campo biochimico può essere sfruttata efficacemente sul piano didattico, come opportunità per ripensare le interazioni interatomiche (legami primari e secondari) apprese nell’insegnamento di chimica e per comprenderne il ruolo e il significato nel contesto biologico. In particolare, diventa possibile:
Punto a
È importante che gli allievi comprendano il nesso esistente – da una parte – tra legami primari e struttura (ad esempio, struttura primaria delle proteine, backbone del DNA, ecc.) e – dall’altra – tra legami secondari e architettura o struttura supramolecolare (ossia, i livelli di struttura secondaria, terziaria e quaternaria, addotti supramolecolari, sistemi auto-assemblati, meccanismi di riconoscimento molecolare, ecc.).
Punto b
La disamina delle energie associate ai vari tipi di interazione può servire ad evidenziare e giustificare il diverso “dinamismo” dei vari tipi di interazione, evidenziando la differente stabilità delle strutture molecolari e supramolecolari nel tempo. L’aspetto energetico permette di valutare la “persistenza” dei legami, una volta fissate le condizioni al contorno. È molto importante mettere in evidenza questo aspetto quando si discutono le funzioni delle macromolecole biologiche, in quanto solo strutture dotate di una certa dinamicità e plasticità (ossia la possibilità di cambiare forma) si prestano a formare addotti funzionali (ad esempio, enzima-substrato, ormone-recettore).
Punto c
L’insieme di questi contenuti offre una chiave interpretativa potente delle proprietà e delle funzioni di molti sistemi di interesse biologico (esaminati a livello molecolare) ben accessibile al livello di conoscenze degli allievi.
Quali condizioni devono essere soddisfatte per poter esaminare i sistemi biologici secondo una prospettiva atomico-molecolare e supramolecolare?
Indubbiamente, occorre aver costruito e discusso il concetto di legame e aver affrontato i modelli di legame primario e secondario. Ciò comporta anche aver affrontato i nodi e le difficoltà concettuali relative a questi temi, che sono ben documentate dalla letteratura. Tra queste, ci sono le problematicità relative al concetto di dipolo istantaneo e permanente, per capire le quali gli allievi devono aver compreso che le interazioni interatomiche e intermolecolari sono mediate da elettroni e sono rese possibili dalla mobilità dei medesimi (molti studenti sanno che gli elettroni si muovono intorno al nucleo carico positivamente, ma non realizzano le implicazioni di tale comportamento. Perciò è fondamentale discuterle con la classe).
A queste condizioni, diventa possibile “leggere” molti eventi di interesse biologico ad un livello che non sarà più soltanto descrittivo, ma che – spostandosi sul piano atomico-molecolare e supramolecolare – consente di evidenziare le relazioni tra struttura/architettura e funzione.
Sul piano didattico, esistono moltissimi fenomeni di pertinenza biologica che – se letti in una prospettiva chimica – consentono di guidare gli allievi verso una migliore comprensione tanto dei contenuti biologici, quanto di quelli chimici e di superare la rigidità delle barriere tra discipline che è spesso ostacolo alla comprensione.
A questo scopo, vengono discussi quattro esempi di argomenti che sono, o possono essere, oggetto di trattazione didattica nella scuola secondaria.
Esempio 1: livelli di struttura delle proteine e fenomeno del folding
La disamina dei livelli di struttura delle proteine (dal primario al quaternario) consente di evidenziare come i legami covalenti intervengano (quasi) esclusivamente nella sola sequenza primaria. L’architettura proteica è stabilizzata da varie tipologie di legami secondari (legami H, interazioni idrofobiche, ponti salini, interazioni dipolari), oltre naturalmente ai ponti disolfuro e a poche altre interazioni covalenti tra residui di aminoacidi, che peraltro non sono presenti in tutte le proteine (Figura 4). La minor energia dei legami secondari rispetto ai primari, unitamente al loro carattere generalmente non direzionale (ad eccezione del legame H) realizza la plasticità delle macromolecole e consente, ove necessario, modifiche conformazionali strettamente correlate alla funzione proteica e alla possibilità di regolazione (si pensi agli effettori allosterici), così fondamentale per la sussistenza di un organismo vivente.
Il processo di folding consente anche di discutere il concetto di emergenza . Con questo termine si intende quel fenomeno, tipico dei sistemi complessi, secondo il quale il sistema esibisce proprietà macroscopiche che scaturiscono dalle interazioni lineari e non-lineari tra le componenti del sistema medesimo e non sono direttamente predicibili a partire dalle proprietà delle singole componenti del sistema. Si pensi ad un enzima: la funzione catalitica emerge in seguito al folding (che è un processo di auto-organizzazione) e non è presente né deducibile dalla semplice sequenza primaria. Ma il folding è reso possibile dallo stabilirsi di una rete di legami secondari. Si chiarisce così un aspetto fondamentale dei legami secondari: essi hanno un profondo significato chimico, contrariamente alla concezione che li vorrebbe semplicemente correlati allo stato fisico di un sistema. Un chiaro esempio di ciò è l’evidenza che la reattività di un enzima si manifesta solo grazie allo stabilirsi di legami secondari che strutturano la proteina e assistono la formazione dell’addotto (reversibile) enzima-substrato.
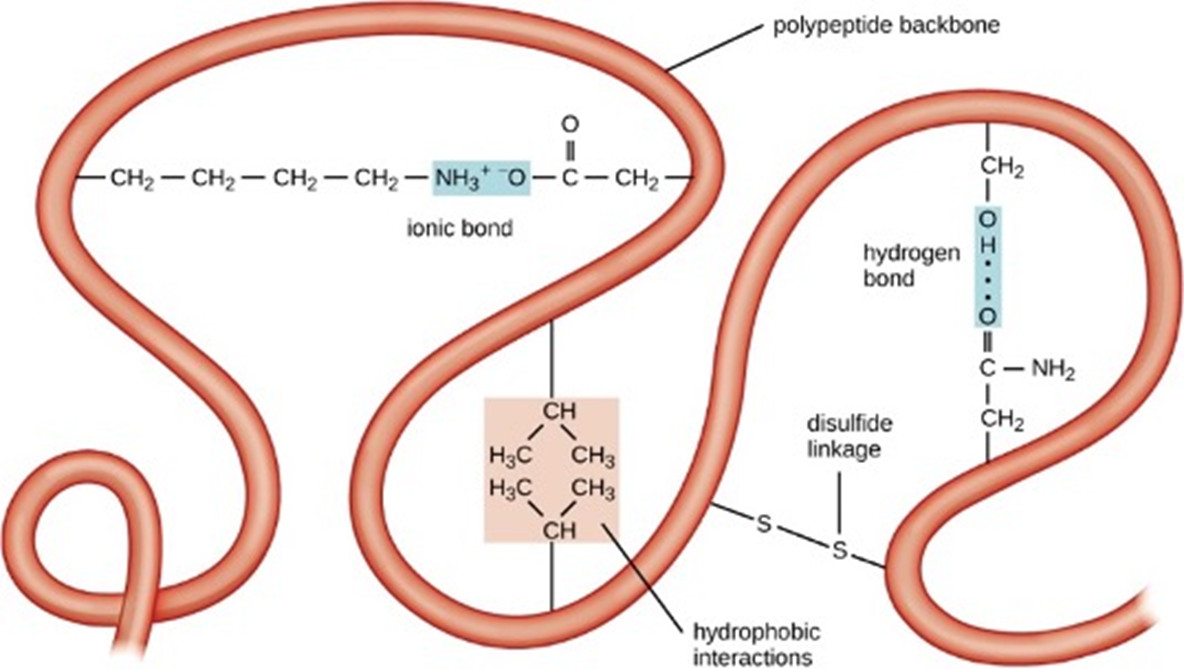
Figura 4 . Le interazioni responsabili per la strutturazione tridimensionale di una proteina (licenza Creative Commons)
L’iconografia attraverso la quale gli aspetti dinamici dei sistemi nanostrutturati sono rappresentati sui libri di testo ha il grande limite di essere statica. La disponibilità di LIM con accesso a Internet costituisce un vantaggio per l’apprendimento e la comprensione, nella misura in cui consente di fruire di animazioni didattiche liberamente disponibili in rete (ad es., i filmati del Protein Data Bank https://www.youtube.com/watch?v=wvTv8TqWC48),
oppure di app didattiche (ad es., https://lab.concord.org/embeddable.html?fbclid=IwAR332EV43jbDw2y9uhJLKpwPi_043xbzPA6bguW0cFNA8oRFoLgNpDXEyJo#interactives/samples/5-amino-acids.json , consente di apprezzare l’influenza della polarità del solvente sul processo di folding di sequenze primarie, a seconda della loro natura idrofilica, idrofobica o anfifilica).
Esempio 2: il processo di trascrizione del DNA
Un discorso del tutto analogo può essere sviluppato in relazione al processo di trascrizione del DNA, che può essere letto in termini molecolari e supramolecolari, evidenziando che solo un sistema supramolecolare qual è la doppia elica del DNA consente un meccanismo di apertura reversibile, che rende possibile la trascrizione dell’informazione genetica (Figura 5).
Infatti, le basi azotate del DNA interagiscono mediante legami secondari (legami H) caratterizzati da energie molto più basse rispetto ai legami covalenti che legano i nucleotidi e che definiscono il backbone della macromolecola. Sono le differenti scale energetiche delle due classi di legami a garantire che il backbone del DNA rimanga intatto durante il processo, consentendo lo stoccaggio e la preservazione del patrimonio genetico.
Ma non basta; anche la regolazione della trascrizione genica, operata da agenti di natura proteica o non proteica, è fondata sulla possibilità di formare addotti reversibili, ossia temporanei. I meccanismi di riconoscimento molecolare che consentono la formazione di tali addotti comportano la formazione di legami secondari. Trattandosi di processi dinamici, ancora una volta, è possibile sfruttare il materiale disponibile in rete per favorirne la comprensione e per discutere la chimica che essi sottendono (ad esempio, https://www.youtube.com/watch?v=dKubyIRiN84 ).
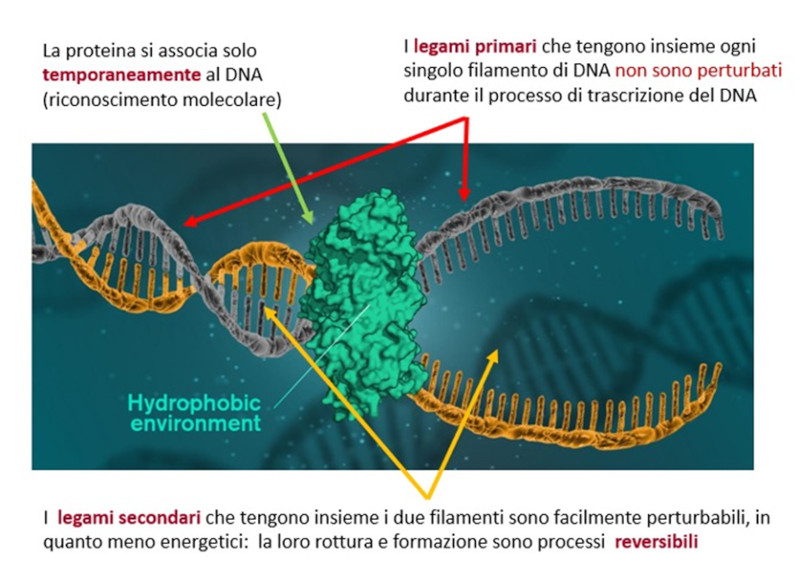
Figura 5 . Diverso significato biologico dei legami primari e secondari nel processo di trascrizione del DNA
Esempio 3: la membrana cellulare come esempio di self-assembly
Applicando i criteri della chimica supramolecolare, diventa anche possibile interpretare la membrana cellulare come sistema nanostrutturato e soggetto ad autoassemblaggio. La forza motrice per l’assemblaggio è da ricercarsi in fattori entropici ed entalpici che governano il cosiddetto effetto idrofobico. Gli strumenti di questo processo sono – nuovamente – i legami secondari. La lettura chimico-fisica dell’autoassemblaggio e della compartimentazione è, dunque, fortemente intrecciata al tema-chiave del mondo biologico, ossia all’origine dei primi sistemi viventi (vedi, ad es., https://www.youtube.com/watch?v=mRzxTzKIsp8 ). Questi stessi principi trovano applicazione pratica in molti altri settori: da quello farmacologico (si pensi al drug delivery mediato da liposomi o ciclodestrine) a quello dei materiali innovativi (ad es., l’autoassemblaggio di biomateriali a base di caseine https://www.youtube.com/watch?v=Xp147umPmLI ).
Esempio 4: due macchine molecolari naturali, il ribosoma e l’ATP sintasi
Le macchine molecolari naturali sono un argomento affascinante, capace di attrarre l’attenzione degli allievi e di motivare l’apprendimento. Sono ubiquitariamente presenti nel mondo vivente e svolgono una varietà di funzioni distinte ( https://www.youtube.com/watch?v=X_tYrnv_o6A ). Si tratta, a tutti gli effetti, di sistemi nanostrutturati dinamici frutto dell’evoluzione naturale. La natura, infatti, si serve di queste nanomacchine per realizzare processi essenziali quali la biosintesi delle proteine o la sintesi dell’ATP, fondamentale per garantire lo stoccaggio di energia negli organismi. Le componenti del ribosoma sono proteine e RNA ( https://www.youtube.com/watch?v=TfYf_rPWUdY).
L’ATP sintasi (Figura 6) è invece un complesso proteico che funziona come un vero e proprio ‘motore’ molecolare ( https://www.youtube.com/watch?v=kXpzp4RDGJI ).
Ancora una volta, il funzionamento delle nanomacchine naturali può essere ‘letto con gli occhi del chimico’ e interpretato ‘con gli occhi del biologo’, al fine di chiarirne sia il meccanismo che il ruolo all’interno dell’economia cellulare.
Questi nanosistemi necessitano di considerevoli modifiche conformazionali per funzionare: sul piano didattico ciò offre un’ulteriore opportunità per discutere il ruolo dei legami secondari come strumenti per assicurare la plasticità dei sistemi, consentirne la regolazione e così garantire il funzionamento della cellula e dell’organismo vivente.
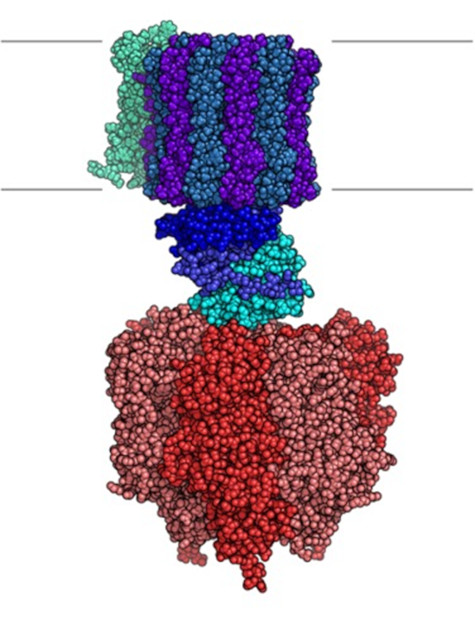
Figura 6 . Rappresentazione della struttura di ATP sintasi (licenza Creative Commons)
Questi quattro esempi, scelti tra un’ampia gamma di possibilità, suggeriscono alcune strade possibili per realizzare una didattica interdisciplinare che consenta agli allievi di comprendere l’utilità delle distinzioni disciplinari, ma anche la necessità di superarle, se si desidera raggiungere un adeguato grado di comprensione della realtà.
Video presentazione
E. Ghibaudi:
https://youtu.be/cFwo8cV8z1I