La teoria molecolare di Ampère:
una visione di primo Ottocento carica di stimoli di riflessione
Vincenzo Villani
Dipartimento di Scienze di Base e Applicate dell’Università della Basilicata, Campus Macchia Romana, Potenza
e-mail: vincenzo.villani@unibas.it
Indice
3. La théorie mathématique de la combinaison chimique
4. La determinazione delle strutture molecolari
Abstract. André-Marie Ampère (1775-1836) was a universal genius, ranging from mathematics, to physics, to chemistry. Encouraged by the chemist Berthollet, in 1814 he published an elaborate theory of molecular structure that took into account Gay-Lussac’s law of combination volumes “To provide the means of predicting a priori the fixed ratios according to which bodies combine, bringing their different combinations back to principles that would be the expression of a law of nature”. In this work he enunciated, independently of Avogadro (1811), the law of direct proportionality between the volume of a gas and the number of particles contained therein, independent of their nature.
Based on the atomistic vision inaugurated by Newton (1704) and the theory of short-range molecular forces developed by Laplace (1806), Ampère developed a complex geometric-molecular theory that, starting from only two fundamental forms, the tetrahedron and the octahedron, constructed stable molecular structures in accordance with the law of combination volumes of reagents and products.
Ampère’s theory was not welcomed by the chemists of the time, however it spread and introduced for the first time the stereochemical vision of molecules and reactions that was finally affirmed in the hypothesis of tetrahedral carbon by van’t Hoff and Le Bel (1874).
These anticipations, eclipsed by the nineteenth-century positivism that rejected the existence of atoms and molecules, later returned in various forms and still retain an educational and epistemological value today.
Keywords: André-Marie Ampère; storia della chimica; didattica della chimica; epistemologia della scienza; teoria della struttura molecolare
Il Premio Nobel della Chimica 2024 è stato assegnato a Baker, Hassabis e Jumper per l’importante contributo dato alla risoluzione teorica del Protein folding. Questo problema è relativo alla previsione della struttura biologicamente attiva delle proteine a partire dalla conoscenza della sola sequenza di amminoacidi: si tratta della determinazione della struttura molecolare più stabile dal punto di vista termodinamico (Figura 1). In generale, la previsione di qualsiasi struttura molecolare all’equilibrio (anche della semplice molecola d’acqua) rappresenta un problema di ottimizzazione di geometria in cui è resa minima l’energia d’interazione del sistema.
La teoria di Ampère del 1814 considera le molecole proprio sotto questo punto di vista: nella sua visione, la struttura molecolare è il risultato dell’equilibrio di forze di attrazione e repulsione tra gli atomi costituenti: all’equilibrio si annullano e il problema è risolto mediante una complessa costruzione geometrica.
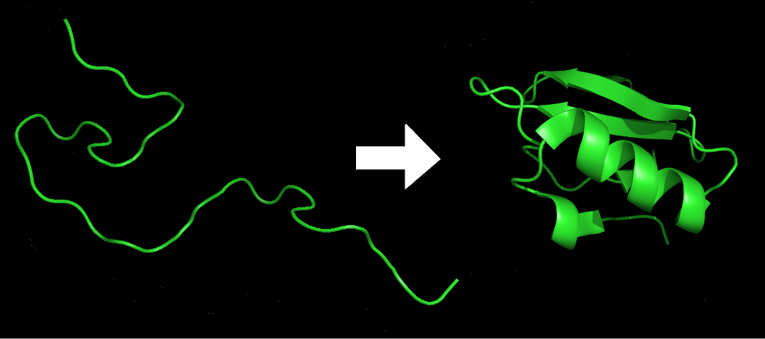
Figura 1. Rappresentazione del protein folding dell’inibitore della chimotripsina
André-Marie Ampère nasce nei pressi di Lione, in un’agiata e colta famiglia borghese: il padre, ricco mercante di seta, è uomo di vedute illuministe e si dedica all’educazione del figlio secondo le idee pedagogiche di Rousseau: osservazione della natura, libera sperimentazione, libere letture, educazione religiosa e morale, sono alla base della formazione del giovane.
La sua preparazione informale, lo rende sempre ben disposto a nuove ipotesi, anche le più azzardate. Questa tendenza a muoversi fuori dalla scienza accademica è alla base della fantasia scientifica: la grande immaginazione costituisce il tratto peculiare del suo carattere che lo spinge a formulare teorie innovative anche in chimica.
Nel 1802 pubblica Considérations sur la théorie mathématique du jeu, in cui l’analisi delle probabilità dimostra che il giocatore d’azzardo è destinato alla rovina. Il saggio lo rende celebre presso cattedratici e accademici. Nel 1804 fonda il cenacolo culturale la Société chrétienne e studia il Traité élémentaire de chimie (1789) di Antoine-Laurent de Lavoisier (1743-1794). Nel 1807 diviene professore di Analisi all’Ecole Polytechnique e nel 1809 è professore di Meccanica. Nel 1814 diventa membro dell’Académie des Sciences nella sezione di Geometria: la sua teoria molecolare sarà giusto un complesso lavoro di geometria.
Nella lettera a Jacques Roux-Bordier (11 marzo 1814), Ampère illustra la genesi e le speranze riposte nella nuova teoria:
Le mie conversazioni con il sig. Davy1 avevano suscitato in me un grandissimo interesse per la chimica. Per circa due mesi mi sono occupato di un lavoro il cui risultato mi sembrava dover aprire in questa scienza un nuovo corso e dare il mezzo di prevedere a priori i rapporti fissi secondo i quali i corpi si combinano, riportando le loro diverse combinazioni a princìpi che sarebbero l’espressione di una legge della natura, in realtà, la teoria delle combinazioni chimiche è chiara e incontestabile e diventerà tanto comune nelle scienze fisiche quanto le altre teorie generalmente ammesse.
La stesura della Théorie è sollecitata dal chimico Claude Louis Berthollet (1748-1822) e pubblicata nel 1814 negli Annales de Chemie: Lettre de M. Ampère à M. le comte Berthollet, sur la détermination des proportions dans lesquelles les corps se combinent d’après le nombre et la disposition respective des molécules dont leurs particules intégrantes sont composées.
Il conte Berthollet è fortemente interessato a questioni di teoria della chimica: è del 1803 il suo Essai de statique chimique, il cui obiettivo è quello di stabilire le leggi generali delle reazioni chimiche.
3. La théorie mathématique de la combinaison chimique
La teoria di Ampère parte dalla Legge dei volumi di combinazione (1808) di Gay-Lussac (1778-1850):
Signor conte, voi sapete che da tempo l’importante scoperta di Gay-Lussac sulle proporzioni semplici, che si osservano tra i volumi di un gas prodotto e quelli dei gas reagenti, mi ha fatto sorgere l’idea di una teoria che spiegasse non soltanto i fatti scoperti da quell’insigne chimico e i fatti analoghi osservati in seguito, ma che potesse anche applicarsi alla determinazione delle proporzioni di un gran numero di altri prodotti che, nelle condizioni ordinarie, non sono allo stato gassoso.
Quindi, esemplifica la legge con alcune importanti reazioni allo stato gassoso, che scriviamo in termini di volumi:
½ Ossigeno + ½ Azoto → 1 Gas nitroso
1 Idrogeno + ½ Ossigeno → 1 Vapore d’acqua
1 Azoto + ½ Ossigeno → 1 Ossido d’azoto
½ Azoto + 3/2 Idrogeno → 1 Gas Ammoniacale
Sulla base della teoria della capillarità di Laplace (1806) e della teoria della rifrazione della luce nei corpi trasparenti di Biot (1814), Ampère assume che le molécules (ovvero, gli atomi, in senso moderno) possono essere considerate puntiformi e sorgenti di forze attrattive gravitazionali e forze repulsive dovute alla pressione del calorico:
Alcune conseguenze dedotte dalla teoria dell’attrazione universale, considerata come la causa della coesione, e la facilità con la quale la luce attraversa i corpi trasparenti hanno condotto i fisici a supporre che le ultime molecole dei corpi siano tenute, dalle forze attrattive e repulsive che sono loro proprie, a distanze da considerarsi infinitamente grandi rispetto alle dimensioni delle molecole stesse.
Essendo gli atomi privi di struttura, la spiegazione dei fenomeni chimici è da ricercare nella struttura delle particelle, ovvero nella configurazione geometrica stabile che gli atomi assumono nella molecola:
Le loro forme, che del resto nessuna osservazione diretta è in grado di farci conoscere, non hanno più alcuna influenza sui fenomeni che presentano i corpi che ne sono composti e bisogna cercare la spiegazione di questi fenomeni nel modo in cui le molecole si dispongono le une rispetto alle altre per formare ciò che io chiamo una “particella”.
Ampère chiama particules intégrantes quelle che noi chiamiamo molecole, e molécules gli atomi, che definisce come: les dernières portions de matières. Quindi, postula che una molecola sia un sistema tridimensionale costituito da almeno quattro atomi:
Si deve considerare una particella come la riunione di un numero determinato di molecole in una posizione determinata, comprendente tra loro [separate da] uno spazio incomparabilmente maggiore del volume delle molecole. Affinché questo spazio abbia tre dimensioni tra loro paragonabili, è necessario che una particella riunisca almeno quattro molecole.
In questo modo, abbiamo: O4, N4 e H4. Riducendo gli atomi a punti materiali e considerando i piani che li contengono, definisce la forme représentative de la particule, come il corrispondente poliedro regolare con gli atomi costituenti ai vertici:
Per esprimere la posizione rispettiva delle molecole in una particella, bisogna immaginare nei centri di gravità delle molecole, centri ai quali esse si possono supporre ridotte, piani situati in modo da lasciare da una stessa parte tutte le molecole che si trovano fuori da ciascun piano. Supponendo che nessuna molecola sia contenuta nello spazio compreso tra questi piani, tale spazio sarà un poliedro, di cui ogni molecola occuperà un vertice e basterà indicare questo poliedro per esprimere la posizione rispettiva delle molecole che compongono una particella. A questo poliedro darò il nome di “Forma rappresentativa della particella”.
Ampère considera un gas a pressione e temperatura costante: per esso valgono le leggi di Boyle-Mariotte (1662) (P ∝ 1/V per T = T0) e Charles-Gay-Lussac (1802) (V ∝ T per P = P0). Assumendo che le particelle del gas siano a una distanza tale che le forze di interazione siano trascurabili, il volume risulta indipendente dalla natura delle particelle e proporzionale solo al loro numero: V ∝ N per T = T0 e P = P0 (legge di Ampére-Avogadro).
A tale scopo sono partito dalla supposizione che, nel caso in cui i corpi passino allo stato gassoso, le loro particelle siano separate e tenute lontane le une dalle altre dalla forza di espansione del calore a distanze molto maggiori di quelle a cui le forze di affinità e coesione hanno un valore apprezzabile, in tal modo queste distanze dipendono soltanto dalla temperatura e dalla pressione del gas e, a parità di pressione e temperatura, le particelle di tutti i gas, semplici o composte, saranno situate alla stessa distanza le une dalle altre. Allora, il numero delle particelle è proporzionale al volume del gas.
Si tratta della legge dei volumi molari, che Avogadro aveva già enunciata nel 1811.
A questo punto Ampère esplicita il Principio epistemologico alla base della sua Ricerca: dai dati sperimentali si ricava una legge empirica (1), dai principi primi un’ipotesi interpretativa matematica (2); l’ipotesi, se avvalorata (in senso probabilistico) dal successo esplicativo e predittivo di fatti sperimentali, diventa una teoria dimostrata (3).
Quali che siano le ragioni teoriche che mi sembrano appoggiare questa spiegazione, non la si può considerare altro che un’ipotesi; ma paragoniamo i risultati che ne sono una conseguenza necessaria con i fenomeni o le proprietà che osserviamo: se essa si accorda con tutti i risultati noti dall’esperienza e se ne deducono conseguenze confermate da successive esperienze, essa acquisterà un grado di probabilità che si avvicinerà a quanto in fisica si chiama ‘certezza’. Ammettendola, basterà conoscere i volumi allo stato gassoso di un corpo composto e dei suoi componenti per sapere quante particelle o porzioni di particelle dei due componenti sono contenute in una particella del corpo composto.
In virtù della legge dei volumi molari, i rapporti volumetrici di reazione coincidono con i coefficienti stechiometrici e Ampère applica la legge alle reazioni gassose più semplici:
Il gas nitroso2 contiene la metà del suo volume d’ossigeno e la metà d’azoto; si deduce che una particella di gas nitroso è formata dalla riunione della metà di una particella di ossigeno e dalla metà di una particella di azoto.
Abbiamo
½ O4 + ½ N4 → N2O2
Essendo un volume di gas ammoniacale3 composto da 1/2 volume d’azoto e da e 3/2 volumi di idrogeno, una particella di questo gas conterrà ½ particella d’azoto e 3/2 particelle d’idrogeno.
Abbiamo
½ N4 + 3/2 H4 → N2H6
Il vapore d’acqua contiene, come dimostrato da Gay-Lussac, un volume uguale d’idrogeno e la metà del suo volume d’ossigeno, ogni sua molecola sarà composta da una particella intera di idrogeno e metà particella d’ossigeno.
Quindi, abbiamo anche
H4 + ½ O4 → H4O2
N4 + ½ O4 → N4O2
Ampère commette un errore sistematico che finisce per inficiare l’intera teoria: il postulato della “Molecola minima tetratomica”. In questo modo, il numero degli atomi nelle molecole d’idrogeno, ossigeno e azoto risulta raddoppiato e l’errore si propaga nei composti derivati.
Il postulato della molecola minima tetratomica è una conseguenza necessaria dell’assunzione degli atomi newtoniani: punti materiali privi di estensione. Inoltre, le molecole sono per Ampère entità geometriche statiche, prive di vibrazioni e moti rigidi: solo successivamente nel lavoro del 1835, introduce il concetto di vibrazioni e rotazioni molecolari. Quindi, affinché una molecola statica, costituita da atomi puntiformi sia tridimensionale, è necessario che sia almeno tetratomica. Pertanto, l’ipotesi è errata, ma coerente con la visione molecolare del tempo.
4. La determinazione delle strutture molecolari
La Legge dei volumi molari applicata alla Legge dei volumi dei gas di Gay-Lussac diventa un metodo efficiente per determinare le formule molecolari. Quindi, a partire dalle formule molecolari, Ampère sviluppa la Teoria delle strutture molecolari.
Se consideriamo le forme primitive dei cristalli stabilite dai mineralogisti come le forme rappresentative delle particelle più semplici, ammettendo nelle particelle tante molecole quanti vertici hanno le forme corrispondenti, troveremo che esse sono in numero di 5: tetraedro, ottaedro, parallelepipedo, prisma esagonale, dodecaedro romboidale. Le particelle corrispondenti alle forme rappresentative sono composte da 4, 6, 8, 12 e 14 molecole.
Ampère assume i cinque poliedri delle molécules intégrantes di Renè Just Haüy4 come le più semplici formes représentatives di strutture molecolari (Figura 2).
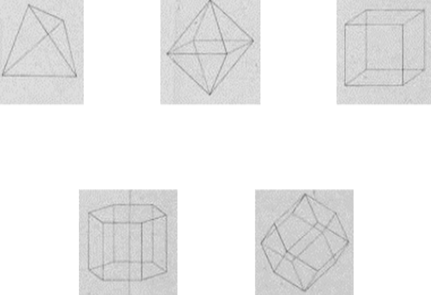
Figura 2. Le più semplici formes représentatives des particules, così come sono rappresentate nella Lettre
Allora, le molecole più semplici sono composte da 4, 6, 8, 12 e 14 atomi: i primi tre casi corrispondono ai gas nitroso (N2O2), acqua (H4O2) e ammoniaca (N2H6). Tuttavia, i poliedri fondamentali sono ridotti a due: il tetraedro e l’ottaedro (Figure 3 e 4).
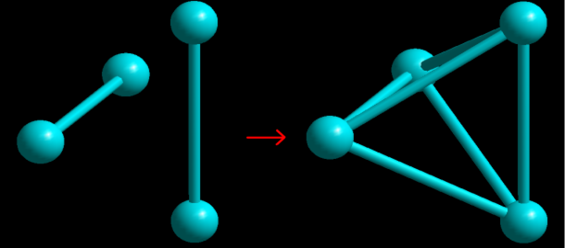
Figura 3. La combinazione di due gruppi bi-atomici danno luogo alla molecola minima tetraedrica
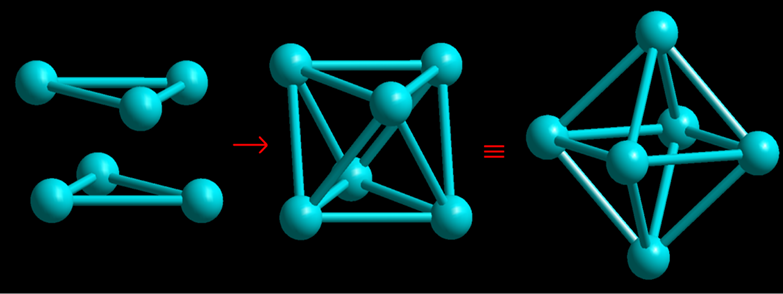
Figura 4. La combinazione di due gruppi tri-atomici danno luogo alla molecola ottaedrica esa-atomica
A partire da questi, mediante combinazioni successive, costruisce le strutture molecolari dei composti noti, in accordo con le formule molecolari ricavate dai rapporti stechiometrici di Gay-Lussac:
Per farci un’idea più chiara della posizione rispettiva di due molecole, supponiamole unite da un segmento di retta; se vi si aggiungono altre due molecole uniti allo stesso modo, dapprima nello stesso piano in maniera che i due segmenti si taglino in due parti uguali, poi allontanandoli tenendoli sempre in posizione parallela a quella che avevano in quel piano, si otterrà un tetraedro, che sarà regolare solamente nei casi in cui i due segmenti siano uguali e perpendicolari tra loro e siano stati allontanati l’uno dall’altro a una distanza che stia alla loro lunghezza come 1:√2.
Immaginiamo ora tre molecole congiunte da segmenti formanti un triangolo qualsiasi: poniamo nello stesso piano un altro triangolo uguale al primo e in posizione tale che i due triangoli abbiano i loro centri di gravità nello stesso punto e i loro lati uguali rispettivamente paralleli: allontanando questi due triangoli in modo che i tre lati di ogni triangolo rimangano sempre paralleli alla loro posizione primitiva, si otterranno sei punti situati ai vertici di un ottaedro; questo sarà regolare solo nel caso di triangoli equilateri allontanati perpendicolarmente al loro piano di una quantità che stia ai lati come √2:√3
Consideriamo la combinazione di due tetraedri, come nella reazione tra azoto e idrogeno ad ammoniaca, ½ N4 + 3/2 H4 → N2H6:
Se si suppone, nel caso del tetraedro, di condurre per i due segmenti di cui abbiamo parlato, due piani paralleli tra loro […] è possibile costruire il tetraedro simmetrico al primo: gli otto vertici dei due tetraedri, uniti in questo modo, saranno i vertici di un parallelepipedo. Il parallelepipedo diventa un cubo quando i due tetraedri sono regolari. (Figura 5)
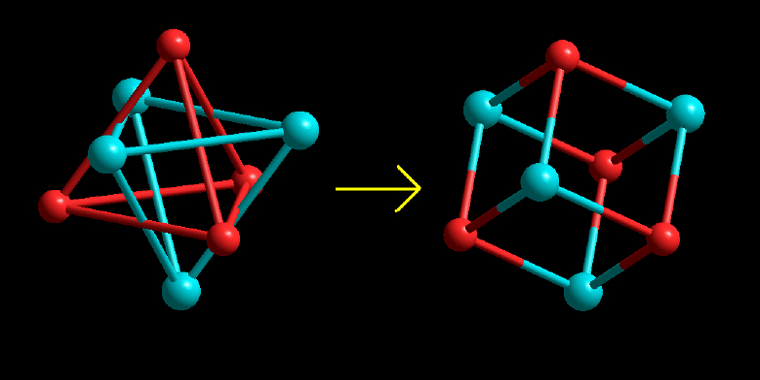
Figura 5. Due molecole tetraedriche si combinano per dare una molecola cubica
Nel caso della conversione di idrogeno e azoto in ammoniaca, la combinazione risulta più complessa: “mezzo tetraedro” d’azoto, ovvero N2 lineare, si compone con “mezzo tetraedro” d’idrogeno, ovvero H2 lineare, per dare il tetraedro N2H2, il quale composto con un tetraedro di H4, darà il cubo di ammoniaca con due atomi di azoto che rispetta la stechiometria della reazione, secondo le leggi di Gay-Lussac e di Avogadro-Ampère.
Quindi, considera la combinazione tra un cubo (dato dall’inviluppo di 2 tetraedri) e un ottaedro per ottenere un dodecaedro (Figura 6), come nella preparazione del muriato di ammoniaca (cloruro d’ammonio) da ammoniaca e acido muriatico (cloridrico):
N2H6 + H2Cl4 → N2H8Cl4 (muriato di ammoniaca)

Figura 6. La molecola cubica di ammoniaca si combina con la molecola ottaedrica di acido muriatico per dare il dodecaedro rombico (con 14 vertici) della molecola di muriato d’ammoniaca (Strutture originali della Lettre)
Nella combinazione delle molecole, le forze attrattive gravitazionali competono con le forze repulsive del calorico. Allora, le molecole reagenti si compenetrano fino a far coincidere i centri di massa, mentre gli atomi ai vertici si sfalsano minimizzando l’energia d’interazione. A questo punto, gli spigoli dei poliedri iniziali si aprono e si formano gli spigoli del poliedro finale. In questo modo, Ampère anticipa la visione moderna della reazione chimica, come “meccanismo di reazione con rottura di legami chimici e formazione coordinata di nuovi legami” (Figura 7).
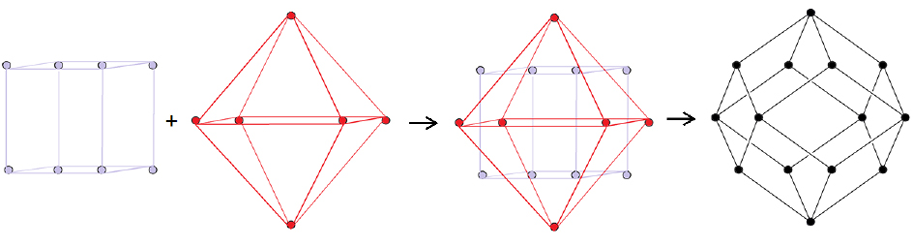
Figura 7. La conversione di ammoniaca (cubo) e acido cloridrico (ottaedro) in cloruro d’ammonio (dodecaedro) secondo la teoria della combinazione chimica di Ampére
Utilizzando il requisito della configurazione stabile, Ampère individua le possibili strutture molecolari combinando in modo sistematico le 2 forme fondamentali (tetraedro e ottaedro) in numero via via crescente. Considera la combinazione di 2 tetraedri, 3 tetraedri, …, 8 tetraedri; 2 ottaedri, 3 ottaedri, …, 8 ottaedri; quindi, le 64 combinazioni miste di n = 1, …, 8 tetraedri con m = 1, …, 8 ottaedri: un’impresa enorme che coinvolge l’analisi di 80 configurazioni possibili da cui seleziona le 23 formes reprèsentatives simmetriche che minimizzano l’energia d’interazione.
Dal punto di vista geometrico, la combinazione delle forme rappresentative più semplici per ottenere le forme rappresentative più complesse, riguarda la costruzione dei “Poliedri composti”, ovvero del poliedro formato da almeno due poliedri intersecanti, con i centri di massa coincidenti. Quindi, per ogni poliedro composto, mediante una procedura detta “Chiusura convessa” viene individuato il “Poliedro convesso minimo” di superficie minima. Si tratta, quindi, di un problema di ottimizzazione. La costruzione di Ampére soddisfa il requisito di Gay-Lussac dato che è razionale il rapporto tra il numero dei vertici dei poliedri di partenza e del poliedro composto risultante corrispondente alla struttura della molecola prodotto.
Dal punto di vista fisico, il Problema di Ampère è un problema di ricerca della “Configurazione di minima energia”. Infatti, la forma rappresentativa della particella deve minimizzare la somma dell’energia gravitazionale attrattiva e repulsiva del calorico. In questo modo, la Lettre inaugura lo studio delle strutture molecolari mediante la ricerca di geometrie di minima energia, obiettivo tutt’oggi della massima importanza in chimica.
Il problema di Ampère si sviluppa in quello di Thomson del 1904 alla base del modello di atomo detto Plum pudding. In generale, il problema corrisponde alla ricerca della struttura atomica di minima energia con n elettroni che si respingono, sotto l’azione della forza di Coulomb, sulla superficie di una sfera di carica positiva (Figura 8).
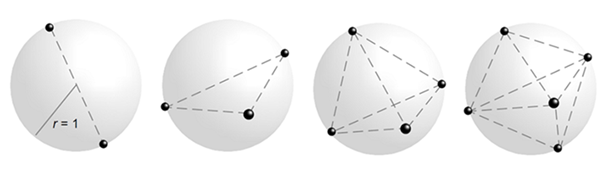
Figura 8. Le strutture risultanti nei casi più semplici del Problema di Thomson con 2, 3, 4 e 5 elettroni sulla superficie sferica di carica positiva di raggio unitario
Successivamente la teoria VSPER (Valence Shell Electron Pair Repulsion, (Gillespie and Nyholm, 1957) sarà un’applicazione del problema di Thompson: la struttura molecolare è ottenuta minimizzando l’interazione delle coppie elettroniche di valenza disponendole il più lontano possibile sulla superficie dell’atomo centrale.
In generale, come già detto, la previsione della struttura molecolare è sempre un problema di ‘Ottimizzazione della geometria mediante minimizzazione dell’energia’. Quindi, Ampère non solo ha avuto una visione stereochimica della struttura della molecola, ma è stato l’iniziatore dei metodi di ottimizzazione di geometria.
Le 23 forme rappresentative delle particelle (Figure 9 e 10) riempiono d’ammirazione per la capacità di Ampère d’aver saputo elaborare con la sola forza del pensiero, una tale complessità di strutture geometriche molecolari.
A conclusione della Lettre, Ampère afferma con soddisfazione e orgoglio:
Con questi poliedri ho rappresentato le diverse sistemazioni di tutti i corpi.
Infine, la Lettre fa riferimento al tanto lavoro che ancora resta da fare in Chimica Inorganica e in Chimica Organica:
I risultati che ho indicato sono soltanto una minima parte di quelli che si possono dedurre dalla considerazione delle forme rappresentative delle particelle dei corpi, applicata alla determinazione delle proporzioni dei composti inorganici. Anche la chimica dei corpi organizzati offre numerose applicazioni di questa teoria; ma è soprattutto a tale riguardo che rimangono ancora da fare molti calcoli e molte analisi per completarla.
La geniale teoria delle combinazioni chimiche non ebbe l’accoglienza sperata: sebbene l’esistenza di atomi e molecole fosse ampiamente riconosciuta, la Chimica non era ancora pronta ad accogliere un’interpretazione molecolare fisico-matematica. Tuttavia, ebbe fondamentali conseguenze di lungo termine, contribuendo a quel processo storico che porterà alla Stereochimica prima e alla Chimica teorica poi.
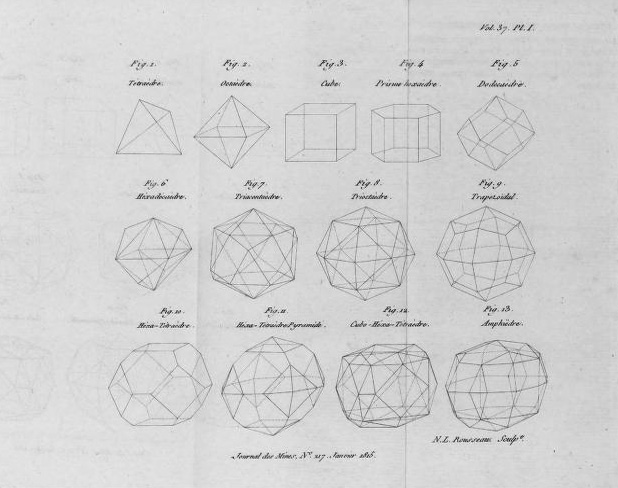
Figura 9. Alcune delle 23 forme rappresentative delle strutture molecolari proposte da Ampére
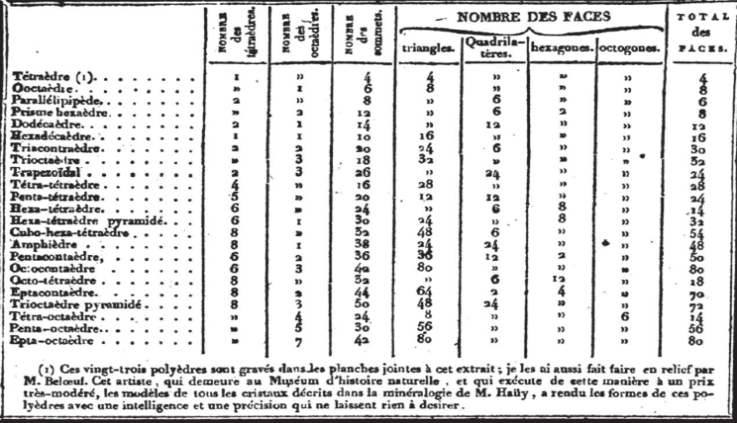
Figura 10. La tabella, acclusa alla Lettre, delle 23 forme rappresentative delle particelle in cui sono specificati il numero di tetraedri e ottaedri combinati e il numero di vertici e di facce del poliedro composto
Ampère non scriverà mai il saggio esteso che ha promesso a Berthollet. Nel 1815 scrive la Démonstration de la relation découverte par Mariotte entre les volumes des gaz et les pressions qu’ils supportent à une même température (Ampère, 1815), in cui precorre la teoria cinetico-molecolare dei gas. Infine, nell’ultimo lavoro, Note de M. Ampère sur la chaleur et sur la lumière, considérées comme résultant de mouvements vibratoires (Ampère, 1835), introduce le vibrazioni molecolari tornando a citare la Lettre del 1814.
Quale è l’eco della Lettre nel 1800? Il grande chimico Jean-Baptiste Dumas (1800-1884) nelle Leçons sur la philosophie chimique (1836) scrive:
L’hypothèse d’Ampère, aussi ingénieuse soit-elle, est absolument inacceptable.
Sebbene sia una dura stroncatura, rappresenta la testimonianza che l’eco della Lettre fosse ancora vivo. Al contrario, lo studente di Dumas, Auguste Laurent (1807-1853), nella tesi di laurea del 1837 e nei successivi lavori fino al 1842, riprende la visione stereochimica di Ampère. Trattando la reattività delle molecole organiche in reazioni di addizione e sostituzione, egli rappresenta la struttura molecolare del naftalene come un prisma esagonale C12H12 (Figura 11); inoltre, nelle reazioni di sostituzione, gli atomi di cloro o bromo sostituiscono quelli d’idrogeno, C12Br12, C12Cl12, lasciando la struttura prismatica invariata, (Figura 11), e nell’addizione di acqua, acido solforico, acido cloridrico, le molecole si addizionano sulle basi esagonali formando delle piramidi (Figura 11).
Oramai la rivoluzione scientifica è avviata e, sebbene in modo controverso, la visione stereochimica di Haüy, Ampère, Laurent si diffonde arrivando alle forme enantiomeriche dell’acido tartarico di Pasteur (1847), alla concezione dell’atomo tetravalente di Kekulé (1859), del carbonio tetraedrico di Paternò (1871) e di van’t Hoff e Le Bel (1874).
Quella di Ampère è una teoria poco nota, sbagliata nel dettaglio, ma corretta nello spirito, eclissata nell’Ottocento dalla visione positivista della realtà che rifiuta l’esistenza di atomi e molecole. Tuttavia, nonostante tutto, ebbe importanti conseguenze e tutt’oggi conserva un valore didattico, storico ed epistemologico, testimone di come il progresso scientifico avanzi in modo non lineare, non solo grazie ai successi, ma anche alla rilettura critica degli errori.
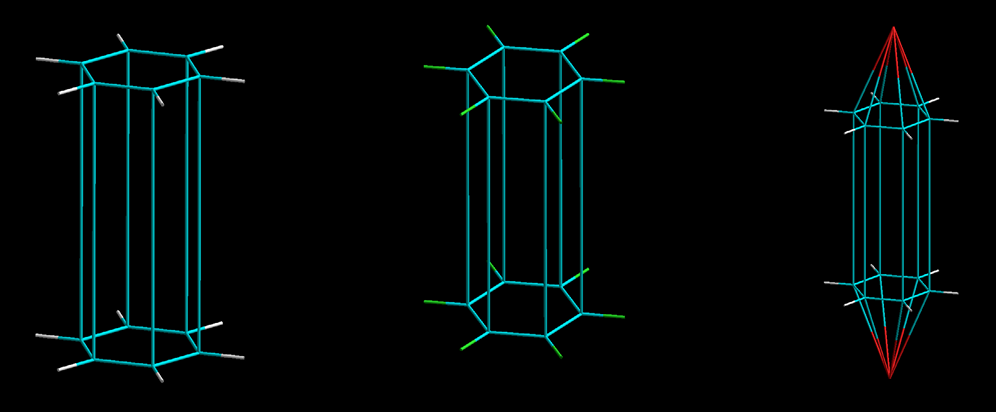
Figura 11. Le strutture stereochimiche del naftalene e suoi derivati di Auguste Laurent, rielaborate in computer graphics (la lunghezza dei legami chimici è arbitraria): il naftalene C12H12, C12Br12 o C12Cl12 e C12H12 + acqua, o acido solforico, o acido cloridrico, rispettivamente da sinistra a destra
A.-M. Ampère, Opere, a cura di Mario Bertolini, Classici della Scienza, UTET, 1969.
H. S. Coxeter, Regular Polytopes, Third ed., Dover Publications, 1973.
R. J. Gillespie, R. S. Nyholm, Inorganic stereochemistry, Quart. Rev. Chem. Soc., 1957, 11, 339.
P.-S. Laplace, Opere, a cura di Orietta Pesenti Cambursano, Classici della Scienza, UTET, 1967.
M. Scheidecker-Chevallier, R. Locqueneux, La théorie mathématique de la combinaison chimique d’André-Marie Ampère, Revue d’histoire des sciences, 1994, 47, 309-352.
V. Villani, La geniale teoria delle combinazioni chimiche di André-Marie Ampère, Rendiconti Accademia Nazionale delle Scienze detta dei XL, Memorie di Scienze Fisiche e Naturali, 137°, 2019, serie V, vol. XLIII, parte II, tomo II, pp. 197-213.
V. Villani, Molecole e interazioni molecolari nella teoria della capillarità di Laplace, Rendiconti Accademia Nazionale delle Scienze detta dei XL, Memorie di Scienze Fisiche e Naturali, 140°, 2022, Vol. III, Parte III, Tomo 1, pp. 113-119.
J. Wisniak, André-Marie Ampère. The chemical side, Educación Química, 2004, 15, 166-176.
J. Wisniak, Auguste Laurent. Radical and Radicals, Educación Química, 2009, 20, 166-176.