I protagonisti del mondo materiale
Prima parte: sabbia, sale, carbone, ferro e rame
Fabio Olmi
e-mail: fabio.olmi@gmail.com
Indice
Abstract. The article reviews the most important material substances that have characterized our world. The most important characteristics and uses of five materials are examined, namely sand, salt, coal, iron and copper. It is discussed not only the positive aspects that they have had or have on the development of the world examined, but also the big problems that they have caused with their extraction, manufacture and use. Furthermore, it is examined the negative influence that some of them have had and still have on the planet’s climate and on our survival.
Keywords: sabbia; sale; carbone; ferro; rame; aspetti positivi per il nostro sviluppo; aspetti negativi connessi al loro utilizzo
L’articolo intende passare in rassegna quelle sostanze materiali il cui utilizzo ha determinato passi essenziali dello sviluppo del mondo, che riguardano settori di vario tipo e interessano periodi di tempo vecchi, recenti ed attuali.
Si tratta di dieci sostanze materiali: sabbia, sale, ferro, rame, carbone, petrolio, cemento, litio, terre rare e idrogeno. Mi è stato molto utile, nella stesura del presente contributo, la lettura di un testo che si occupa però solo di sei di queste sostanze.1
È bene precisare subito che non è possibile guardare allo sviluppo che c’è stato nel mondo solo con occhio positivo, come molti continuano a fare, perché questo è stato accompagnato da una dilapidazione sistematica delle risorse naturali, come se fossero infinite, e con poco o nessun rispetto dell’ambiente, “regalandoci” un riscaldamento del pianeta così rapido ed elevato, che ora è necessario lottare con rapidità e determinazione per rimediare all’incuria con una decisa e generalizzata decarbonizzazione.
Il rischio è l’estinzione non del pianeta, ma della nostra stessa specie: un dato a testimonianza di quanto detto è rappresentato dalla crescita del valore della concentrazione del CO2 dall’età dello sviluppo industriale a oggi. Da quando si è iniziato a fare una misurazione continua della concentrazione del CO2 si è passati da 318 a 422 ppm (2024).
La Curva di Keeling2 (Figura 1), mostra l’aumento della concentrazione di diossido di carbonio nell’atmosfera del nostro pianeta. È il simbolo tangibile e inequivocabile dell’impatto che le attività umane hanno avuto ed hanno sulla Terra. Si può ben dire che la Curva di Keeling è uno dei prodotti scientifici più importanti e simbolici della nostra epoca.
In altre parole, lo sviluppo deve continuare, ma su “binari” diversi dal passato: deve essere uno sviluppo sostenibile, capace cioè di essere trasferito senza problemi ai nostri futuri discendenti.
Fermo restando quanto si è detto sopra, è importante esaminare alcune filiere che, partendo dai materiali presi in esame, ci forniscono le procedure che hanno condotto a molti oggetti di uso quotidiano e che ci rivelano il contributo degli sforzi intellettuali di tante persone che hanno consentito di farlo. Questo costituisce una serie di conoscenze che ci consentono di valutare con occhi diversi e apprezzare più in profondità l’oggetto che abbiamo dinanzi.
Dobbiamo d’altra parte tener presente che per poter affrontare la transizione ecologica e soprattutto energetica, abbiamo bisogno di molti materiali per costruire le apparecchiature che ci permettono di compiere questa transizione. E se cercheremo di limitare drasticamente il ricorso alle risorse minerali naturali finite, dovremo ricorrere sempre più massicciamente al recupero e riciclo di quegli oggetti e di quei materiali già impiegati e dismessi.
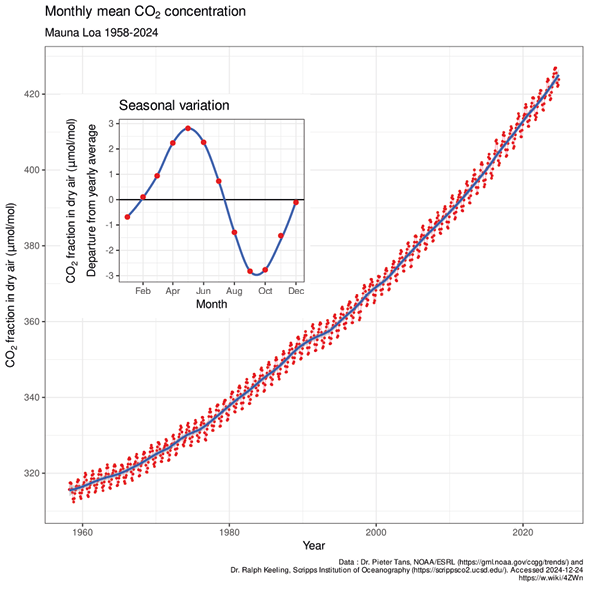
Figura 1. La curva di Keeling con l’andamento crescente e continuo della CO2 nell’atmosfera
Data la corposità dell’argomento il contributo è stato diviso in due; in questa prima parte si affronteranno solo cinque dei materiali di interesse, e cioè, sabbia, sale, carbone, ferro e rame.
È più opportuno parlare di sabbie anziché di sabbia, perché ci sono tanti tipi di sabbia per cui, in base alla provenienza, si parla di sabbia di mare, sabbia di fiume e sabbia del deserto.
La sabbia del deserto, che costituisce senz’altro la riserva più ingente di sabbia, è composta di granuli piccoli assai uniformi, con un diametro tra 0,1 e 1 millimetro, è ricca di polvere (viene mossa dal vento) e non è utilizzabile negli impieghi comuni in cui sarebbe necessaria la sabbia.
La sabbia di mare, quella che comunemente chiamiamo rena, ha granuli meno uniformi della sabbia desertica, con un diametro che varia tra 0,1 e 2 millimetri, ed è costituita da una miscela di diversi composti di difficile utilizzazione.
La sabbia di fiume, grazie alla grande presenza di silice, ha molti granuli con sfaccettature vitree che le permettono, dunque, di essere molto più facilmente individuata rispetto alle altre sabbie. Si usa soprattutto per formare la malta unita al cemento e, se si tratta di una granulometria più grossa, si impiega nel calcestruzzo. Sabbie con forte quantità di silice vengono impiegate poi per la produzione del vetro e dei microprocessori a base di silicio.
A seconda della granulosità media, le sabbie si distinguono in sabbie fini, medie e grossolane. In particolare, in base alla granulometria dei grani si hanno le tipologie riportate in Tabella 1.
In base alla composizione chimica si possono distinguere i seguenti tipi di sabbie: sabbia silicea (è usata per la formazione delle malte, per la formazione di vetri e per microprocessori a base di silicio); sabbia quarzifera (viene utilizzata principalmente nella produzione di abrasivi e quella che contiene zeoliti è usata come filtri per l’acqua); sabbia ferrosa; sabbia calcarea; sabbia micacea.
La sabbia può formarsi attraverso i seguenti meccanismi: (a) per erosione di rocce preesistenti di qualunque natura, (b) per precipitazione chimica da acque soprassature di sali e (c) per accumulo di scheletri e gusci di organismi come le conchiglie.
Tabella 1. Tipologia del materiale in base alla dimensione dei grani
|
Tipologia |
Dimensione dei grani (mm) |
|
Ciottoli |
256 – 64 |
|
Ghiaia |
64 – 4 |
|
Ghiaia fine |
4 – 2 |
|
Sabbia molto grossolana |
2 – 1 |
|
Sabbia grossolana |
1 – 1/2 |
|
Sabbia media |
1/2 – 1/4 |
|
Sabbia fine |
1/4 – 1/8 |
|
Limo |
1/16 – 1/256 |
|
Argilla |
< 1/256 |
Vediamo ora i più importanti impieghi a seconda dei tipi di sabbia.
2.1 Formazione di malte
La formazione di malte è essenziale come collante di pietre e mattoni per le costruzioni. Una malta contiene generalmente 3-4 parti di sabbia, 1 parte di cemento (portland) e una parte di acqua. La sabbia impiegata è quella di fiume.
Riparleremo della malta quando esamineremo le caratteristiche del cemento, altra sostanza base del nostro mondo.
2.2 Fabbricazione del vetro e vari tipi di vetro
Il vetro comune si ottiene a partire da sabbia silicea, ma ad essa si aggiungono altri composti che hanno funzioni diverse: i fondenti (come ossido di sodio o di potassio) che hanno la funzione di abbassare la temperatura di fusione della massa e gli stabilizzanti (ossidi calcio o magnesio) che hanno la funzione di rendere il vetro più resistente agli attacchi atmosferici. Si preparano poi vetri speciali con l’aggiunta di altri composti, come mostrato in Tabella 2.
Quando la massa preparata viene portata a fusione (tra i 1300 e i 1500 °C) le strutture cristalline dei componenti la miscela collassano formando una miscela di atomi disordinata che, per raffreddamento rapido, dà un solido trasparente amorfo (liquido sopra raffreddato) che presenta la tipica struttura del vetro; se non sono state fatte aggiunte, ha l’aspetto limpido e incolore.
Il vetro non ha una temperatura di fusione definita, ma un intervallo di rammollimento in quanto prodotto amorfo. I vetri variano il loro grado di viscosità diventando prima pastosi e successivamente fluidi.
Tabella 2. Principali tipi di vetri speciali
|
Tipo di vetro |
Composizione |
|
Vetro di Boemia |
Silicati di potassio; silicati di calcio |
|
Cristallo |
Silice pura (oltre il 50%); silicati di potassio; silicati di piombo |
|
Vetri armati |
Silicato di sodio; silicato di calcio; sottile rete metallica |
|
Vetro Pyrex |
Silice (80%); triossido di diboro (13%); piccole quantità di silicati di sodio e alluminio |
|
Vetri colorati |
Silicati di sodio e di calcio con aggiunta di ossidi metallici di vario tipo |
|
Vetro specchio |
Silicati di sodio, potassio calcio; su una faccia viene depositato un sottile strato di nitrato d’argento protetto da apposite vernici |
2.2.1 Vetri colorati
Questi vetri li ammiriamo nelle finestre di tante chiese e sono il risultato dell’aggiunta alla massa da fondere di vari composti in parte allo stato ionico, in parte come coloranti colloidali.
La Tabella 3 fornisce un elenco di queste sostanze coloranti.
Tabella 3. Elenco dei coloranti usati nei vetri e dei colori ottenuti
|
Tipo di colorante |
Colorazione ottenuta |
|
|
Condizioni ossidanti |
Condizioni riducenti |
|
|
Coloranti ionici |
||
|
Cobalto ossido |
Blu |
Blu |
|
Rame ossido |
Acquamarina |
Verde |
|
Manganese |
Viola |
|
|
Cobalto-Manganese |
Ametista, nero |
Ametista, nero |
|
Ferro |
Giallo |
Verde-blu |
|
Zolfo-ferro |
Giallo-ambra |
|
|
Coloranti colloidali |
||
|
Zolfo-Cadmio |
Giallo |
|
|
Zolfo-Cadmio-Selenio |
Rosso |
|
|
Rame |
Rosso-rubino |
|
|
Oro |
Rosso-rubino |
|
|
Argento |
Giallo |
|
2.2.2 Vetri speciali
Si tratta di vetri che assumono proprietà inaspettate del tutto particolari come, ad esempio, i vetri antiproiettile, capaci cioè di non infrangersi all’impatto con una pallottola sparata da una pistola o da un fucile. Qual è il segreto che attribuisce al vetro queste caratteristiche? Il segreto sta nel conferire al vetro rigido una certa flessibilità e questo si ottiene predisponendo un vetro multistrato contenente al suo interno uno o più lamine di materiale plastico trasparente (elastomeri). Se il vetro viene colpito da un proiettile, gli elastomeri mantengono la lastra coesa, impedendone il cedimento a causa dell’urto. La figura 2 mostra lo schema della struttura di un vetro simile.
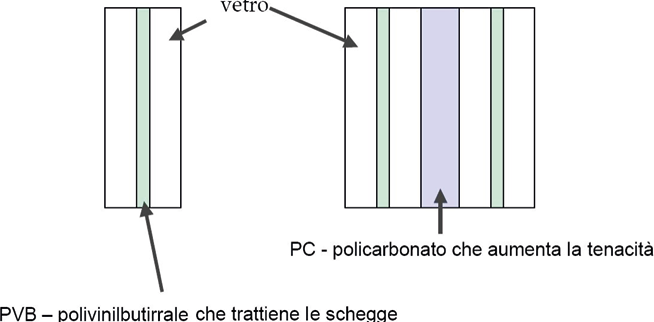
Figura 2. Schema della struttura di un vetro antiproiettile
Un altro tipo di vetro è quello dei parabrezza. Qui il problema da risolvere è stato quello di evitare che, a seguito di un urto con un oggetto, i vetri si potessero frantumare generando pericolose schegge per il guidatore. La prima variante è stata quella di usare per i parabrezza vetro temperato.3 Il vetro indurito in tal modo si spacca in tantissimi frammenti piccoli e per lo più innocui. Successivamente, nei parabrezza questo tipo di vetro fu sostituito con vetro laminato.
Un caso particolare è quello dei parabrezza per aerei che, operando ad alte quote (basse temperature) e a forti velocità, sono dotati di parabrezza riscaldati al loro interno dalla corrente elettrica che attraversa un sottile strato di diossido di stagno, accorgimento che permette al vetro di non appannarsi all’interno e di non gelare all’esterno.4
2.2.3 Vetro per l’edilizia
Il vetro non è più solo sinonimo di finestre ma è diventato sinonimo anche di pareti. I piani dei giganteschi grattacieli, sempre più numerosi in ogni parte del mondo, sono infatti fasciati di pareti di vetro; ne è un esempio famoso il palazzo delle Nazioni Unite a New York, costruito ormai tanti anni fa e chiamato non a caso “Palazzo di vetro”.
La costruzione di un grattacielo si fonda sulla struttura portante fatta di cemento armato e acciaio e “l’abito esterno” sarebbe impensabile senza l’uso del vetro. Una struttura di questo genere porta però due importanti conseguenze: da un lato ci sono le tensioni dovute al caldo/freddo e dall’altro le vibrazioni/oscillazioni a cui viene sottoposta la struttura per effetto del vento, sempre più ampie quanto maggiore è la sua altezza. Inoltre, c’è da tenere presente anche l’esigenza di mantenere all’interno una temperatura gradevole e questo comporta spese elevate per la climatizzazione interna.
Si tratta dunque di vetri fatti e lavorati in modo particolare. Sono i cosiddetti vetri basso-emissivi (Love-E) che, mentre riflettono la radiazione esterna e minimizzano anche la trasmissione interna, permettono un ottimo equilibrio energetico combinando un maggior isolamento termico e un apporto ottimale di luce dall’esterno.5 La sfida tecnologicamente più impegnativa si è avuta a Dubai nella costruzione della torre dell’emiro Khalifa alta 829 metri (Figura 3), che è in grado di resistere a venti con velocità di 250 Km/h e a oscillazioni fino a 2,5 metri di raggio.

Figura 3. La torre dell’emiro Khalifa a Dubai
2.3 Silicio cristallino per i chips
Il silicio elementare si prepara da SiO2, è un semiconduttore e si impiega per la costruzione di circuiti integrati, transistor e chips elettronici. Si preparano i cosiddetti wafer di silicio,6 sottilissimi dischetti di silicio purissimo che costituiscono il supporto dei circuiti integrati.
Un circuito integrato (integrated circuit, in sigla IC) è un circuito elettronico miniaturizzato dove i vari transistor sono stati formati tutti nello stesso istante grazie a un unico processo fisico-chimico.
Un chip (letteralmente “pezzetto”) è il componente elettronico composto da una minuscola piastrina del wafer di silicio (Figura 4, sinistra), a partire dalla quale viene costruito il circuito integrato; in pratica, il chip è il supporto che contiene gli elementi (attivi o passivi) che costituiscono il circuito. A volte si utilizza il termine chip per indicare complessivamente l’integrato. Viene realizzato a partire dal wafer di un semiconduttore (generalmente silicio), attraverso diverse scale di integrazione, e rappresenta il core, o nucleo o dispositivo di elaborazione del processore.
L’ideazione del circuito integrato si deve a Jack St. Clair Kilby (Figura 4, destra), che nel 1958 ne costruì il primo esemplare composto da circa dieci componenti elementari, cosa che gli valse il Premio Nobel per la Fisica nel 2000.

Figura 4. Wafer di silicio (sinistra) e Jack St. Clair Kilby, ideatore del circuito integrato (destra)
Un circuito integrato (IC, o, come già detto, CHIP), è un dispositivo elettronico nel quale, gli elementi attivi (transistor, diodi, ecc.) e gli elementi passivi (resistori, condensatori, ecc.), sono contenuti all’interno di una singola piastrina di materiale semiconduttore.7 Esso è il prodotto della tecnologia avanzata dell’industria dei semiconduttori, cioè della capacità che hanno oggi le industrie di costruire milioni di transistori in un solo chip di semiconduttore.
2.4 La fibra ottica, rivoluzione nelle comunicazioni via cavo
Le fibre ottiche sono dei sottilissimi speciali “fili di vetro” che sono state inventate nel 1955 dal ricercatore inglese Nardiner S. Kanapy. Si tratta di filamenti di vetro capaci di guidare al proprio interno la luce, basati sulla proprietà della luce di propagarsi da un capo all’altro del filamento percorrendolo rimbalzando sulle pareti interne senza disperdersi all’esterno. La Figura 5 mostra lo schema dell’interno di una fibra ottica.

Figura 5. Insieme di fibre ottiche e schema interno di una fibra ottica
La scoperta ha trovato vastissime applicazioni nelle comunicazioni telefoniche, televisive e nella trasmissione di dati. Si tratta di trasformare un impulso elettrico in impulso luminoso e immetterlo nella fibra ottica; all’altro capo del “filo” l’impulso luminoso viene nuovamente trasformato in impulso elettrico. I vantaggi di questo metodo di trasmissione rispetto all’uso di fili di rame sono enormi: una fibra ottica non subisce interferenze elettriche e il segnale trasportato non risulta disturbato. Inoltre, il segnale si può trasmettere a grande distanza senza bisogno di amplificazione, cosa invece necessaria per un messaggio elettrico.
La silice purissima per la fibra ottica si prepara a partire dal SiCl4 secondo la reazione:
SiCl4 + O2 → SiO2 + 2Cl2
Le fibre ottiche sono costituite da una parte interna (nucleo) a indice di rifrazione più alto della parte circostante (mantello): si tratta di silice con droganti. Per ottenere questo indice di rifrazione più elevato si utilizza il GeO2. La fibra si presenta dunque come un cilindro di silice del diametro di un centinaio di micron con una parte interna composta da silice debolmente drogata con germanio.8
I sali sono molti ma quando si dice sale si intende comunemente il “re dei sali”, il sale da cucina, il cloruro di sodio.9 Il sale ha rappresentato nella storia una sostanza molto importante e anche oggi rappresenta l’origine di molti importanti composti.
“Il sale entra di diritto nel novero dei protagonisti del Mondo materiale, non solo per le sue straordinarie proprietà, ma per ciò che ci ha permesso di fare … Nella nostra storia e nel nostro presente il sale è ovunque”. Così si pronuncia a proposito del sale Ed Conway nel suo recente libro “La materia del mondo”, già citato.1 Il nostro corpo ha bisogno di sale per permettere a nervi, muscoli e tendini di funzionare correttamente (passaggio degli impulsi elettrici). A parte la salatura dei cibi, fino all’invenzione dei frigoriferi, il sale era il principale mezzo di conservazione dei cibi (ad esempio carni e pesci).
A Ibiza e Maiorca il sale viene lavorato sin dall’epoca dei fenici: attraverso un sistema di canali e di chiuse, l’acqua del mare viene convogliata in una serie di laghi dove, riscaldata dal Sole, evapora lentamente trasformandosi in salamoia sempre più concentrata da cui alla fine è possibile estrarre i cristalli di sale (fior di sale). In Italia la strada statale SS4 che collega Roma con Porto d’Ascoli, è una via del sale che segue il percorso della via Salaria di epoca romana: l’Adriatico è stato per migliaia di anni uno snodo di produzione del sale. Almeno fin dall’epoca medievale il sale di Venezia raggiungeva Modena e Parma e altre località delle rive del Po, dove veniva usato per la produzione di prosciutto e formaggio. “Il sapore caratteristico del parmigiano-reggiano è dovuto al fatto che le forme, prima della stagionatura, vengono lasciate per 20 giorni in salamoia”.10
Per gran parte dell’antichità il sale era indice di ricchezza e in Africa i mercanti lo scambiavano con l’oro e veniva usato come moneta per pagare le merci. I romani furono i primi a fornire una razione di sale ai propri soldati come diaria (da cui la parola salario). Uno dei primi provvedimenti in vista di una guerra era fare scorte di sale. I governi hanno sempre cercato di esercitare il proprio potere anche attraverso il sale controllandolo e tassandolo. In Cina, nel corso della lunghissima storia delle istituzioni cinesi, si riconosce una costante: il monopolio del sale e questo è sopravvissuto fino al XXI secolo.
Famosa è la gabelle francese che tassava il sale e che in certe zone della Francia raggiungeva livelli esorbitanti. A tempi di Luigi XIV (1638-1715) la gabelle era la chiave portante delle finanze pubbliche francesi. Non meraviglia che al cuore della Rivoluzione Francese ci fosse proprio la gabella sul sale: era il simbolo di tutto ciò che non andava nell’ancien regime.
In Italia si è pagata l’imposta sul sale dall’unificazione del Regno fino al 1974. Era un tributo antico e veniva corrisposto anche ai tempi in cui il Paese era suddiviso in piccoli Stati. Si prevedeva l’istituzione, per la fabbricazione e la vendita o per la vendita soltanto, di un monopolio a favore dello Stato per calmierarne il prezzo, vietandone ai privati la fabbricazione e la vendita, oppure la sola vendita. Nel 1974 la legge che l’istituiva fu abrogata e così l’imposta sul sale.
Esistono tre modi per ottenere il sale: si può ricavare per evaporazione dell’acqua di mare, operazione già nota ai tempi del Neolitico, oppure si può estrarre da miniere (salgemma) allo stato solido, e ancora si può estrarre dalla terra sottoforma di salamoia, una soluzione salina che contiene oltre il 30% di sale. È questo il procedimento più usato in quelle parti del mondo in cui il calore solare non è sufficiente a evaporare l’acqua di mare.
L’utilizzo del sale come tale è ben noto: si impiega nell’insaporimento dei cibi, per la conservazione di carni e pesci e come prodotto di partenza per molte sostanze di uso quotidiano. A rendere così importante il cloruro di sodio all’interno del Mondo materiale è il fatto che oggi è alla base di gran parte dell’industria chimica e di quella farmaceutica.
3.1 Il sale e alcuni suoi derivati nell’industria chimica
Uno dei processi industriali più importanti è il processo cloro-soda. Serve a produrre cloro e soda caustica e può essere realizzato con una cella a membrana, la cui struttura è mostrata in figura 6.11
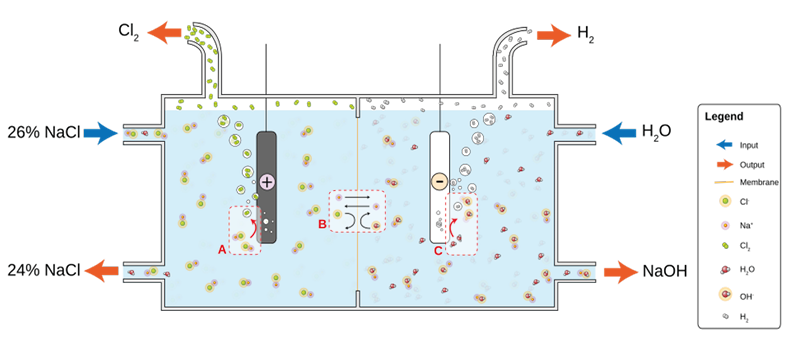
Figura 6. Schema di funzionamento di una cella a membrana per la produzione di cloro-soda
Si tratta di una elettrolisi di cloruro di sodio/potassio in soluzione acquosa all’interno di una cella a due comparti separati da una membrana semipermeabile a scambio ionico, costituita da una resina perfluorurata, permeabile a Na+ e H2O, ma non a OH– e Cl–. La salamoia concentrata di cloruro di sodio viene introdotta nel primo comparto (cella anodica) dove gli ioni Cl– si ossidano all’anodo formando cloro (Cl2). Nel comparto catodico gli ioni Na+ in soluzione con gli ioni OH– producono NaOH, mentre all’elettrodo si sviluppa H2.
La reazione completa dell’elettrolisi del cloruro di sodio è:
2NaCl + 2H2O → Cl2 + H2 + 2NaOH
Come si utilizzano i prodotti ottenuti da questo processo (messo a punto nel lontano 1892) e cosa si produce da questi prodotti?
3.1.1 Utilizzo di NaOH
La soda caustica viene impiegata nella sintesi di coloranti, di detergenti e saponi, nella fabbricazione della carta e nella produzione di ipoclorito di sodio.
Ad esempio, come si prepara un sapone? Il sapone è un sale alcalino che si forma unendo un grasso (vegetale o animale) e una base forte (come la soda caustica). Più precisamente, è di solito un sale di sodio o di potassio di un acido carbossilico alifatico a lunga catena (Figura 7), che ha la caratteristica di sciogliere le sostanze grasse.

Figura 7. Strutture chimiche di un sapone
Si prepara per mezzo di un processo denominato saponificazione, ovvero per idrolisi alcalina, di acidi grassi di origine animale o vegetale. Il processo porta alla formazione del sale carbossilico (il sapone) e un alcol (comunemente, glicerina).
3.1.2 Utilizzo del cloro e di alcuni suoi derivati
Il cloro è un importante agente chimico utilizzato nella depurazione dell’acqua, nei disinfettanti e come sbiancante; è stato fra le prime armi chimiche impiegate su vasta scala, in forma gassosa essendo un forte vescicante.12
Si usa inoltre nella fabbricazione di molti oggetti di uso quotidiano, come carta, antisettici, tinture, alimenti, insetticidi, vernici, prodotti petroliferi, plastica, medicinali, tessuti, solventi.
Da Cl2 in ambiente basico si ottiene lo ione ipoclorito, ClO–, in base alla seguente reazione:
Cl2 + 2OH– → Cl– + ClO– + H2O
L’ipoclorito di sodio si impiega nei sistemi di depurazione dell’acqua e nel detergente candeggina. Il processo di disinfezione dell’acqua garantisce l’inattivazione microbica anche per i patogeni più resistenti eventualmente presenti. L’efficacia del trattamento è funzione della concentrazione del disinfettante introdotto nell’acqua e del tempo di contatto ed è strettamente legato alle caratteristiche specifiche dell’acqua da trattare.13
Un derivato particolarmente importante del cloro è il PVC, uno dei prodotti industriali più studiati dal punto di vista tecnico-industriale e regolatorio di compatibilità con la salute e l’ambiente. L’industria del PVC è un’industria “matura” che nasce nel 1936 e i suoi processi di fabbricazione si sono adeguati agli standard più severi per la protezione dei lavoratori, consumatori e ambiente.
Il PVC è la sigla del policloruro di vinile –(CH2-CHCl)n– e rappresenta una delle materie plastiche più utilizzate al mondo, essendo difficilmente infiammabile: nel 2019 la produzione mondiale è stata di oltre 47 milioni di tonnellate. Il polimero si ottiene dalla polimerizzazione del cloruro di vinile monomero ed è costituito dal 57% di cloro proveniente dal sale da cucina e dal 43% da carbonio e idrogeno derivanti da un prodotto petrolifero.14
Dal 1845 il cloruro di vinile si ottenne facendo reagire l’1,2 dicloroetano con una soluzione di idrossido di potassio in etanolo. Più tardi si ottenne da acetilene e acido cloridrico in presenza di cloruro di mercurio(II) come catalizzatore.15
Partendo da etene la reazione è:
2CH2=CH2 + 2HCl + O2 → 2CH2=CHCl + 2H2O
La reazione di polimerizzazione del cloruro di vinile porta alla formazione di lunghe catene lineari e viene innescata dall’aggiunta di un iniziatore, un composto capace di generare radicali:
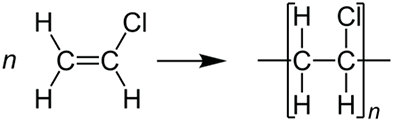
Gli utilizzi del PVC sono molto numerosi: può essere modellato per stampaggio a caldo nelle forme desiderate, estruso, calandrato16 o ridotto a liquido per la spalmatura di tessuti, serbatoi, vasche e fibre tessili artificiali.
Le applicazioni più rilevanti sono la produzione di tubi per l’edilizia (ad esempio, grondaie e tubi per acqua potabile), la protezione di cavi elettrici, profili per finestre, pavimenti vinilici, pellicola rigida e plastificata per imballi e cartotecnica.
In termini applicativi, il PVC è la materia plastica più versatile conosciuta. È il “vinile” per antonomasia usato per la produzione dei dischi.
Di PVC per uso tessile ne esistono più tipi. Il primo tipo, commercialmente chiamato Movil, fu prodotto in Francia già nel 1949 a partire da PVC essenzialmente amorfo. Un secondo tipo, commercialmente chiamato Leavil, è costituito da PVC cristallino ed è di qualità migliore.
Nel complesso la produzione di fibre cloroviniliche è stata, però, quasi abbandonata.
3.1.3 Utilizzo del sodio
Sta prendendo sempre più importanza l’utilizzo del sodio per produrre batterie agli ioni di sodio, Na+, assai più economiche di quelle al Li+ e più facilmente accessibile come materiale. Il processo di produzione delle batterie agli ioni sodio è analogo a quello delle batterie agli ioni litio e più semplice (per le caratteristiche meno reattive del sodio).
Le batterie agli ioni sodio sono però meno potenti di quelle al litio,17 ma possono rendere l’Europa indipendente nell’approvvigionamento della materia prima e anche qui si può applicare la circolarità dei materiali impiegati nella costruzione.
Dovrebbero arrivare sul mercato tra un paio d’anni le prime batterie per auto elettriche a base di sodio e le produrrà per prima la Cina.18 Le batterie saranno installate su una city car prodotta dalla cinese BYD (Build Your Dreams) e si calcola che verrà messa sul mercato a circa 10.000 dollari.
Le batterie al sodio presentano, però, alcuni problemi come concorrenti di quelle al litio: forniscono una densità di carica inferiore di quelle al litio, il che si traduce in un’autonomia ridotta per le auto elettriche; hanno una velocità di ricarica assai più ridotta di quelle al litio; inoltre, essendo una tecnologia relativamente giovane, richiedono ulteriori sviluppi per ottimizzare le prestazioni e garantire l’affidabilità a lungo termine.
Il carbone, come è noto, è un combustibile solido composto prevalentemente da carbonio che si è formato in natura per decomposizione anaerobica di sostanze organiche vegetali. La sua genesi e le sue caratteristiche sono illustrate nella Scheda 1, riportata di seguito.
Recenti ritrovamenti indicano che il carbone veniva utilizzato come combustibile già nel 1600 a.C.: tracce di carbone sono state trovate nelle rovine di Jiren Taigoukounello e Xinjiang in Cina, anche se si suppone che la scoperta sia stata casuale. Per quanto riguarda tempi “relativamente più recenti”, nel 1000 a.C. circa, si hanno tracce dell’uso di una vera miniera di carbone scoperta sempre in Cina e anche della commercializzazione del carbone estratto.
In occidente gli antichi greci e poi i romani lo estraevano e lo utilizzavano sia per scaldarsi che per produrre opere di artigianato. Nel tardo Medioevo il carbone è stato utilizzato nei Paesi Bassi nella provincia di Limburgo e anche in Inghilterra nella città di Newcastle.
È, però, solo con la Rivoluzione Industriale (1760-1840) in Inghilterra che il carbone diventa il protagonista fondamentale della produzione energetica mondiale.19 Per avere un’idea dell’entità della quantità di carbone che è stata utilizzata a partire da questo periodo basta ricordare che la produzione mondiale passò da circa 10 milioni di tonnellate nel 1700 a circa 70 milioni nel 1850 e si sono toccati gli 800 milioni di tonnellate nel 1900.
Se nella Rivoluzione Industriale il carbone è stato la fonte energetica fondamentale, sono state le macchine a vapore (a carbone) a determinare il grande incremento dell’industrializzazione. Fu lo scozzese James Watt (1765) a inventare la prima macchina a vapore alimentata a carbone che diventò il simbolo della rivoluzione industriale: ne furono costruite varie versioni per poterla utilizzare in varie situazioni (Figura 8). Fu questa macchina che determinò la nascita della moderna fabbrica industriale. L’applicazione della macchina a vapore alla tessitura con l’invenzione della prima macchina automatica per tessere (Edmund Cartwright, 1785) determinò una vera e propria rivoluzione economico-sociale e i processi lavorativi meccanizzati rimpiazzarono progressivamente il lavoro manuale a domicilio dando origine, da un lato, al nascere della classe operaia e, dall’altro, a quella del capitalismo industriale.

Figura 8. Schema della macchina a vapore di J. Watt
Nel 1814 iniziò la rivoluzione del trasporto terrestre con l’invenzione della prima locomotiva a vapore di George Stephenson (Figura 9): nel 1830 fu inaugurata la prima linea ferroviaria Liverpool-Manchester e il 3 ottobre 1839 veniva inaugurata la prima linea ferroviaria italiana la Napoli-Portici.

Figura 9. Locomotiva a vapore di Stephenson
Un forte incremento dei trasporti marittimi si ebbe poi con il passaggio dalle navi a vela a quelle a vapore. Fu nel 1807 che una nave a vapore salpò dal porto di New York navigando per trentadue ore. In Europa furono la Francia e la Gran Bretagna a costruire i primi “vapori”; in Italia fu il governo di Napoli che varò il vapore “Ferdinando I” che da Napoli navigò fino a Marsiglia.
Nonostante che il carbone sia stato progressivamente spodestato dal petrolio molto più agevole da spostare e utilizzare, oggi la produzione è di circa 8 miliardi di tonnellate20 e, benché costituisca il peggior produttore di CO2 nell’atmosfera, causa principale del riscaldamento del pianeta, la sua produzione e il suo consumo, dopo una leggera inflessione dal 2017 al 2020, continua a crescere sia pure debolmente (Figura 10, sinistra): nel 2013-2014 ne sono state prodotte 7976 milioni di tonnellate (Mton) e, nel 2018-2019, 7940 Mton, con Cina e India fra i maggiori produttori.21 La situazione europea è leggermente migliore (Figura 10, destra); ad oggi in Europa rimangono solo due grandi produttori: Polonia e Cecoslovacchia.
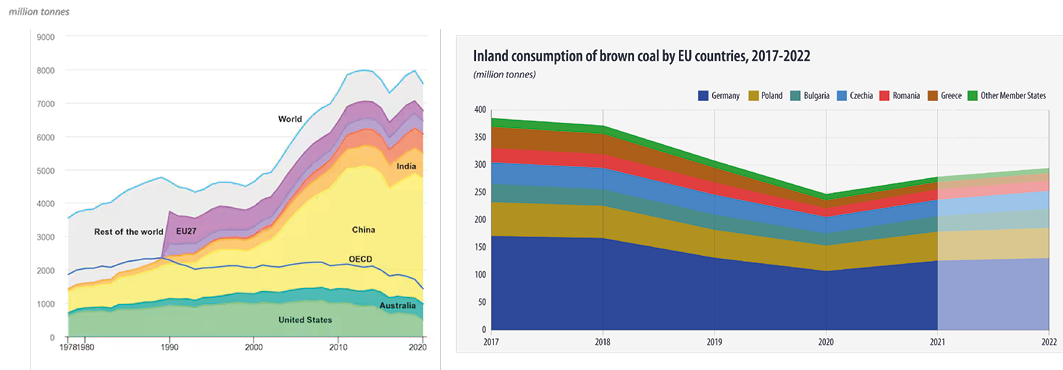
Figura 10. Consumo di carbone a livello mondiale nel periodo 1978-2020 (sinistra) e in Europa nel periodo 2017-2022 (destra)
Scheda 1
Genesi e caratteristiche del carbone
Le biomasse prodotte milioni di anni fa, sommerse durante il periodo Carbonifero dell’Era primaria, furono ricoperte da sedimenti e, sotto l’effetto della pressione e della temperatura, misero in atto una serie di processi chimico-fisici e biologici (carbonificazione) fuori del contatto dell’aria e concentrarono il carbonio presente nel legno generando il carbone. Tuttavia, i prodotti ottenuti da questo processo, a seconda della durata temporale, sono diversi per quanto riguarda le percentuali di carbonio: torba (circa 60% di C), lignite circa 70% di C), litantrace (circa 80% di C) e infine l’antracite (circa 95% di C). Se il processo giunge a produrre il 100% di C si forma la grafite che, pur essendo un ottimo conduttore di elettricità e calore, non è però combustibile.
Le impurezze contenute nel carbone generano una combustione molto “sporca” di fumi e polveri che richiede interventi impegnativi, sia tecnologicamente che economicamente, per evitare gravi danni all’ambiente e alla salute umana.
I metodi con cui viene utilizzato il carbone sono essenzialmente tre: combustione diretta, combustione come coke negli altiforni per la preparazione del ferro e gassificazione.
Il coke è il risultato della distillazione (pirolisi) del carbone ed è un solido resistente al carico del minerale negli altiforni.22 Il processo di gassificazione del carbone produce il cosiddetto gas di sintesi che veniva impiegato a scopi energetici: era il cosiddetto “gas di città”, ora è in disuso. Per gassificazione si può ottenere gas d’aria, gas d’acqua e gas misto: nel primo caso si tratta di far passare aria in difetto sul carbone rovente ottenendo una miscela di CO, H2 e CH4; nel secondo caso si fa passare vapor d’acqua su carbone a 1000°C ottenendo una miscela contenente 40% di CO e 50% di H2 (tre volte più calorifica di quella del gas d’aria).
Il ferro rappresenta senza dubbio il “re dei metalli” per la sua abbondanza e la sua grande versatilità di impiego. Il ferro, però, combinandosi facilmente con l’ossigeno, non si trova allo stato nativo, ma sottoforma di suoi composti essenzialmente ossigenati. I più importanti di questi, dove il ferro si trova in percentuali economicamente vantaggiose, sono l’ematite, la magnetite e la limonite, meno ricchi sono la siderite e la pirite.23
La storia dell’umanità è stata scandita prima dall’uso e dalla lavorazione della pietra e successivamente dalla metallurgia per ottenere e lavorare metalli. Questa attività è stata caratterizzata, all’inizio, dall’età del rame e del bronzo (lega di rame e stagno) e, solo più tardi, da quella del ferro; la ragione è di natura chimico-fisica: il rame e il bronzo si ottengono molto più facilmente del ferro dai loro minerali perché hanno punti di fusione più bassi.24
Per ottenere rame e bronzo è sufficiente trattare il minerale con riscaldamento in forno a legna, per ottenere il ferro sono necessari due salti tecnici: l’uso del carbone come combustibile (che permette di ottenere temperature più elevate) e l’impiego di un mantice per insufflare aria in modo da aumentare la temperatura della combustione; questo naturalmente fu acquisito più tardi della fusione dei minerali di rame. La figura 11 mostra lo schema di due tipi di antichi forni.
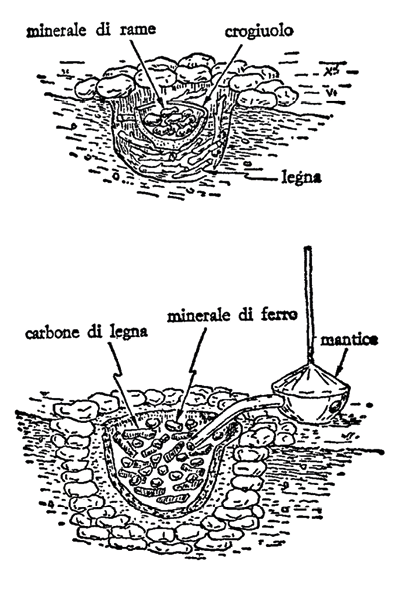
Figura 11. Schema di due tipi di forni antichi
La storia ci dice che già nel 3000 a.C. la tecnologia del bronzo era diffusa a partire dal Vicino Oriente e impiegata per fabbricare armi e armature; sembra che l’evento più famoso dell’età del bronzo sia stata la guerra di Troia. In Europa l’età del bronzo si sviluppò più tardi, a partire da circa l’anno 1800 a.C. L’età del ferro ebbe inizio tra il 1000 e il 700 a.C. e sembra che il segreto per la fusione del ferro sia stato scoperto nell’Asia Minore, dove gli Ittiti crearono un grande impero fabbricando con il ferro armi e corazze.
Per comprendere l’enorme importanza che il ferro ha nel mondo riprendiamo alcune affermazioni tratte dal libro di Ed Conway.1
“L’acciaio è uno di quei materiali su cui i leader politici tendono a sviluppare una fissazione poiché alimenta praticamente ogni altro processo produttivo. Il ferro è ciò che ci permette di fare: costruire, viaggiare fabbricare e anche ucciderci a vicenda. Rappresenta il 95% circa dei metalli che usiamo. È talmente essenziale da essere un ottimo indicatore degli standard di vita di un Paese al pari del suo PIL. In quasi tutti i Paesi ricchi una persona, nell’arco della sua esistenza, ha a disposizione quasi 15 tonnellate di acciaio (nelle case, nelle automobili, negli ospedali, nelle scuole, negli armamenti, …). In Cina si scende a circa 7 tonnellate pro capite e in Africa, nei paesi sub sahariani, si arriva a malapena a 1 tonnellata a testa. Spesso non lo ricordiamo, ma il ferro scorre nel nostro corpo all’interno dei vasi sanguigni legato all’emoglobina dei nostri globuli rossi. È il secondo metallo più abbondante della crosta terrestre (il primo è l’alluminio).”
La storia della lavorazione del ferro appare come una sequela di prove empiriche; abbiamo scoperto come produrre acciaio a livello industriale a metà del XIX secolo, quando Sir Henry Bessemer progettò il convertitore della ghisa in acciaio.
È stato Donald Trump che ha affermato “Se non hai l’acciaio, non hai un Paese”.
Come si ottiene oggi il ferro dai suoi minerali? Con la siderurgia degli altiforni, le caratteristiche e il funzionamento dei quali sono riportati nella Scheda 2. Attualmente, però, per abbattere l’inquinamento si cerca di sostituire l’alimentazione a carbone con l’idrogeno. In Svezia c’è un impianto già attivo alimentato a idrogeno. Si sta tentando di battere questa strada anche in Italia e precisamente nell’impianto di Taranto, l’ex ILVA, ma la prospettiva appare assai incerta per le vicende economiche che affliggono tale impianto (attualmente è in attività solo un forno e la produzione è molto scarsa, dell’ordine di due milioni di tonnellate all’anno).
Ricordiamo che la maggior parte dell’acciaio italiano è ottenuto dal riciclo dei rottami con la loro rifusione in forni elettrici: si tratta all’incirca dell’80% della nostra produzione. Tuttavia, non è possibile rinunciare anche alla sua preparazione attraverso l’impiego del minerale per la sua grande utilizzazione.
Scheda 2
La tecnologia dell’altoforno25
L’altoforno classico non è una struttura isolata, ma è connesso a un serie di apparecchiature che ne permettono il funzionamento: sili per immagazzinare il minerale, apparecchi di preparazione del minerale e del coke, magazzini del coke e dei fondenti, apparecchi di preparazione delle “cariche” dosate da immettere nell’altoforno, elevatore per il trasporto delle cariche alla bocca dell’altoforno, impianti di presa per la depurazione del gas prodotto, apparecchi che insufflano aria alla base della struttura (Figura 12).
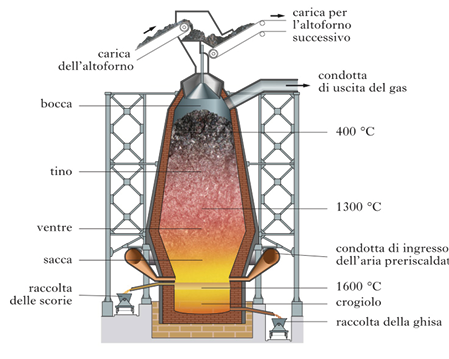
Figura 12. Schema di un altoforno
I processi chimici che portano alla separazione del ferro dai suoi minerali sono piuttosto complessi, si può dire semplicemente che si tratta di una serie di reazioni che coinvolgono prima l’ossido di carbonio (CO) e successivamente il carbonio nel sottrarre al minerale l’ossigeno liberando così il metallo. Essenzialmente si hanno le seguenti reazioni:
CO2 + C → 2CO
3Fe2O3 + CO → 2Fe3O4 + CO2
Fe3O4 + CO → 3FeO + CO2
FeO + C → Fe + CO
È l’aria calda alla base del forno che alimenta la combustione del coke e si forma una corrente ascendente costituita da aria e dai prodotti della combustione (CO, CO2). Il forno viene caricato dall’alto alternativamente con strati di minerale mescolato a fondente e strati di carbon coke: questo ha una duplice funzione, brucia mantenendo elevata la temperatura del forno e reagisce con l’ossido di ferro liberando il ferro metallico. La temperatura dell’altoforno varia da circa 1600 °C all’altezza del crogiolo a circa 200-220 °C della parte alta del forno. In genere gli stabilimenti siderurgici vengono costruiti vicino al mare sia per agevolare il trasporto del minerale, del carbone e del fondente che per favorire la spedizione dei prodotti in ghisa e acciaio.
La siderurgia dell’altoforno classico a carbone ha l’esigenza di eliminare i composti inquinanti: polveri e gas. Sono ben note le tecnologie di disinquinamento, il fatto, però, è che non vengono sempre impiegate.
L’altoforno produce ghisa e non acciaio: la ghisa, infatti, contiene una forte percentuale di carbonio e per ottenere l’acciaio è necessario ridurne la sua percentuale. A seconda della percentuale residua di carbonio si hanno diversi tipi di acciai, come mostra la Tabella 4.
Tabella 4. Diverse percentuali di carbonio caratterizzano diversi tipi di acciai
|
Carbonio (%) |
Caratteristiche |
Usi |
|
|
Ghisa |
3 – 6 |
Non fucinabile, subisce la tempra |
Produzione dell’acciaio e di pezzi fusi |
|
Ferro dolce |
0,05 – 0,25 |
Facilmente saldabile, non subisce la tempra |
Lamiere da caldaia, tubi, apparati elettrici |
|
Acciaio dolce |
0,25 – 0,40 |
Si salda poco facilmente, si tempra difficilmente |
Alberi, assi, viti, etc. |
|
Acciaio semiduro |
0,40 – 0,60 |
Non si salda, si tempra bene |
Perni, utensili ordinari |
|
Acciaio duro |
0,60 – 1,0 |
Si tempra bene |
Rotaie, fili, getti, utensili come lime, scalpelli, seghe |
|
Acciaio da utensili |
1,0 – 1,5 |
Energeticamente temprabile |
Utensili da taglio, pezzi destinati ad attriti |
Per ridurre la percentuale di carbonio nella ghisa si impiega il convertitore Bessemer (Figura 13).

Figura 13. Convertitore Bessemer e un suo schema
Si tratta di un grosso recipiente a forma di pera rivestito internamente di materiale refrattario e capace di ruotare intorno a un asse per le operazioni di carico della ghisa e scarico dell’acciaio. Alla base del convertitore viene insufflata nella ghisa aria calda: l’ossigeno reagisce con il carbonio residuo producendo essenzialmente CO. In pochi minuti il carbonio viene eliminato completamente e, per ottenere un acciaio con una determinata percentuale di C, si interrompe il flusso dell’aria e si aggiunge alla massa una determinata quantità di ghisa in modo che l’acciaio ottenuto abbia la voluta percentuale di carbonio. Oggi si impiegano convertitori tecnologicamente più avanzati (soprattutto di tipo Linz-Donawitz), più grossi del convertitore Bessemer, in cui viene insufflato dall’alto ossigeno, anziché aria, consentendo di ridurre drasticamente il tempo necessario per effettuare la conversione.
Non c’è dubbio che il rame occupi un posto importante tra i protagonisti del mondo materiale: da esso dipende la produzione di energia elettrica e la possibilità di avere luce nelle nostre case. Vediamo bene.
Dice Ed Conway:26 “A rendere l’elettricità la cosa migliore sulla Terra fu la capacità di incidere rapidamente su ogni aspetto della vita quotidiana” e continua “Il rame è il substrato invisibile che sostiene il mondo moderno così come lo conosciamo. Se non ci fosse resteremmo letteralmente al buio. Se l‘acciaio è lo scheletro del nostro mondo e il cemento ne è la carne, il rame è il sistema nervoso della civiltà, il sistema di cavi e collegamenti invisibili senza i quali nulla potrebbe funzionare … I generatori e i trasformatori dei nostri sistemi elettrici dovrebbero essere considerati tra le invenzioni più importanti della storia”. Più avanti aggiunge “l’elettricità, a differenza di altre fonti di energia, è silenziosa e sostanzialmente invisibile, senza il rame non potremmo né produrla, né distribuirla.”27
6.1 Caratteristiche, minerali e miniere più importanti
Il rame ha colore rossastro, lucentezza metallica e caratteristiche di duttilità, malleabilità e buona conducibilità sia termica che elettrica (è secondo solo all’argento). È dunque l’elemento più utilizzato come conduttore elettrico e trova applicazione in innumerevoli oggetti di uso comune.28 I principali minerali di rame sono quelli solforati: calcopirite (CuFeS2) e bornite (Cu5FeS4) che costituiscono circa l’80% dei depositi di rame presenti nella crosta terrestre. I minerali carbonati (azzurrite e malachite) e gli ossidi (cuprite) hanno un impiego molto limitato, perché contengono un basso contenuto di rame. Il rame può esistere anche allo stato di metallo, ma non è comune.
I Paesi maggiori produttori di rame nel 2024 sono il Cile (con 5,3 milioni di tonn/anno) e il Perù (con 2,7 milioni tonn/anno), seguono la Repubblica Democratica del Congo (2,5 milioni tonn/anno), la Cina (1,7 tonn/anno) e gli Stati Uniti (1,1 milioni tonn/anno). La più grande miniera di rame al mondo è la cilena Escondida con una produzione di un milione di tonn/anno.
La metallurgia del rame è assai lunga e complessa e, se vogliamo rame purissimo adatto al trasporto della corrente elettrica (cavi e fili elettrici), si deve fare al termine la raffinazione elettrolitica.29
Il rame meno puro di quello usato per la conduzione elettrica viene impiegato in lastre e tubi soprattutto nell’edilizia.
6.2 Riciclo
Anche per il rame si pone il problema del riciclo per garantire la continuità della sua disponibilità, tuttavia questo è inferiore al riciclo di altri metalli soprattutto perché è “bloccato” molto a lungo nei dispositivi in cui viene impiegato (il riciclo è intorno al 40%). Deve essere pertanto particolarmente regolato il suo impiego.
Scheda 3
Produzione e trasporto della corrente elettrica
Si produce corrente elettrica attraverso un alternatore generalmente sincrono. Il funzionamento di un alternatore sincrono30 è fondato sul fenomeno dell’induzione elettromagnetica in base al quale si ha che, in una spira conduttrice concatenata con un flusso magnetico variabile, si genera una forza elettromotrice indotta (f.e.m.). Un generatore o alternatore sincrono (Figura 14, sinistra) è costituito da una parte rotante o rotore detta induttore, che produce il campo magnetico per mezzo di masse magnetiche (elettromagnetiche) dette poli, eccitate da corrente continua, e da una parte fissa o statore, detta indotto, che contiene gli avvolgimenti conduttori nei quali si genera la f.e.m. indotta. Vengono prodotti anche piccoli generatori portatili per produrre corrente in posti mobili (ad esempio, per i gli ambulanti che si spostano magari giornalmente).
Gli avvolgimenti (spire) di fili di rame sono anche essenziali in un’altra apparecchiatura di grande diffusione, il trasformatore (Figura 14, destra). Si tratta di un’apparecchiatura elettrostatica che funziona in corrente alternata basata sul principio dell’induzione elettromagnetica: due avvolgimenti (spire) di filo di rame di diversa lunghezza trasformano, ad esempio, la tensione domestica (220 volt) in tensione di diverso voltaggio (ad esempio, 12 volt). Sono impiegati negli apparecchi radio e per i televisori; nei televisori a schermo piatto il trasformatore è solidale al cavo di alimentazione.
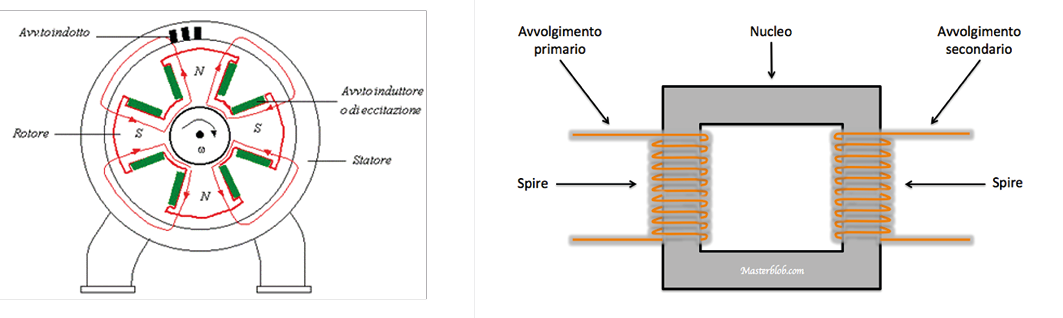
Figura 14. Schema di un alternatore (sinistra) e di un trasformatore (destra)
La corrente elettrica prodotta dalle centrali viene trasportata con grossi tralicci anche a grandi distanze e viene raccolta da una centrale di smistamento dove grossi trasformatori industriali (Figura 15) la convertono a 220 volt per connetterla ai vari utilizzatori finali (abitazioni, centri commerciali e piccole industrie).

Figura 15. I trasformatori industriali
Il trasporto di energia elettrica prodotta dal fornitore (ad esempio, Enel o Hera) avviene utilizzando la corrente alternata con frequenza di 50Hz. Questa rete è composta da linee che vengono classificate (in campo elettrotecnico) a seconda della tensione di esercizio in:
• Altissima tensione (AAT), superiore ai 150 kV
• Alta tensione (AT), compresa fra i 30 kV e i 150 kV
• Media tensione (MT), compresa fra 1 kV e 29 kV
• Bassa tensione (BT), inferiore a 1 kV (voltaggio 50-1000 Volt)
Per quanto riguarda la trasmissione di energia elettrica la natura dei cavi dipende dalle caratteristiche del voltaggio operativo. In particolare, per l’AAT e l’AT i cavi elettrici impiegati sono ormai di alluminio (cavi nudi) rinforzati al centro da un’anima di filo d’acciaio (per garantire la resistenza alla trazione); ciò è dovuto al fatto che, nonostante l’alluminio abbia una conducibilità più bassa del rame,31 quando si tratta di impiegare altissima o alta tensione (e bassa corrente), la dispersione di calore per effetto Joule è bassa e prevale la convenienza economica. Per i cavi di media tensione (cavi di distribuzione) si impiega sia l’alluminio che il rame. Solo per l’ultimo chilometro, fino al raggiungimento delle utenze finali, si impiegano cavi di rame isolati con PVC o gomma sintetica (EPR). Infine, i cavi elettrici degli impianti interni sono in fili di rame isolati.
1 E. Conway, La materia del mondo, Marsilio editori, Venezia, 2023.
2 C. D. Keeling è stato un chimico statunitense che ha impiantato l’osservatorio di Mauna Loa nelle Hawaii, dando l’avvio alla misurazione continua della concentrazione di CO2 nell’atmosfera.
3 Il vetro temperato è un vetro di sicurezza ottenuto dal vetro “normale” per trattamento termico portandolo a circa 700°C e poi raffreddandolo velocemente.
4 Alle quote di crociera di un aereo la temperatura dell’aria può arrivare a -50°C.
5 https://www.sorgedil.it/blog/?vetro-basso-emissivo-caratteristiche
7 https://aws.amazon.com/it/what-is/computer-chip/#:~:text=chip%20per%20computer?-,Cos’è%20un%20chip%20per%20computer?,che%20trasmettono%20segnali%20di%20dati.
8 G. Ferri, G. Galasso, Analisi delle caratteristiche delle fibre ottiche: https://web.tiscali.it>chemengworld
9 Il cosiddetto sale da cucina è in realtà una miscela di diversi sali, principalmente NaCl, ma ci sono anche, in piccola quantità, sali di calcio, magnesio e potassio.
10 Riferimento 2 a pag. 123 del libro di Ed Conway citato nella nota 1.
11 Il più antico metodo di produzione del processo era quello della cella a catodo di mercurio, ma è stato da tempo sostituito da quello a membrana evitando le contaminazioni da mercurio.
12 Tristemente famoso è un suo derivato micidiale, l’iprite: diclorometil solfuro S(CH2-CH2-Cl)2.
13 https://www.technoacque.com/blog/appunti-sulla-disinfezione-dellacqua-potabile/
14 https://idealsistem.it/cosa-pvc-caratteristiche-utilizzi/
15 https://chimicamo.org/chimica-generale/cloruro-di-vinile/
16 La calandratura è un processo di produzione industriale di tipo deformazione plastica che consente di produrre (calandratura della gomma e della plastica) o trasformare (calandratura della lamiera metallica) fogli di materiale o profilati metallici.
17 https://www.qualenergia.it/articoli/batterie-sodio-loro-futuro-ancora-incerto/
18 https://www.economyup.it/automotive/batterie-al-sodio-cosa-sono-e-perche-potrebbero-essere-il-futuro-dellauto-elettrica/
19 F. Olmi, La chimica nelle cose, PM edizioni, Varazze, 2017, pag. 122-125.
20 https://assocarboni.it/assocarboni/il-sole-24-ore-marzo-2015/
21 La Cina e l’India sono di gran lunga i Paesi che impiegano il carbone, soprattutto nelle centrali termoelettriche.
22 L’alimentazione continua di un altoforno consiste nell’immissione dalla bocca di strati alternati di coke e di minerale di ferro.
23 La magnetite, Fe3O4, è il minerale più ricco di ferro, seguono l’ematite, Fe2O3, e la limonite, 2Fe2O3.3H2O; meno ricchi in ferro sono la pirite, FeS2, e la siderite, FeCO3.
24 Il ferro ha p.f. di 1530°C, il rame di 1083°C e le leghe come CuSn sotto i 1000°C.
25 Tratto da F. Olmi, La chimica nelle cose, PM edizioni, Varazze, 2017, pp. 199-200.
26 Vedi pp. 234-235 del libro di Ed Conway riportato nella nota 1.
27 Oggi per la corrente di alta tensione vengono impiegati anche cavi di alluminio per la loro leggerezza e buona conduttività elettrica (anche se inferiore a quella del rame).
28 Per esempio, in un’automobile è presente in media 1 chilometro di cavi; questi portano l’elettricità a luci, finestrini, portiere, etc.
29 Le fasi della metallurgia del rame sono: frammentazione del minerale, flottazione per arricchire la percentuale del rame, concentrazione, arrostimento e fusione, conversione di CuS e Cu2S in rame metallico; si ottiene così rame per tubazioni, grondaie, laminati. Se occorre rame per conduzione elettrica si effettua l’elettrolisi.
30 Sincrono: alternatore in cui la frequenza della tensione generata è legata alla velocità della rotazione.
31 La conducibilità di alcuni metalli (espressa in Siemens/metro, S/m) è la seguente: argento, 61 × 106 S/m; rame, 58 × 106 S/m; oro, 45 × 106 S/m; alluminio, 37 × 106 S/m; ferro, 10 × 106 S/m