Le nuove frontiere della catalisi ecosostenibile: un viaggio, dai catalizzatori omogenei alla fotocatalisi, ripercorrendo le tappe storiche più rilevanti per il suo sviluppo
Marcello Crucianelli e Nicola Di Nicola
Dipartimento di Scienze Fisiche e Chimiche dell’Università dell’Aquila
e-mail: marcello.crucianelli@univaq.it
Indice
2. Breve cronistoria della catalisi e dei premi Nobel ad essa dedicati
4. Nuove tendenze nello sviluppo di moderni sistemi catalitici
5. Presente e futuro: fotocatalisi
Abstract. Catalytic processes are behind many chemical reactions, both industrial and non-industrial. Since the 1990s, with the rise of Green Chemistry concept and its 12 principles for making chemistry more sustainable and environmentally friendly, scientists around the world have been increasingly interested in understanding the central role of catalysis. Understanding how catalysts work is very important since they help chemical reactions to take place faster and more efficiently, using less energy and producing less waste. This short review covers the scientific advancements during the past 30 years which allowed the development of catalytic processes in a more eco-friendly way. All this, starting from homogeneous catalysis, moving through hybrid multifunctional catalysts, and ending with photocatalysis, by tracing a brief history of catalysis, its advancement and the most relevant Nobel Prizes specifically awarded to it.
Keywords: catalisi omogenea; catalisi eterogenea; supporti ibridi; nanoparticelle; metallo-enzimi; sistemi supramolecolari
Il termine “catalisi” (parola di origine greca che significa sciogliere, rompere) venne introdotto per la prima volta, nel 1835, da Berzelius [1].
La catalisi è un fenomeno chimico naturale che, ponendo in correlazione gli aspetti termodinamici (legati alle energie in gioco) e cinetici (legati alle velocità) di una reazione chimica, consente a quest’ultima di avvenire in modo più agevole e in tempi più rapidi. Infatti, affinché una reazione chimica avvenga è necessario che i suoi reagenti, ovvero le sostanze che si mettono a reagire, abbiano un contenuto minimo e sufficiente di energia, definita come energia di attivazione.
In natura esistono reazioni chimiche che, pur essendo termodinamicamente favorite, sono cineticamente molto lente e, quindi, in pratica, non avvengono: un esempio è la trasformazione fra i due allotropi (cioè forme diverse dello stesso elemento chimico cui corrispondono proprietà differenti) più conosciuti del carbonio da diamante (meno stabile) a grafite (più stabile). Questa trasformazione, pur essendo favorita termodinamicamente è cineticamente sfavorita in condizioni di pressione e temperatura ambiente per cui, di fatto, non avviene.
Tuttavia, in linea di principio, molte di queste reazioni potrebbero avvenire, in tempi più rapidi, in presenza di un catalizzatore.
Un catalizzatore, quindi, è una sostanza che, pur aumentando la velocità di una reazione chimica (riducendo l’energia di attivazione per le molecole dei reagenti) (Figura 1), non la modifica da un punto di vista termodinamico e, sebbene interagisca con i reagenti, viene rigenerato alla fine della reazione stessa restando, in sostanza, inalterato. In altri termini, tutto il catalizzatore presente all’inizio della reazione si ritrova, chimicamente inalterato, al termine di essa.
Possiamo definire due tipi di catalizzatori: i catalizzatori positivi, che accelerano la reazione (Figura 2) e i catalizzatori negativi, più noti come inibitori, che la rallentano.
La catalisi gioca un ruolo fondamentale praticamente in tutti i processi chimici e, in effetti, la stragrande maggioranza delle reazioni chimiche (e biologiche) avviene in presenza di catalizzatori (o enzimi). Attualmente, più del 90% dei processi chimici di interesse tecnologico o industriale, vengono eseguiti in condizioni catalitiche.
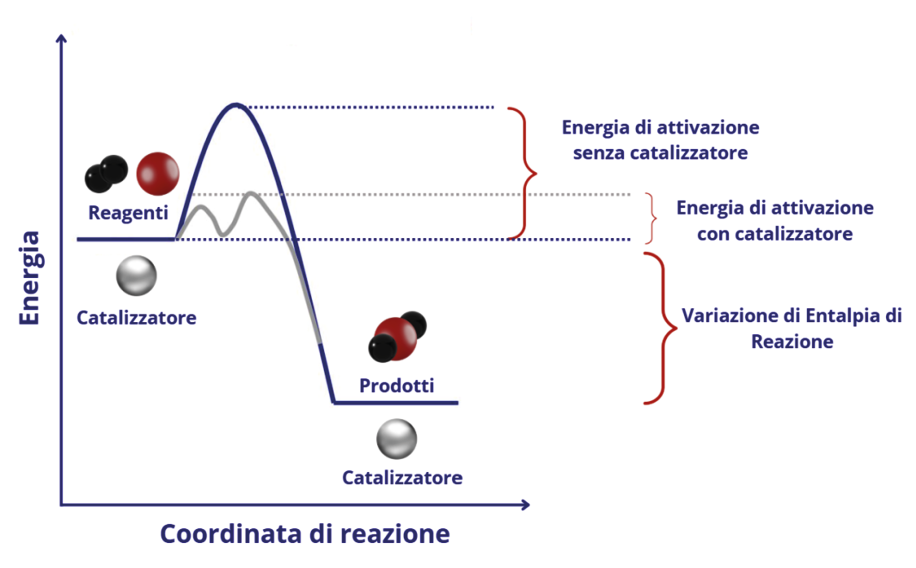
Figura 1. Riduzione della barriera di attivazione di una reazione chimica in presenza di un catalizzatore
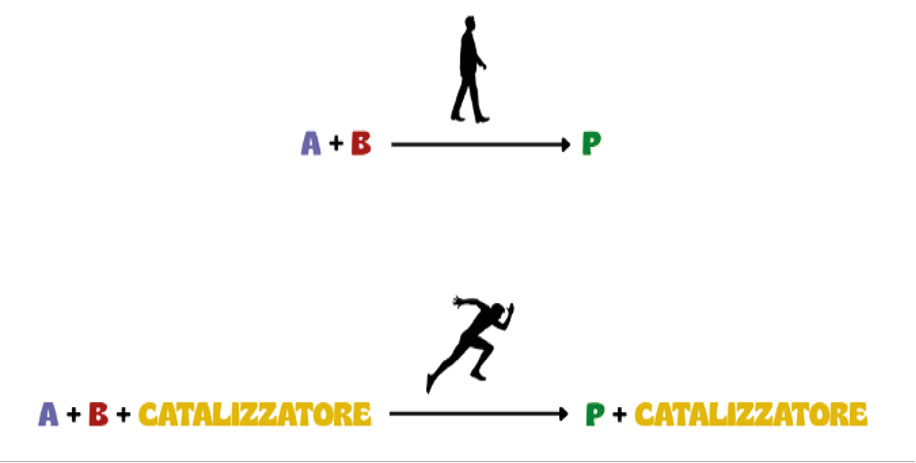
Figura 2. Confronto fra la stessa reazione in assenza e in presenza di catalizzatore
2. Breve cronistoria della catalisi e dei premi Nobel ad essa dedicati
Da quanto brevemente esposto, risulta evidente come la catalisi rappresenti uno degli aspetti chiave nella riconversione sostenibile delle vecchie tecnologie chimiche e nello sviluppo di nuove, come chiaramente indicato anche nei 12 principi alla base della Green Chemistry, vale a dire quel cambiamento di paradigma che, all’inizio degli anni ’90 del secolo scorso, decretò un cambio di marcia sostanziale nello sviluppo di nuovi processi chimici e/o tecnologici, con l’obiettivo di massimizzare l’efficienza e la sostenibilità al fine di ridurre al massimo il loro impatto nei riguardi della salute umana e dell’ambiente [2].
A tale scopo, vediamo quali sono state le tappe essenziali nello sviluppo del concetto di catalisi, in un contesto storico.
• Si ritiene che la prima applicazione catalitica sia stata la produzione di etanolo per fermentazione, la cui scoperta si perde nell’antichità; già nella Bibbia, infatti, si parla di fermenti per la produzione del pane, del latte e del vino.
• Nel medioevo e rinascimento gli alchimisti vanno alla ricerca della pietra filosofale, cioè di quel composto in grado di trasformare i metalli vili in oro. Infatti, essi credono che l’oro si formi con il passare del tempo a partire dai metalli vili; per accelerare questo processo, vanno alla ricerca della pietra filosofale, in grado di svolgere una sorta di ruolo “catalitico”.
• Nel 1552 si fa riferimento al primo impiego di un catalizzatore inorganico (acido solforico) da parte di Valerius Cordus, nel suo studio di conversione dell’alcol etilico ad etere etilico [1].
• Nel 1781, A. A. Parmentier osservò che la fecola di patate, mescolata con acqua e cremor tartaro (agente lievitante naturale a base di tartrato acido di potassio) acquisiva un sapore dolciastro dopo diverse settimane: il processo veniva accelerato in presenza di acido acetico. Tale processo fu più approfonditamente studiato da W. Döbereiner, nel 1816, quando trovò che l’amido, sciolto in acqua, veniva trasformato ad alcol etilico, previa conversione in uno zucchero. Lo stesso Döbereiner fu in grado di notare che l’azione catalitica del diossido di manganese era in grado di promuovere la decomposizione termica del perclorato di potassio, nel corrispondente cloruro, con conseguente sviluppo di ossigeno [1].
• Nel 1835, come già accennato, J. Jacob Berzelius introdusse il concetto di catalisi, valido ancora oggi: il catalizzatore è una sostanza in grado di aumentare la velocita di una reazione chimica, senza venir consumata in modo apprezzabile. Questa definizione è tratta dal suo rapporto intitolato “Årsberättelse om framstegen i fysik och kemi” (Rapporto annuale sui progressi in fisica e chimica), pubblicato dall’Accademia Reale Svedese delle Scienze, avvalendosi di molte evidenze sperimentali acquisite, nel frattempo, da diversi altri suoi colleghi e scienziati a cavallo fra XVIII e XIX secolo.
• Nel corso del XIX secolo, la ben nota disputa tra Louis Pasteur e Marcellin Berthelot, sulla natura della fermentazione, rappresenta un momento cruciale nella storia della catalisi. Mentre Pasteur sosteneva che la fermentazione fosse un processo biologico mediato da organismi viventi, Berthelot la considerava una reazione puramente chimica, catalizzata da sostanze non viventi. Questo confronto tra visione vitalista e approccio meccanicista ha stimolato ricerche fondamentali che portarono, anni dopo, alla scoperta degli enzimi come catalizzatori biologici (vedi più avanti il premio Nobel a Eduard Buchner, nel 1907). La disputa contribuì così a chiarire il concetto di catalisi, ponendo le basi per la biochimica moderna e ampliando la comprensione dei processi catalitici oltre il mondo inorganico.
• Nel 1894 Emil Fischer propose il modello “chiave-serratura” per descrivere l’azione degli enzimi, introducendo per la prima volta un’interpretazione strutturale della loro specificità. Secondo questo modello, il substrato si lega all’enzima in modo preciso, come una chiave che entra perfettamente in una serratura. Tale concetto fu fondamentale per la storia della catalisi, perché chiarì che gli enzimi non solo accelerano le reazioni, ma lo fanno in modo altamente selettivo, riconoscendo solo specifiche molecole bersaglio.
• Successivamente, nel 1925, Sir Hugh Stott Taylor introdusse il concetto di “sito catalitico”, dimostrando l’esistenza di particolari zone sulla superficie del catalizzatore attivamente implicate nel meccanismo di reazione.
Il grande sforzo di molti studiosi e ricercatori che si sono impegnati, nel corso del XX secolo, nello sviluppo di processi chimici catalitici e nello studio dei meccanismi alla loro base, è stato premiato dall’Accademia Reale Svedese delle Scienze di Stoccolma, con l’assegnazione del premio Nobel, istituito nel 1909 [3].
Anche questo prestigioso riconoscimento ha infatti voluto sottolineare la centralità della catalisi, premiando in ben tredici occasioni studiosi che hanno scoperto nuovi sistemi catalitici o disvelato complessi meccanismi alla base del loro funzionamento (studio delle interazioni tra struttura delle superfici di un solido e attività catalitica).
Vediamo ora una rapida rassegna dei premi Nobel dedicati specificamente alla catalisi e/o alla biocatalisi.
• 1907, Eduard Buchner per i suoi studi sulle fermentazioni “cell-free”, dimostrando il ruolo essenziale svolto dagli enzimi nel promuovere i processi biochimici.
• 1909, Wilhelm Ostwald in riconoscimento dei suoi studi condotti sulla catalisi, in generale, e sui principi fondamentali che governano gli equilibri chimici e le velocità di reazione.
• 1912, Paul Sabatier per gli studi sulle reazioni di idrogenazione di composti organici in presenza di metalli finemente suddivisi.
• 1918, Fritz Haber per lo sviluppo della reazione catalizzata per la sintesi dell’ammoniaca (primo esempio di processo chimico sviluppato su scala industriale).
• 1932, Irving Langmuir per le sue scoperte e ricerche nello studio della “chimica delle superfici”, da cui trarrà origine, a partire dagli anni ‘30 del 1900, la nascita della “surface science” che decreterà lo sviluppo della catalisi eterogenea.
• 1956, Cyril Hinshelwood e Nikolay Semenov per le loro ricerche volte a chiarire i meccanismi delle reazioni chimiche (es. reazioni a catena), mediante un approccio teorico e matematico.
• 1963, il nostro Giulio Natta, insieme al tedesco Karl Ziegler, per lo studio e lo sviluppo di sistemi catalitici in grado di orientare selettivamente la stereochimica delle reazioni di polimerizzazione di olefine, per l’ottenimento di polimeri a elevate prestazioni tecnologiche.
• 1973, Geoffrey Wilkinson e Ernst Otto Fischer per i loro studi pionieristici sulla chimica dei complessi organometallici, da cui prese il via lo sviluppo della catalisi omogenea.
• 2001, William S. Knowles, Ryōji Noyori e K. Barry Sharpless per lo sviluppo di sistemi catalitici chirali per le reazioni di idrogenazione (i primi due) o le ossidazioni (il terzo), in condizioni stereoselettive, di molecole organiche.
• 2005, Robert H. Grubbs, Richard R. Schrock e Yves Chauvin per i loro studi sulle reazioni di metatesi in presenza di opportuni catalizzatori; molto schematicamente, le reazioni di metatesi sono del tipo: AB + CD → AC + BD, dove i componenti B e C, nei prodotti, si sono scambiati fra loro.
• 2007, Gerhard Ertl per i suoi studi sulla chimica dei processi che avvengono sulle superfici di solidi e, in generale, per lo sviluppo della scienza delle superfici molecolari.
• 2010, Richard F. Heck, Ei-ichi Negishi e Akira Suzuki per lo studio e lo sviluppo delle reazioni di “crosss-coupling” catalizzate dal palladio, per la sintesi di molecole organiche.
• 2021, Benjamin List e David W. C. MacMillan per lo studio e lo sviluppo di opportune molecole organiche utilizzate nelle reazioni di organocatalisi asimmetrica.
Brevemente, uscendo un attimo dal contesto specifico della catalisi, al fine di chiarire alcuni termini usati spesso come chiralità, stereochimica o reazioni stereoselettive (dalla parola greca “stèreo-” che significa solido, rigido, spaziale, tridimensionale), diciamo che, in generale, le molecole hanno una loro struttura specifica, derivante da una successione di atomi legati fra loro mediante legami chimici distribuiti nelle tre dimensioni spaziali e, di conseguenza, tutte le molecole sono caratterizzate dall’avere una propria simmetria. Come conseguenza, la forma e la simmetria di ciascuna molecola possono avere un impatto significativo sul comportamento e sulle interazioni che essa può avere, a livello microscopico, con altre molecole e, a livello macroscopico, caratterizzarne le sue proprietà e le sue caratteristiche [4]. La stereochimica, quindi, è una branca della chimica che si occupa di analizzare e studiare la disposizione spaziale degli atomi all’interno di molecole o di aggregati molecolari e di come ciò possa influenzare e determinarne le loro proprietà chimiche e fisiche.
Tornando alla catalisi, chiariamo subito che i catalizzatori possono essere suddivisi in due principali categorie: omogenei ed eterogenei.
Nel primo caso, il catalizzatore si trova in una fase omogenea con i reagenti, favorendo l’incremento dell’attività catalitica e delle rese di reazione; nel secondo caso, la specie catalitica si trova in una fase diversa rispetto ai reagenti cioè, di norma, risulta essere insolubile nel solvente di reazione. In quest’ultimo caso, l’attività catalitica è generalmente minore rispetto alla catalisi omogenea ma, a volte, la selettività può risultare anche migliore e, in ogni caso, c’è il grande vantaggio che il catalizzatore può essere separato dalla miscela di reazione e recuperato per un altro ciclo catalitico.
Risulta evidente che la catalisi eterogenea, se opportunamente ottimizzata, risulta essere molto vantaggiosa anche in termini di sostenibilità del processo chimico, non solo per il recupero della specie catalitica, ma anche perché si evita che eventuali sue tracce possano inquinare i prodotti della reazione, essendo complicato il loro recupero dalla miscela di reazione.
In alternativa, si possono progettare e sviluppare sistemi catalitici che prevedano l’eterogenizzazione di catalizzatori omogenei, mediante il loro “ancoraggio” su supporti ibridi organici/inorganici, eventualmente anche provvisti di un “core” magnetico, in modo tale da consentirne un loro rapido e semplice riciclo. I supporti ideali per l’ancoraggio di sistemi catalitici devono avere specifiche proprietà come, ad es., inerzia chimica, elevata area superficiale, micro/meso porosità, eventuale presenza di gruppi funzionali, opportunamente introdotti, per ancorare la specie catalitica. Fra le principali tipologie di supporti più impiegate ci sono: silicati, silico-alluminati (zeoliti), carboni attivi, nanotubi di carbonio, polimeri organici (polistirene, polivinilpiridine, ecc.), biopolimeri (chitosano, lignina, ecc.).
I sistemi catalitici appena descritti traggono vantaggio, in termini di attività catalitica e selettività chimica, dagli effetti di confinamento legati all’introduzione del catalizzatore all’interno della matrice del supporto, in uno spazio ben definito e “confinato”, che può contribuire sinergicamente all’attività del catalizzatore come, ad esempio, aumentando la stereoselettività delle reazioni chimiche [5].
A questo punto ci si può chiedere: ma la catalisi è importante per la nostra quotidianità? Il modo migliore per rispondere è quello di focalizzare la nostra attenzione sull’azione biocatalitica del Saccharomyces Cerevisiae vale a dire, probabilmente, il lievito più importante nell’ambito dell’alimentazione umana, il cui utilizzo è noto fin dall’antichità per la panificazione e la produzione di birra e vino. Si pensa che sia stato isolato, per la prima volta, dalla superficie di acini d’uva, dove è infatti presente nella pruina, il rivestimento ceroso che è visibile sulla buccia degli acini d’uva.
Se invece, vogliamo fare riferimento a una vera e propria catalisi chimica eterogenea, l’esempio più importante è quello della marmitta catalitica (un vero e proprio piccolo reattore chimico) che ha rappresentato un successo eclatante, in termini di applicazione pratica e di diffusione su larga scala, dello studio dei meccanismi alla base del ruolo catalitico svolto da metalli di transizione depositati su matrici eterogenee (Figura 3).
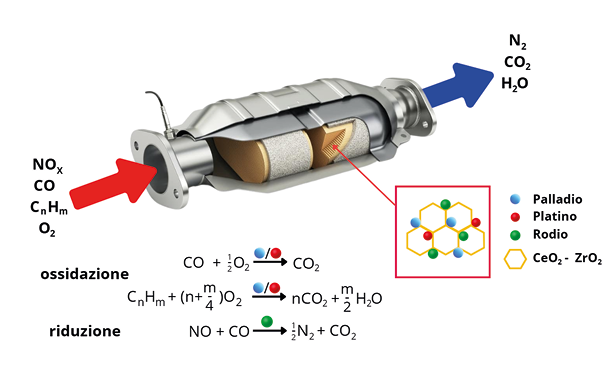
Figura 3. Schematizzazione delle principali reazioni e del funzionamento di una marmitta catalitica
Come è noto, nella marmitta catalitica (detta anche a tre vie perché in grado di agire contemporaneamente sui tre inquinanti principali CO, NO e idrocarburi incombusti, CnHm), metalli di transizione a base di platino, palladio e rodio, supportati su matrici ceramiche composite contenenti ossidi misti di cerio, zirconio e alluminio, drogati con lantanio, svolgono un ruolo determinante nel catalizzare reazioni di ossidazione o riduzione con lo scopo di rendere “innocui”, da un punto di vista di tossicità, i gas di scarico ottenuti come prodotti finali dei motori a combustione interna [6].
4. Nuove tendenze nello sviluppo di moderni sistemi catalitici
Con l’obiettivo di combinare i vantaggi sia della catalisi omogenea sia di quella eterogenea, negli ultimi venti anni, l’innovazione nel campo della catalisi si è indirizzata verso la progettazione e lo sviluppo, su scala nanometrica, di singole particelle (o piccoli aggregati) cataliticamente attive (metalli o loro ossidi) ancorate su matrici ibride organiche o inorganiche inerti, facilmente accessibili ed economiche (“single-site” or single atomic sitecatalysis SASC) [7]; tutto ciò è divenuto possibile grazie anche alla disponibilità di tecniche di analisi strumentale sempre più efficienti e performanti che consentono di “vedere” la grandezza degli agglomerati di particelle metalliche depositate sulla superficie, o all’interno di cavità delle matrici, più o meno porose, impiegate come supporti (Figura 4).
Figura 4. Schematizzazione di un sistema catalitico metallico del tipo “single-site”
Oppure, prendendo spunto dalla natura, con lo scopo di mimare il perfetto funzionamento catalitico dei biocatalizzatori o enzimi, è stata sviluppata la tecnica di progettazione e sviluppo di metallo-enzimi artificiali, avvalendosi di tecniche computazionali sempre più potenti, per la “ricostruzione” sintetica dei siti attivi delle metallo-proteine (Figura 5) [8].
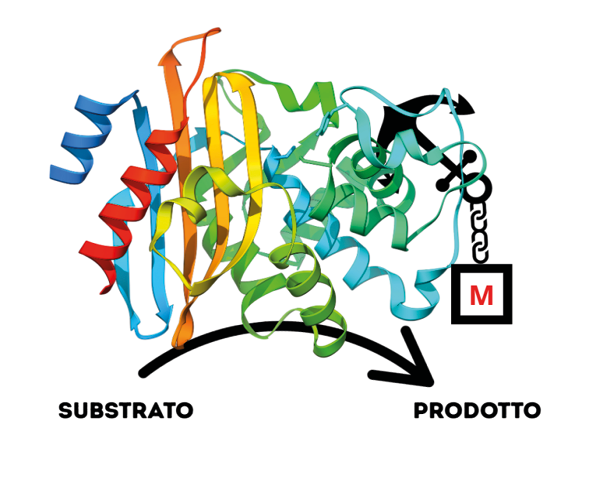
Figura 5. Schematizzazione della struttura di un metallo-enzima artificiale
In alternativa, complessi organometallici, cioè composti chimici formati da uno ione metallico coordinato a molecole organiche, più o meno complesse, in grado di stabilizzare lo ione stesso, fungendo da leganti, sono stati confinati all’interno di strutture micellari (“cat-surf” catalysis), o in aggregati chelanti complessi quali calixareni, ciclodestrine, ecc. (nanoreattori supramolecolari) per l’impiego di questi articolati sistemi catalitici, anche in solventi acquosi (Figura 6) [9].
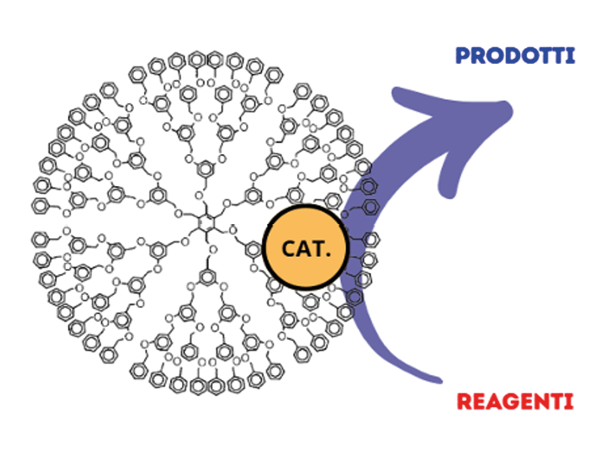
Figura 6. Schematizzazione di sistemi catalitici supramolecolari complessi
Negli ultimi periodi, si è largamente diffusa la tendenza di creare, all’interno delle matrici usate come supporti, un “core” magnetico, a base di magnetite o altri ossidi magnetici, con lo scopo di agevolare nettamente il recupero dei catalizzatori, al termine del processo chimico, dotandosi di una semplice calamita (Figure7 e 8), con grandi vantaggi in termini di tempo e resa nel recupero del catalizzatore [10].
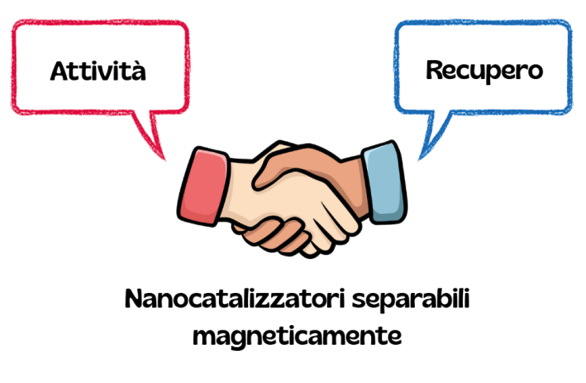
Figura 7. Catalizzatori eterogenei su core magnetici: una sinergia perfetta fra attività catalitica ed efficienza del loro riciclo

Figura 8. Recupero di catalizzatori supportati su “core” magnetici, mediante calamita
Infine, i materiali ibridi organico-inorganici con diversi livelli di funzionalizzazione e struttura porosa contenenti più tipologie di siti attivi (fra cui biocatalizzatori), possono catalizzare processi chimici multistep in un sistema reattivo “one-pot”, seguendo una cascata di eventi di reazione successivi. I diversi siti attivi possono agire in modo sinergico o sequenziale, secondo un modello di funzionalità simile a quello dei catalizzatori biologici multisito (Figura 9).
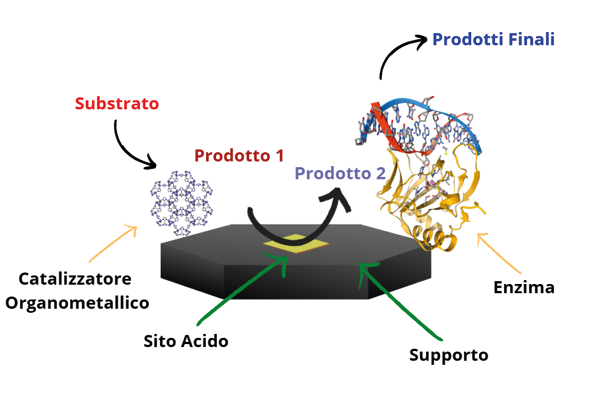
Figura 9. Schematizzazione di un sistema catalitico ibrido multifunzionale per reazioni catalitiche
sequenziali
Quest’ultima rappresenta l’evoluzione più recente all’interno del fervido settore di ricerca della catalisi in senso generale, il cui successo consentirà di ottenere risultati molto interessanti, nell’immediato futuro, in termini di attività e (stereo)selettività dei processi catalitici, soddisfacendo in pieno la sostenibilità anche in chiave di applicazioni su vasta scala [11].
5. Presente e futuro: fotocatalisi
Negli ultimi anni la fotocatalisi, un particolare processo chimico che sfrutta la luce per attivare un (foto)catalizzatore, ha assunto un ruolo centrale nella green chemistry, grazie alla sua capacità di operare in condizioni ambientali, spesso senza bisogno di solventi tossici o alte temperature. I fotocatalizzatori più comuni, come il diossido di titanio (TiO₂) e alcuni materiali a base di metalli di transizione, assorbono la radiazione luminosa e generano coppie di elettroni (e–) e lacune elettroniche (h+), che possono innescare reazioni di ossidazione e riduzione (Figura 10).
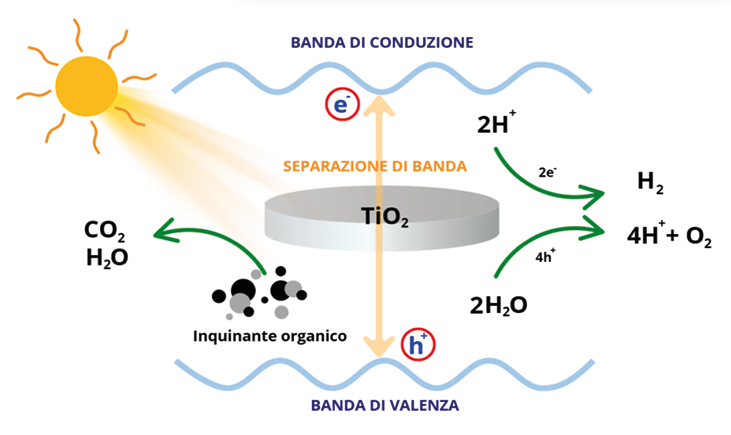
Figura 10. Rappresentazione schematica delle reazioni redox che avvengono mediante un fotocatalizzatore opportunamente eccitato
Questo meccanismo trova applicazione in numerosi campi, tra cui la degradazione di inquinanti organici, la scissione dell’acqua per la produzione di idrogeno (sempre più importante come vettore energetico) e la sintesi di composti chimici con un impatto ambientale ridotto [12]. L’impiego della fotocatalisi nella depurazione delle acque e dell’aria, nella riduzione delle emissioni di CO₂ e nella produzione di combustibili rinnovabili sta contribuendo in modo significativo alla transizione verso un’economia circolare e a basse emissioni di carbonio [13]. L’ottimizzazione di nuovi fotocatalizzatori, capaci di assorbire una porzione maggiore dello spettro solare e migliorare l’efficienza delle reazioni, rappresenta una delle sfide più promettenti per il futuro della chimica sostenibile.
È infatti ormai noto a tutti che il progresso nella scienza e nella tecnologia, nel presente e nel futuro immediato, non possa più prescindere dall’essere anche totalmente sostenibile per l’uomo e l’ambiente.
[1] J. Wisniak, The History of Catalysis. From the Beginning to Nobel Prizes: https://www.sciencedirect.com/science/article/pii/S0187893X18300740
[2] P. T. Anastas, J. C. Warner, Green Chemistry Theory and Practice, Oxford University Press, New York, 1998.
[3] https://www.nobelprize.org
[4] (a) E. L. Eliel, S. H. Wilen, Stereochemistry of Organic Compounds, Wiley, Hoboken, 2008; (b) Topics in Inorganic and Organometallic Stereochemistry, Volume 12 (Ed. G. L. Geoffroy), Wiley, Hoboken, 2007.
[5] (a) E. G. Derouane, J. Catal., 1986, 100, 541-544; (b) C. Yu, J. He, Chem. Commun., 2012, 48, 4933-4940.
[6] https://online.scuola.zanichelli.it/chimicadappertutto-files/approfondimenti/Zanichelli_Bagatti_ChimicaDappertutto_Cap10_Marmitte.pdf
[7] (a) J. D. A. Pelletier, J.-M. Basset, Acc. Chem. Res., 2016, 49, 664−67; (b) J. Liu, ACS Catal., 2017, 7, 34-59.
[8] P. J. Deuss, R. den Heeten, W. Laan, P. C. J. Kamer, Chem. Eur. J., 2011, 17, 4680-4698.
[9] C. Deraedt, D. Astruc, Coord. Chem. Rev., 2016, 324, 106-122.
[10] (a) L. M. Rossi, N. J. S. Costa, F. P. Silva, R. Wojcieszak, Green Chem., 2014, 16, 2906-2933; (b) R. Colaiezzi, A. Lazzarini, F. Ferella, V. Paolucci, A. Di Giuseppe, M. Crucianelli, Inorg. Chim. Acta, 2022, 531, 120711.
[11] U. Díaz, D. Brunel, A. Corma, Chem. Soc. Rev., 2013, 42, 4083-4097.
[12] J. Schneider, M. Matsuoka, M. Takeuchi, J. Zhang, Y. Horiuchi, M. Anpo, D. W. Bahnemann, Chemical Reviews, 2014, 114, 9919-9986.
[13] https://www.europarl.europa.eu/topics/it/article/20151201STO05603/economia-circolare-definizione-importanza-e-vantaggi