Progettazione e sperimentazione in classe di una sequenza didattica sui concetti di dipolo permanente e istantaneo
Nicolò Cimadamore1, Marco Ghirardi1 2, Alberto Regis1 e Elena Ghibaudi1
1Gruppo SENDS, Dipartimento di Chimica dell’Università di Torino;
2ITIS “Quintino Sella” di Biella
e-mail: elena.ghibaudi@unito.it
Indice
1. Il rapporto tra didattica ed epistemologia chimica
2. Un esempio di applicazione dell’analisi epistemologica alla didattica
Abstract. The intertwining of chemical epistemology and didactics may foster educational approaches capable to overcome conceptual problems in chemistry. We discuss some aspects of this relationship and present the theoretical framework adopted for designing a teaching sequence on intermolecular forces.
Keywords: epistemologia chimica; formazione chimica; forze intermolecolari; apprendimento significativo
1. Il rapporto tra didattica ed epistemologia chimica
Le riviste specializzate nella didattica chimica riportano numerosi validi esempi di esperienze didattiche volte a promuovere l’interesse degli studenti verso questa disciplina, generalmente presentata nei suoi aspetti sperimentali. Per raggiungere questo obiettivo, si ricorre spesso a strategie didattiche quali il gaming e la spettacolarizzazione della scienza, che fanno leva sugli aspetti motivazionali [1, 2].
Per quanto valida, ci pare che questa modalità di accostarsi alla chimica corra il rischio di far passare in secondo piano l’aspetto speculativo e concettuale dell’attività di indagine scientifica, intesa come attività ermeneutica applicata alla realtà materiale, che è invece un aspetto portante della scienza. Per quanto concerne la disciplina chimica ciò significa, innanzi tutto, “Spostare l’attenzione dall’apprendimento della chimica come corpo di conoscenze alla comprensione della chimica come modo di pensare” [3], ossia concepirla e insegnarla come un sistema di pensiero e non come accumulazione di conoscenze tecniche. È, dunque, necessario agire sul modo in cui la chimica viene insegnata, elaborando percorsi di formazione degli insegnanti che includano elementi essenziali di filosofia della scienza e della chimica: “Non è sufficiente formare gli insegnanti di chimica solo sui contenuti dei corsi di chimica e forse su un po’ di psicologia dell’educazione. Gli educatori chimici devono essere introdotti allo studio della natura della chimica” [4].
L’assenza di un minimo background epistemologico porta a insegnare la chimica come attività pratica di modificazione della realtà materiale, senza riuscire a mettere in evidenza il fatto che l’efficacia della pratica chimica deriva dalla peculiare struttura teorica della disciplina: “La chimica, con il suo carattere ibrido, è allo stesso tempo scienza della materia per via delle operazioni e scienza della mente per via del ragionamento simbolico” [6]. Di conseguenza, la scarsa familiarità dei docenti di chimica con questi temi ha significative conseguenze sulla comprensione, da parte degli studenti, di aspetti fondamentali dell’interpretazione chimica del reale, quali ad esempio il rapporto microscopico/macroscopico: “La familiarità degli insegnanti con temi come la modellizzazione e la loro capacità di trasformarli in pratiche pedagogiche in classe sono aspetti vitali per promuovere una comprensione efficace della chimica” [7]. Una maggiore intersezione disciplinare tra il dominio di ricerca della didattica chimica (e delle scienze) e quello della storia e della filosofia della chimica è pertanto auspicabile, allo scopo di realizzare l’obiettivo di rendere gli studenti consapevoli “di come conosciamo ciò che conosciamo nelle scienze” [8].
La disamina della letteratura in didattica chimica evidenzia che gli esempi di applicazione di un approccio epistemologicamente informato all’insegnamento della chimica sono ancora troppo pochi. Per insegnare la chimica come “modo di pensare” è necessario che cambi l’atteggiamento dei professionisti e degli insegnanti di chimica nei confronti della filosofia e della storia della chimica. Lo scarso interesse dei chimici verso gli aspetti speculativi della propria disciplina, infatti, genera un circolo vizioso che va a detrimento della disciplina stessa, non favorendo (e forse, bloccando) l’introduzione di pratiche innovative nell’insegnamento della chimica (Figura 1).
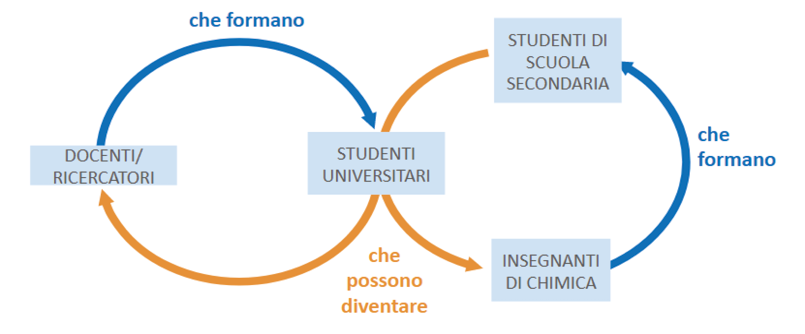
Figura 1. Il circolo della formazione disciplinare può diventare vizioso: professionisti non abbastanza consapevoli degli aspetti storico-filosofici della propria disciplina inevitabilmente formeranno studenti ignari di questi aspetti; alcuni studenti potranno diventare insegnanti di chimica, e come tali soffriranno della stessa mancanza di familiarità con la chimica come attività speculativa, formando i loro studenti di conseguenza
Consideriamo, a titolo di esempio, due problemi ampiamente discussi nell’ambito dell’educazione chimica: la struttura del curriculum di chimica e le concezioni difformi sviluppate dagli studenti (e dagli insegnanti). Questi due problemi sono correlati.
Molti studiosi osservano che il curriculum di chimica è sovraccarico e scollegato; la chimica viene spesso insegnata come un’aggregazione di fatti isolati, astorici e decontestualizzati: “I curricula sono troppo spesso aggregazioni di fatti isolati e slegati dalla loro origine scientifica” [9]. Inoltre, le connessioni tra i diversi argomenti del curriculum non sono evidenziate a sufficienza (ad esempio, la relazione tra struttura atomica e forze intermolecolari viene scarsamente percepita dagli studenti): “[Il curriculum di chimica] è troppo ampio, troppo scollegato, troppo astratto, troppo irrilevante, troppo orientato alla risoluzione di problemi algoritmici” [3].
Nello stesso tempo, le ricerche evidenziano che le concezioni difformi nascono proprio dall’assenza di un quadro concettuale coerente, che aiuti gli studenti a costruire significati e a cogliere nessi tra nozioni chimiche distinte e/o descrizioni modellistiche [10].
Alla luce di queste considerazioni, appare contraddittorio che le soluzioni proposte dalla ricerca educativa siano troppo spesso puramente metodologiche: si suggerisce di lavorare in piccoli gruppi, utilizzare strategie come la flipped classroom, privilegiare l’attività pratica, far ricorso ad applicazioni informatiche a scopo educativo, ecc. Tutti suggerimenti importanti che, tuttavia, rischiano di essere insufficienti se non sono accompagnati dalla consapevolezza delle difficoltà intrinseche alla elaborazione di ciascun specifico concetto chimico. È proprio su questo terreno che la ricerca epistemologica dovrebbe incontrare la ricerca educativa, in quanto i suoi risultati possono informare l’insegnamento della chimica e aiutare a progettare unità didattiche coerenti con la struttura logica della chimica.
I curricula di chimica dovrebbero riflettere il carattere logico e relazionale della chimica, così da guidare gli studenti a comprendere la chimica all’interno di un quadro concettuale coerente: “Questi programmi di studio vengono insegnati senza che gli studenti sappiano come devono formare connessioni all’interno e tra le aggregazioni di fatti isolati. L’acquisizione di un gran numero di fatti isolati non si presta alla formazione di schemi mentali. Gli studenti non possono acquisire il senso di come dare un significato a ciò che stanno imparando” [11].
L’epistemologia può aiutare a rispondere a domande come: quali difficoltà sono implicite nell’elaborazione di un dato concetto chimico (cioè non dipendono da un insufficiente livello di conoscenza o comprensione da parte degli studenti)? Quali sono le premesse teoriche necessarie per comprenderlo?
2. Un esempio di applicazione dell’analisi epistemologica alla didattica
Le forze intermolecolari sono un argomento essenziale per interpretare vari fenomeni di interesse chimico, ma la ricerca didattica attesta che esso risulta di difficile comprensione per gli studenti [12]. La letteratura è ricca di esempi di concezioni difformi riguardanti le forze intermolecolari, ma secondo Schmidt: “Sono state condotte poche ricerche per indagare la comprensione delle forze intermolecolari da parte degli studenti” [13]. Infine, questo argomento si presta particolarmente bene a far comprendere il ruolo della modellizzazione microscopica come strumento per interpretare fenomeni macroscopici.
Tradizionalmente, nei testi e negli insegnamenti di chimica, le forze intermolecolari vengono affrontate come segue: dapprima si introduce il concetto di dipolo permanente, poi si affronta il legame idrogeno e infine le forze di dispersione di London, che vengono solitamente discusse per ultime. Il nesso tra questo argomento e i modelli di struttura atomica non viene sufficientemente sottolineato nella discussione del meccanismo generativo di queste interazioni; inoltre, in molti casi, tende a prevalere un approccio puramente fenomenologico, che mette in relazione l’entità delle interazioni di London con la taglia molecolare, senza ulteriori approfondimenti. Anche l’utilizzo dell’iconografia merita un commento: si fa ampio uso di rappresentazioni che vedono coinvolte coppie di molecole, con il risultato che il carattere sistemico del fenomeno viene oscurato e si perde di vista il fatto che, senza interazioni intermolecolari, non avremmo sostanze, tangibili, ponderabili e manipolabili. Di fatto, quest’ultimo aspetto è dato per scontato e in molti casi il compito di realizzare la transizione da interazione tra due molecole a interazione multi-particellare, per giungere infine al livello macroscopico viene lasciato agli studenti.
Baldock segnala che [14]: “Per prevedere le proprietà fisiche dei materiali in base alla loro struttura, gli studenti devono applicare conoscenze contestualizzate provenienti da tutti e tre i domini della chimica: rappresentazione simbolica, osservazioni macroscopiche e costrutti teorici submicroscopici. Per gli studenti è difficile comprendere le sottili relazioni tra struttura molecolare, forze intermolecolari e proprietà fisiche risultanti. A causa di queste sfide, molti studenti imparano a identificare le forze intermolecolari presenti in un campione attraverso la pura memorizzazione, mantenendo intatte le loro concezioni difformi, come ad esempio l’idea che le forze intermolecolari sono forze attrattive all’interno di una molecola”.
Per questa ragione è importante impegnare gli studenti in forme di apprendimento attive, che colleghino livello macroscopico e microscopico e che facciano uso di rappresentazioni di tipo diversificato [14].
La proposta didattica che qui presentiamo nei suoi tratti essenziali è stata realizzata nell’ambito di un progetto di tesi magistrale1 di un corso di laurea in chimica ed è stata sperimentata in tre classi del secondo biennio dell’ITIS “Quintino Sella” di Biella, indirizzo “chimica, materiali e biotecnologie”, opzione “chimica e materiali”.
Essa ha comportato le seguenti fasi di realizzazione:
- disamina della letteratura per identificare le concezioni difformi sulle forze intermolecolari
- analisi epistemologica volta a identificare i nodi concettuali dell’argomento prescelto
- progettazione della sequenza didattica
- sperimentazione della sequenza in classe, su un totale di 42 studenti
- analisi dei risultati.
L’analisi epistemologica del concetto di forza intermolecolare ha consentito di ‘decostruire’ tale concetto e mettere a fuoco la sua relazione con altri argomenti del corso di chimica, in primo luogo quello della struttura atomica. Abbiamo lavorato con l’obiettivo di progettare un’attività nella quale gli studenti fossero guidati a utilizzare i modelli come strumenti di ragionamento per interpretare alcuni set di dati sperimentali, mobilitando il sapere chimico già in loro possesso e argomentando in modo coerente: “Un modo per aiutare gli studenti ad apprendere argomenti impegnativi del corso è quello di coinvolgerli in esercizi di apprendimento attivo che incorporino rappresentazioni multiple, come le osservazioni macroscopiche abbinate a spiegazioni di livello submicroscopico” [14].
Abbiamo inoltre posto attenzione a correlare il tema delle forze intermolecolari con altri temi del corso, evidenziandone il potenziale esplicativo: “L’esposizione chiara e la ripetizione di idee importanti non sono sufficienti a produrre una comprensione robusta e funzionale. Infatti, in molti corsi di chimica generale l’argomento delle forze intermolecolari è spesso separato sia dalle conoscenze preliminari necessarie per comprenderlo (ad esempio, la struttura molecolare, la forma e la polarità) sia dai soggetti per comprendere i quali sono necessarie tali forze (ad esempio, la solubilità e i cambiamenti di fase)” [12].
Infine, abbiamo adottato un approccio didattico non trasmissivo, di ispirazione socio-costruttivista, che mira alla comprensione e alla costruzione di argomentazioni efficaci e coerenti, esaltando il ruolo attivo dello studente nel processo di apprendimento e di elaborazione delle informazioni per trasformarle in conoscenze e competenze. Abbiamo dunque aderito alla prospettiva di Gilbert, secondo il quale gli insegnanti e gli studenti partecipano a una “comunità di pratica, con interazioni fruttuose su base regolare” [11].
Gli strumenti dei quali ci siamo serviti sono: fogli di lavoro individuali, con la proposizione di situazioni-problema mirate a stimolare l’elaborazione di soluzioni e di strategie risolutive da parte degli studenti, che dovevano fornire risposte in forma scritta; formulazione di ipotesi interpretative da parte degli studenti; discussioni collettive in classe, moderate dal docente, mirate a confrontare le soluzioni proposte dagli studenti e a elaborare soluzioni condivise, coerenti con il sapere pregresso degli allievi; diapositive di ricapitolazione dei concetti appena appresi e delle proprietà dei modelli elaborati, per formalizzare e consolidare il sapere costruito.
I risultati della sperimentazione in ogni sua singola fase sono poi stati analizzati, per valutare punti di forza e debolezza ed efficacia dell’intervento didattico.
La prima fase di elaborazione della sequenza didattica ha avuto come scopo l’individuazione degli ostacoli concettuali relativi al tema delle forze intermolecolari, come riportato in letteratura. Sono così emerse:
• la concezione delle forze intermolecolari come forze attrattive all’interno di una molecola;
• la difficoltà di comprendere i concetti di dipolo permanente e istantaneo a livello atomico-molecolare e sub-atomico;
• l’insufficiente connessione di questi concetti con i modelli atomici conosciuti [15];
• l’identificazione di sistemi dipolari con specie cariche [10, 16];
• l’errata interpretazione dei simboli δ+/δ- e la sottovalutazione delle implicazioni causali della mobilità degli elettroni all’interno degli atomi [13, 15]; a questo proposito Nelsen segnala che “gli studenti fraintendono le interazioni dipolari e i simboli δ+/δ- […] Alla domanda ‘da dove provengono queste cariche’, gli studenti hanno fornito la spiegazione che esse provengono dalla tavola periodica, oppure hanno detto di sapere che queste cariche erano associate a ogni atomo” [17];
• la mancanza di una visione sistemica di queste interazioni [18];
• la confusione tra i concetti di polarizzabilità ed elettronegatività [19];
• la visione statica e fortemente dualista dei legami primari e secondari, che sono concepiti come fenomeni del tutto scorrelati fra loro, e delle interazioni tra dipoli istantanei e tra dipoli permanenti, che sono concepite in alternativa le une alle altre.
A partire da queste premesse, abbiamo costruito un percorso il cui punto di partenza è il problema di interpretare l’andamento dei punti di ebollizione di alcune serie omologhe di sostanze (dapprima i gas monoatomici, poi alcune sostanze biatomiche omopolari, quali H2, Cl2; infine, specie biatomiche polari come HCl e HF). L’aumento di complessità dei sistemi trattati nel corso della sequenza è il risultato della scelta (inusuale) di dare priorità al trattamento delle forze di London, lasciando per ultimo il concetto dipolo permanente: trattando dapprima le sostanze monoatomiche, si evitano le complicazioni concettuali derivanti dalla compresenza di legami primari e secondari nella stessa specie chimica. Ciò consente di costruire agevolmente i concetti di dipolo istantaneo, induzione di polarizzazione e polarizzabilità e pone le basi per esaltare il carattere ubiquitario delle interazioni di London (molti studenti ritengono che queste forze siano tipiche solo dei sistemi non polari), e per chiarire i fattori che ne determinano l’entità. In un momento successivo, questi stessi concetti vengono riferiti a sostanze biatomiche omopolari: ciò consente di consolidare quanto appreso in precedenza. Solo in un terzo momento vengono introdotte sostanze polari, che mettono in crisi il modello interpretativo costruito fino a quel punto. Gli studenti vengono dunque aiutati a mettere a fuoco le nuove esigenze interpretative e a comprendere la necessità di espandere il modello, per includere le interazioni dipolari (forze di Keesom e Debye).
Nel disegnare questa sequenza abbiamo tenuto presente le raccomandazioni provenienti dalla ricerca didattica e, in particolare, il ruolo fondamentale della verbalizzazione scritta e orale per monitorare le modalità di ragionamento degli studenti. Abbiamo poi fatto ampio uso di rappresentazioni sia statiche che dinamiche, sia uniparticellari che multiparticellari, disegnate ad hoc e discusse con gli studenti.
2.2 Progettazione della sequenza didattica
Schematizziamo brevemente le scelte operate in fase di progettazione della sequenza didattica.
− Partire da un problema posto a livello macroscopico ed elaborare un’interpretazione di evidenze sperimentali (punti di ebollizione): “I punti di ebollizione sono buoni indicatori dell’entità delle forze intermolecolari” [20].
− Monitorare l’evoluzione delle concezioni degli studenti e i loro ragionamenti, mediante verbalizzazione, discussione e realizzazione di rappresentazioni del livello microscopico: “Se agli studenti non viene mai chiesto di scrivere e disegnare, di riflettere, di spiegare e di rivedere le loro idee, ma vengono invece valutati solo in base alla voce che scelgono in un test o in compiti generati a caso, è improbabile che sviluppino una comprensione robusta e coerente dei concetti fondamentali” [21]. L’importanza del disegno è sottolineata da Cooper et al., che hanno lavorato estesamente sul tema delle forze intermolecolari e suggeriscono che sia la scrittura sia il disegno possono fornirci indicazioni su come gli studenti comprendono questo concetto: “Il disegno dovrebbe essere particolarmente utile per identificare le idee degli studenti sulle informazioni spaziali” [12].
− Tenere conto del ruolo (ambiguo) delle rappresentazioni disponibili sui libri di testo, che possono assistere la comprensione, ma anche fuorviarla [21]. È evidente che la dimensione visiva gioca un ruolo fondamentale nell’apprendimento. È tuttavia importante vigilare sulla qualità delle immagini riportate nei testi e sui codici comunicativi utilizzati nella loro realizzazione. È necessario che tali codici siano esplicitati e condivisi con gli studenti per assicurare la corretta decodifica delle immagini.
− Ricorrere sistematicamente ad attività di modellizzazione per spiegare e prevedere le proprietà dei sistemi presi in esame: è importante che gli allievi comprendano il ruolo esplicativo e predittivo dei modelli e realizzino il carattere non definitivo di questi ultimi: “Un’altra abilità più pratica [...] consiste nell’utilizzare le rappresentazioni e le loro caratteristiche per sostenere affermazioni e fare previsioni su fenomeni chimici percepibili” [17]. Un punto particolarmente delicato della sequenza è il passaggio dalla disamina delle proprietà di sostanze non polari a quella di sostanze polari, in quanto comporta la messa in discussione del modello interpretativo elaborato fino a quel momento (dipolo istantaneo e meccanismo sottostante), che non risulta più sufficiente e richiede l’introduzione di nuovi concetti, quali ad es. l’elettronegatività.
− Utilizzare tecnologie informatiche per combinare rappresentazioni statiche e dinamiche dei sistemi in esame e per acquisire una visione dinamica delle forze intermolecolari. Le immagini disponibili sui testi sono forzatamente statiche, anche quando vogliono rappresentare situazioni dinamiche. Tali rappresentazioni non rendono l’idea che la mobilità elettronica determina un continuo sbilanciamento della distribuzione di carica nel tempo, entro lo spazio atomico o molecolare. Il dipolo istantaneo nasce da lì. L’utilizzo di rappresentazioni dinamiche consente di superare questa difficoltà, facilitando la comprensione del nesso tra mobilità elettronica e insorgenza di dipoli istantanei. Il gioco tra immagini dinamiche (film) e fotogrammi statici (presentati come fermo-immagine del film) aiuta a rendersi conto che la distribuzione di carica entro un atomo o una molecola varia continuamente nel tempo.
− Attenersi a una descrizione semiclassica del mondo atomico-molecolare, facendo ricorso al solo modello di Bohr.
− Porre in stretta connessione il tema delle forze intermolecolari e quello dei modelli atomici, al fine di discutere le implicazioni della mobilità degli elettroni nell’insorgenza delle forze intermolecolari e, in particolare, nella generazione di dipoli istantanei. Similmente, il concetto di polarizzabilità viene costruito ponendolo in correlazione con il numero di elettroni della specie trattata, in accordo con quanto suggerito da Glazier et al.: “Il numero di elettroni permette di discutere il ruolo degli elettroni nelle forze di London” [20].
− Affrontare la concezione difforme relativa all’entità relativa delle forze di London e Keesom-Debye. Molti studenti sono convinti che le forze di dispersione di London siano sempre le più deboli, in termini assoluti, indipendentemente dalle caratteristiche dei sistemi molecolari messi a confronto.
− Enfatizzare la dimensione sistemica delle forze intermolecolari, con particolare riguardo al concetto di induzione di polarizzazione e polarizzabilità: pertanto è stato fatto ampio uso di rappresentazioni multiparticellari ed è stato chiesto agli studenti di realizzarne a loro volta. Purtroppo, i libri di testo tendono a presentare le forze intermolecolari come interazioni tra coppie di particelle, lasciando agli studenti il compito di connettere il comportamento macroscopico con le interpretazioni microscopiche a livello atomico-molecolare e sub-atomico: la prospettiva sistemica diventa così uno strumento per connettere i livelli macroscopico e microscopico (Figura 2).
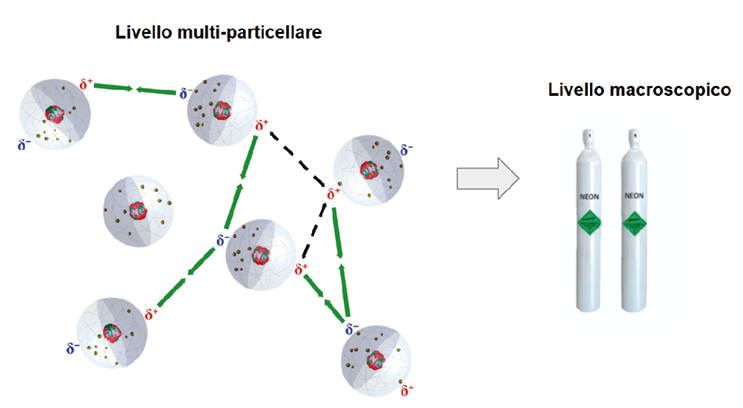
Figura 2. Transizione dalla prospettiva multi-particellare al livello macroscopico
L’efficacia dell’intervento didattico è stata monitorata mediante un questionario somministrato prima e dopo lo svolgimento della sequenza didattica. Il test prevedeva 7 domande su temi correlati a quelli affrontati nella sequenza, ma applicati a sistemi e situazioni diverse da quelle discusse in classe. Lo scopo era testare non solo le conoscenze, ma anche le competenze maturate dagli studenti. I risultati sono stati molto incoraggianti, come dimostra l’aumento considerevole di risposte corrette dopo la sperimentazione in classe (Figura 3).
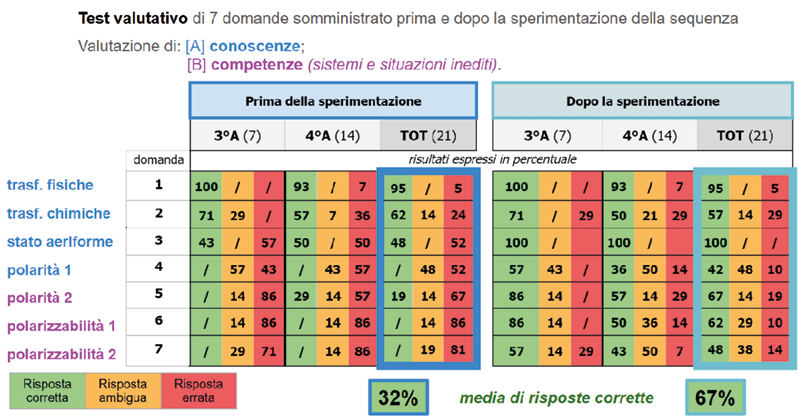
Figura 3. Risultati del test somministrato prima e dopo la sperimentazione in classe
La maggior parte degli studenti è stata in grado di fare correlazioni struttura-proprietà per quanto riguarda l’andamento dei punti di ebollizione e la polarità delle sostanze; inoltre, moltissimi studenti sono stati in grado di applicare i concetti di polarità e polarizzabilità all’interpretazione di prove sperimentali relative a sostanze sconosciute e di argomentare in modo coerente. Inoltre, abbiamo riscontrato un incremento delle capacità argomentative degli studenti. La sequenza verrà ora perfezionata, alla luce dei punti di forza e di debolezza evidenziati dall’analisi dei dati.
[1] E. Byusa, E. Kampire, A. R. Mwesigye, Game-based learning approach on students’ motivation and understanding of chemistry concepts: A systematic review of literature, Heliyon, 2022, 27, e09541, doi: 10.1016/j.heliyon.2022.e09541.
[2] H. W. Roesky, Spectacular Chemical Experiments, Wiley-VCH, Weinheim, 2007.
[3] V. Talanquer, J. Pollard, Let’s teach how we think instead of what we know, Chem. Educ. Res. Pract., 2010, 11, 74-83.
[4] E. Scerri, The new philosophy of chemistry and its relevance to chemical education, Chem. Educ. Res. Pract., 2001, 2, 165-170.
[5] S. Erduran, Philosophy, chemistry and education: an introduction, Science & Education, 2013, 22, 1559-1562
[6] E. Kaya, S. Erduran, Integrating epistemological perspectives on chemistry in chemical education: The cases of concept duality, chemical language, and structural explanations, Science & Education, 2013, 22, 1741-1755.
[7] S. Erduran, A. Aduriz-Bravo, R. Mamlok-Naaman, Developing epistemologically empowered teachers: Examining the role of philosophy of chemistry in teacher education, Science & Education, 2007, 16, 975-989.
[8] S. Erduran, Philosophy of chemistry: An emerging field with implications for chemistry education, Proceedings of the 5th History, Philosophy and Science Teaching Conference, Pavia (Italy), 1999.
[9] W. De Vos, A. Bulte, A. Pilot, Chemistry curricula for general education: Analysis and elements of a Design, in Chemical Education: Towards Research-based Practice (Eds. J. K. Gilbert, O. De Jong, R. Justi, D. F. Treagust, J. H. Van Driel), vol. 17, Springer, Dordrecht, 2002, pp. 101-124.
[10] R. K. Coll, N. Taylor, Alternative conceptions of chemical bonding held by upper secondary and tertiary students, Res. Sci. & Technol. Educ., 2001, 19, 171-191.
[11] J.K. Gilbert, On the nature of context in chemical education, Int. J. Sci. Educ., 2006, 28, 957-976.
[12] M. M. Cooper, L. C. Williams, S. M. Underwood, Student understanding of intermolecular forces: A multimodal study, J. Chem. Educ., 2015, 92, 1288-1298.
[13] H. J. Schmidt, B. Kaufmann, D. F. Treagust, Students’ understanding of boiling points and intermolecular forces, Chem. Educ. Res. Pract., 2009, 10, 265-272.
[14] B. L. Baldock, J. D. Blanchard, A. L. Fernandez, Student discovery of the relationship between molecular structure, solubility, and intermolecular forces, J. Chem. Educ., 2021, 98, 4046-405.
[15] M. Niaz, Chemistry Education and Contributions from History and Philosophy of Science, Springer, Berlin, 2016.
[16] G. Tsaparlis, E. T. Pappa, B. Byers, Teaching and learning chemical bonding: research-based evidence for misconceptions and conceptual difficulties experienced by students in upper secondary schools and the effect of an enriched text, Chem. Educ. Res. Pract., 2018, 19, 1253-1269.
[17] I. Nelsen, A. Farheen, S. E. Lewis, How ordering concrete and abstract representations in intermolecular force chemistry tasks influences students’ thought processes on the location of dipole-dipole interactions, Chem. Educ. Res. Pract., 2024, 25, 815-832.
[18] K. Taber, Chemical misconceptions: Prevention, diagnosis and cure, Royal Society Chemistry, London, 2005.
[19] H. R. Widarti. S. Marfuaf, R. Retnosari, Identifying students’ misconception about intermolecular forces topic in organic chemistry I course, Unnes Sci. Educ. J., 2019, 8, 46-56.
[20] S. Glazier, N. Marano, L. Eisen, A closer look at trends in boiling points of hydrides: Using an inquiry-based approach to teach intermolecular forces of attraction, J. Chem. Educ., 2010, 87, 1336-1341.
[21] W. Quiroz, C. Rubilar, Natural laws and ontological reflections: The textual and didactic implications of the presentation of Boyle’s law in general chemistry, Chem. Educ. Res. Pract., 2015, 16, 447-459.
1 Il presente articolo riassume alcuni aspetti del lavoro di tesi del primo autore di questo manoscritto.