Macromolecole: il livello mancante tra le molecole e le cellule?
Giovanni Villani
Istituto di Chimica dei Composti Organometallici del CNR (sede di Pisa)
Orcid: 0000-0001-8030-0799
e-mail: villani@pi.iccom.cnr.it
Indice
2. Struttura e forma delle molecole
3. Il piano di complessità delle macromolecole
Spesso in ambito filosofico/culturale si è parlato di “anello mancante” in un’ipotetica catena, quasi a voler colmare i salti (i singoli anelli) di una catena ideale continua. Per esempio, per gli esseri viventi ogni anello della catena dovrebbe riconciliarsi con la “grande catena degli esseri”. Un buon esempio è quello dell’evoluzione delle specie di Darwin.
Nella seconda metà del XIX secolo, una comune interpretazione errata del lavoro di Charles Darwin era che gli umani discendessero in linea retta da specie esistenti di scimmie antropomorfe. Per accettare questa teoria e conciliarla con la Grande Catena gerarchica dell’Essere, sembrava necessario un fossile di scimmia-uomo o uomo-scimmia per completare la catena. Oggi è riconosciuto che la relazione degli umani moderni con le attuali scimmie antropomorfe (ad esempio, gli scimpanzé) avviene attraverso antenati comuni piuttosto che attraverso una discendenza diretta.1
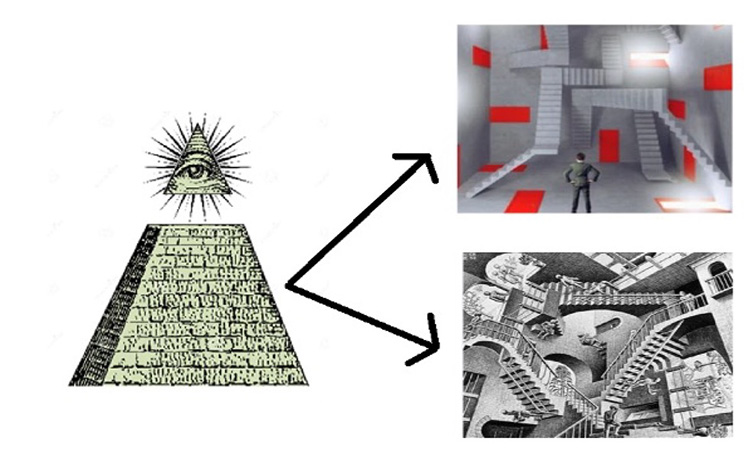
Figura 1. Strutturazione del mondo: semplice a piramide (sinistra) e complessa, statica
Io non credo che quest’ottica lineare, sia essa a catena o a piramide, funzioni bene, in generale. Oggi quest’idea è superata e io credo che alla visione concatenata o a piramidale con l’occhio di Dio alla sommità (parte sinistra della figura 1) vada sostituita un’idea complessa, tipo quelle della parte destra della figura 1, con aspetti statici e dinamici.
L’approccio lineare è stato applicato anche all’elenco dei piani di complessità. Quando si elencano, infatti, i piani di complessità che dal microscopico portano al macroscopico si è soliti procedere con un approccio di strutturazione del mondo materiale non casualmente chiamato torta a strati (layer-cake). Tale approccio, con molte varianti, è di vecchia data e ha, quindi, numerosi esempi storici; per esemplificarlo e per semplicità mi rifaccio alla sua versione moderna, quella di Oppenheim e Putnam [1]. Poiché la strutturazione del mondo non può essere vista in questo modo lineare, proviamo a ragionare sulla teoria (e il conseguente modello) “di torta a strati”.
La teoria della torta a strati di Oppenheim e Putnam ha tre componenti [2, 3]. In primo luogo, pretende di essere una teoria onnicomprensiva, cioè ritiene di essere in grado di rendere conto di tutti i casi in cui si possa parlare di “livelli di complessità”. In secondo luogo, i livelli sono correlati da relazioni compositive, strutturate in modo graduale, passo dopo passo. In pratica, tutti gli enti di un livello sono correlati a quelli del livello inferiore adiacente essendo enti formati dall’insieme di parti nel piano inferiore e, a loro volta, come costituenti per gli enti che si trovano al livello superiore adiacente. Probabilmente è questo aspetto che ha dato alla teoria il nome di “torta a strati”. Infine, Oppenheim e Putnam assumono una stretta relazione tra gli enti che compongono un livello e i predicati e le teorie scientifiche legate ad essi. Questo significa che i livelli della scienza si associano ordinatamente ai livelli della natura, in modo che per ogni livello in natura vi sia una disciplina scientifica o una teoria corrispondente e viceversa. Tali autori propongono sei “livelli fondamentali”: particelle elementari, atomi, molecole, cellule, esseri viventi pluricellulari e gruppi sociali. Ad esempio, il livello molecolare presuppone una disciplina scientifica che è stata chiamata Chimica.
Questo modello di strutturazione potrebbe essere usato sia in un’ottica riduzionista sia in una antiriduzionista. La prima ottica fu quella originaria usata da Oppenheim e Putnam, come dimostra il titolo del loro lavoro Unity of Science as a Working Hypothesis (L’unità della scienza come ipotesi di lavoro) [1]. Nel secondo caso, invece, sarebbe sufficiente insistere sull’aspetto “fondamentale” dei sei livelli e, quindi, sulla loro irriducibilità e questo modello diverrebbe molto simile a quello della Sistemica.
Numerose sono le possibili critiche a questo modello di strutturazione del mondo. La più importante è quella dell’identificazione dei livelli fondamentali che, secondo Oppenheim e Putnam, come prima detto sono sei. Io ritengo che siano di più: almeno il livello macromolecolare andrebbe inserito. Lo scopo del presente contributo è proprio quello di esplicitare quest’ultimo punto. Per farlo dobbiamo “lavorare” sui concetti di struttura e di forma molecolare.
2. Struttura e forma delle molecole
I concetti di “struttura” e di “forma” molecolare sono utilizzati in tutti gli ambiti della Chimica e spesso sono considerati come sinonimi. Tali non sono e questo può generare confusione in Chimica e, ancora di più, nella filosofia della scienza.
Anche se la confusione scientifica può essere “attutita” nel caso degli “esperti” (non è, comunque, irrilevante neppure in questo ambito), nell’insegnamento della Chimica dove sono presenti dei “principianti” (gli studenti) è più grave. Questa confusione è presente anche nei testi di Chimica, compresi quelli specialistici, in cui si sostiene che tali concetti siano sinonimi e descrivano la stessa cosa.
La confusione dei due concetti del mondo molecolare ha implicazioni generali/filosofiche anche fuori della stessa scienza. Questa confusione ci porta a ritenere una macromolecola come “una molecola gigante” e a non avere, quindi, la necessità di un ulteriore piano di complessità tra le molecole e la cellula.
Qui riepilogheremo la differenza tra i concetti di struttura e forma di una molecola già sviluppata altrove [4, 5] e, siccome la differenza tra i due concetti aumenta all’aumentare del numero di atomi nella molecola, su tale differenziazione inseriremo la necessità di un piano di complessità specifico per le macromolecole. Riallacciarsi alla differenza concettuale tra la struttura e la forma molecole soprattutto nelle macromolecole e ricavarne le conseguenze generali è lo scopo principale di questo contributo.
La definizione di struttura molecolare è quella di una “disposizione relativa degli atomi costituenti in una molecola” come possiamo vedere nella seguente citazione [6]:
Quelle scienze che si occupano degli aspetti molecolari delle proprietà della materia, principalmente la chimica, ma anche la fisica molecolare e la biochimica, si fondano sulla convinzione che tutti gli esperimenti che coinvolgono le molecole possano essere compresi in termini di disposizioni relative degli atomi costituenti nelle molecole. Questa idea di struttura molecolare (o “forma molecolare”) è stata fondamentale per lo sviluppo della nostra comprensione delle proprietà chimico-fisiche della materia ed è ora così familiare e profondamente radicata nel nostro pensiero che di solito è data per scontata: è il dogma centrale della scienza molecolare. (Corsivo nel testo; grassetto aggiunto dallo scrivente).2
Noi non siamo d’accordo con questa definizione. Ovviamente la disposizione degli atomi che costituiscono la molecola è un aspetto essenziale del concetto di molecola e della sua struttura, ma per arrivare al concetto di molecola e di relativa struttura, partendo dalla disposizione spaziale degli atomi, occorrono ulteriori passaggi logici da chiarire.
Per prima cosa va notato che solo un sistema stabile può costituire una molecola con la sua struttura molecolare. Un generico aggregato di atomi può fregiarsi del termine “molecola” solo se esso è un minimo della n-dimensionale superficie di energia potenziale globale del sistema. Non entreremo nel dettaglio tecnico di questo aspetto (per gli approfondimenti vedere [5]) e qui ci fermeremo allo spot: non ogni aggregato di atomi può essere una molecola!
Il concetto di struttura molecolare, inoltre, ci dà informazioni sull’organizzazione interna di una molecola. In particolare, tale concetto si rapporta a quello di legame chimico intramolecolare. Dobbiamo precisare che noi chimici distinguiamo all’interno di una molecola le coppie di atomi legate da quelle non legate e la formula di struttura mette in evidenza proprio questa differenza. Nella molecola di H2O, la sua struttura molecolare prevede che l’atomo di ossigeno sia legato ai due atomi d’idrogeno e che, reciprocamente, ogni atomo d’idrogeno sia legato all’atomo d’ossigeno, ma non prevede che vi sia un legame tra i due atomi d’idrogeno. Questo significa che la struttura molecolare di Figura 2(a) è corretta, mentre l’ipotetica struttura (b) della stessa figura non è corretta. Notiamo che nelle strutture (a) e (b) la disposizione degli atomi costituenti la molecola è esattamente la stessa e, quindi, seguendo la definizione di Wolley, ambedue rappresenterebbero la stessa struttura di H2O.
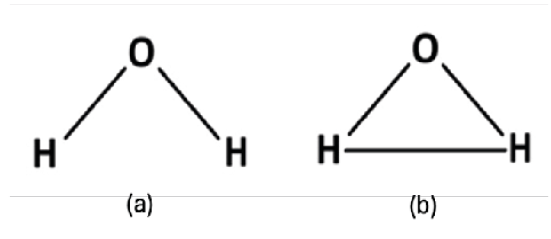
Figura 2. Due possibili strutture con uguali disposizioni degli atomi del sistema H2O; solo la struttura (a) è corretta, ma dalla definizione di struttura di Wolley non è possibile differenziarle
Essendo, quindi, il concetto di struttura molecolare un “descrittore dell’interno della molecola”, tale concetto dipende poco dall’ambiente in cui la molecola si trova. Questo significa che la struttura di una molecola è poco “ristrutturata” dall’ambiente: tale aspetto della struttura molecolare raramente viene evidenziato.
Nella citazione di Wolley riportata [6], la struttura molecolare è il dogma della chimica e delle altre scienze molecolari. Nelle scienze molecolari, infatti, si parte dall’assunto che una struttura, una molecola, una sostanza chimica è un solo set di proprietà strettamente correlato e questo assunto vale in ambedue i versi, nel senso che dalle proprietà si può dedurre la struttura e viceversa. Che questo non sia vero in generale basta dimostrarlo con qualche esempio, come quello mostrato in figura 3(a).
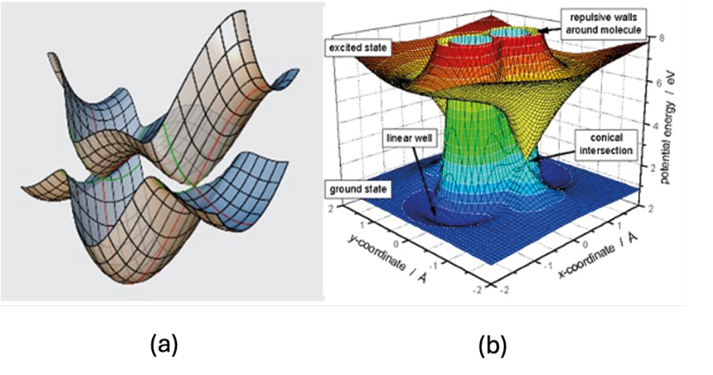
Figura 3. Due possibili curve di energia potenziale di due stati elettronici della stessa molecola (a) e intersezioni coniche tra due stati elettronici della stessa molecola (b)
Qui sono riportate le superfici di energia potenziale elettroniche di due possibili stati molecolari della stessa molecola: per esempio, il suo stato fondamentale e quello eccitato. La figura, quindi, rappresenta a livello molecolare la stessa sostanza chimica. Da questa figura, un chimico esperto può capire che i due stati elettronici hanno proprietà molto diverse: per esempio, nello stato fondamentale vi è un solo minimo assoluto di energia potenziale e questo significa un solo sistema stabile in queste condizioni; nello stato eccitato, invece, ci sono due minimi uguali di energia potenziale e un sistema in questo stato avrebbe due situazioni stabili della stessa energia. Inoltre, nella parte (b) della stessa figura è illustrato un caso di un’intersezione conica, quello in cui le due superfici di stati elettronici diversi si toccano. In quei punti non possiamo sapere se il sistema è nello stato fondamentale, con le sue caratteristiche, o in quello eccitato con le proprie caratteristiche.
La forma di un oggetto macroscopico è identificata dalla sua superficie esterna e, caratterizzata da un suo numero discreto di punti, può essere riportata in un grafico tridimensionale. Nel caso di una molecola, la sua superficie esterna di contorno dipende dalle scale delle dimensioni e dell’energia alla quale si guarda e può essere identificata solo facendo riferimento a un modello, introdotto per studiare una particolare proprietà della molecola. Il concetto di “forma molecolare” è, quindi, dipendente dal modello e dalla proprietà che tale modello vuole evidenziare.
In particolare, in quanto superficie di separazione tra la molecola e l’ambiente, la forma molecolare dipende fortemente sia dalla molecola sia dall’ambiente in cui essa si trova.
La differenza tra struttura e forma molecolare vale per ogni macromolecola: sia per una proteina sia per un polimero, ma in ambito biologico essa mostra tutta le sue potenzialità. In figura 4 è mostrata una macromolecola biologica: si vede chiaramente che essa, per una stessa struttura molecolare, può assumere differenti forme molecolari e, ovviamente, potrà esplicare differenti reazioni a seconda della sua forma.
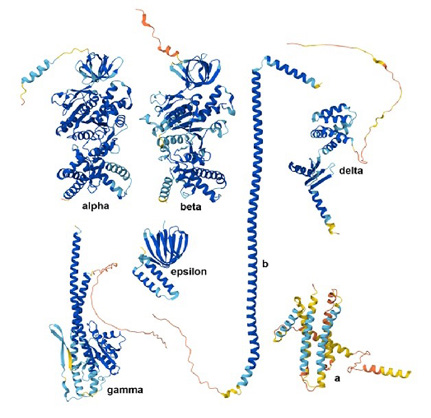
Figura 4. Le differenti forme che una macromolecola biologica può assumere
3. Il piano di complessità delle macromolecole
La nascita del concetto di macromolecola biologica è avvenuta nella prima metà del XX secolo [7]. A tale concetto, che considera l’esistenza di molecole giganti del peso molecolare di decine o centinaia di migliaia di dalton (un dalton è circa il peso atomico dell’idrogeno), come nel caso del DNA e anche molto di più, si è pervenuti superando due ostacoli scientifici generali. Il primo è quello di capire come sia possibile avere molecole così grandi tenute insieme dai normali legami chimici. A lungo, infatti, l’ipotesi dell’esistenza di queste molecole giganti è stata contrapposta all’idea che tali sostanze a livello molecolare fossero degli “aggregati” di molecole piccole. Un secondo ostacolo scientifico da superare è stato quello che Erwin Schrödinger definì il problema del “polimero aperiodico”. Schrödinger fu uno dei padri della Meccanica Quantistica e negli anni 40 del XX secolo scrisse il libro What Is Life? The Physical Aspect of the Living Cell, che ebbe una notevole influenza sulla nascita della biologia molecolare. Egli osservò che, quand’anche si fosse ritenuta possibile l’esistenza di un’enorme molecola, essa poteva essere solo formata da una singola unità ripetuta infinite volte, come le macromolecole che oggi chiamiamo polimeri. La possibilità di sintetizzare un polimero aperiodico, una macromolecola formata da differenti unità ripetitive, poneva uno scoglio scientifico insuperabile. Fu il superamento di questa difficoltà a gettare le basi dell’attuale concetto di macromolecola biologica, basi valide sia per le proteine sia per acidi nucleici.
All’inizio del XX secolo, si fece strada l’idea di estendere le normali valenze di Kekulé dalle molecole con pochi atomi alle molecole giganti. La teoria dei polipeptidi di Hofmeister e Fischer creava un substrato comune ai concetti di molecola e di macromolecola, proponendo che le proteine fossero polimeri degli amminoacidi (piccole molecole), legati insieme da normali legami chimici, i legami ammidici.
Per Emil Fischer, tuttavia, la grandezza massima del polipeptide ottenibile con i legami peptidici era di circa quaranta amminoacidi, corrispondente a un peso molecolare di circa 4.000-5.000 dalton. Le proteine naturali che avevano un peso molecolare superiore erano, quindi, un miscuglio di questi polipeptidi. Nel 1917 Soren Sorensenn mostrò che sciogliendo in acqua l’albumina dell’uovo si formava una soluzione e non una sospensione, come c’era d’aspettarsi se fosse stata un aggregato di polipeptidi di differenti dimensioni, e calcolò per questa proteina un peso molecolare di 34.000 dalton.
Sempre agli inizi del XX secolo entrarono a pieno titolo tra le tecniche sperimentali utilizzate dalla biochimica sia la spettroscopia che usava i raggi X da poco scoperti sia l’ultracentrifuga. La prima rivoluzionò l’analisi delle strutture molecolari; infatti, la spettroscopia ai raggi X offriva la possibilità di individuare la posizione degli atomi nei cristalli. C’erano, ovviamente, delle limitazioni all’applicabilità di questa tecnica spettroscopica. La prima, ovvia, limitazione era che tale tecnica richiedeva che la sostanza in esame formasse un cristallo. Tale difficoltà in ambito biochimico fu superata dalla scoperta che le fibre delle sostanze biologiche, essendo sufficientemente periodiche, potevano in pratica essere considerate un cristallo monodimensionale tale da potervi applicare la spettroscopia ai raggi X.
L’ultracentrifuga fu inventata da Theodor Svedberg che trovò anche la relazione tra la velocità di sedimentazione e il peso molecolare di una sostanza. Dopo aver costruito una macchina che arrivava a 42.000 giri al minuto, Svedberg dimostrò in maniera inoppugnabile che molte sostanze biologiche non erano a livello molecolare aggregati di molecole piccole, ma una molecola del peso atomico di decine di migliaia di dalton. L’emoglobina, per esempio, aveva un peso molecolare di 66.800 dalton.
Anche se accettate concettualmente, per le macromolecole alla fine degli anni 30 del XX secolo restava ancora irrisolto il problema fondamentale di ricostruire l’ordine dei monomeri che le rendevano specifiche. In particolare, occorreva determinare l’ordine degli amminoacidi nelle proteine e decifrare le specifiche sequenze negli acidi nucleici. Oltre al problema “tecnico”, c’era un altro problema da risolvere. La sintesi di un omopolimero (un polimero formato da un singolo monomero, come la cellulosa che ha il glucosio per monomero) era concettualmente facile. Tali macromolecole necessitavano di un enzima capace di legare i monomeri. La sintesi di un polimero aperiodico con molti tipi di monomeri necessitava non solo di molti enzimi, ma anche di un “metodo temporale” per disporre i differenti monomeri.
Dal punto di vista concettuale si sviluppò l’idea che la catena peptidica della proteina avesse una forma naturale raggiunta tramite un complesso processo chiamato folding e che la proteina potesse, tramite il cosiddetto fenomeno di “denaturazione”, perdere tale forma. Erano i legami deboli (come il legame a idrogeno) intramolecolari a tenere in piedi questa specifica “forma molecolare”. Già nel 1936 Pauling parlava della forma nativa di una proteina [8], quella biologicamente attiva negli organismi viventi.
Ritorniamo adesso alla domanda del titolo “Sono le macromolecole il piano di complessità mancante tra le molecole e le cellule?” Io credo che la risposta possa essere positiva per due motivi.
Per prima cosa, va sottolineato un punto filosofico, oltre che scientifico, essenziale. La macromolecola non si differenzia dalla molecola per il semplice fatto di essere molto più grande. Essa è più complessa, nel senso tecnico del termine. La molecola è determinata dalla sua struttura, cioè dall’organizzazione interna tra i costituenti, e a tale struttura noi ricolleghiamo le sue proprietà. La macromolecola va oltre la struttura molecolare, nel senso che le sue proprietà funzionali non sono solo determinate dalla sua struttura molecolare, cioè dalla specifica catena o dalle catene peptidiche, ma anche dalla sua forma. La struttura molecolare, infatti, non varia nel processo di folding e/o di denaturazione di una proteina, eppure queste due macromolecole sono “molto differenti”.
Per seconda cosa, analizziamo le reazioni chimiche molecolari e macromolecolari in una cellula [9]. Nella cellula troviamo molti tipi di molecole e macromolecole e avvengono innumerevoli (stimate a circa 100.000) differenti reazioni chimiche che le modificano. Da un punto di vista reattivo, l’ambiente di reazione cellulare è differente per le molecole e le macromolecole. Cerchiamo di farci un’idea dello “affollamento” che vedono tali sistemi nei due casi. La dimensione delle molecole è nell’ordine di alcuni Ångström (10–10 m) e una generica macromolecola è della dimensione di 10–8 m. Anche trascurando le aggregazioni di macromolecole, il rapporto lineare di 1 a 100 tra le molecole e le macromolecole porta a un rapporto di 1 su un milione dei loro volumi. Da questi rapporti si capisce che le molecole trovano nella cellula una situazione di “molto spazio libero” e possono facilmente migrare all’interno di una cellula, mentre per le macromolecole l’ambiente cellulare è “affollato”. Per le reazioni chimiche che coinvolgono le molecole, quindi, valgono le normali leggi statistiche, quelle legate ai grandi numeri delle molecole presenti; per le reazioni macromolecolari, invece, acquista maggiore importanza la loro individualità, quello che avviene sulla singola macromolecola e le loro interazioni. Sebbene non conoscesse le dimensioni delle macromolecole, Erwin Schrödinger nel già citato libro What is Life? si accorse che le normali leggi statiche della fisica e della chimica non potevano applicarsi ad esse all’interno della cellula.
Chiudiamo l’articolo segnalando che nel XX secolo, il mondo microscopico della chimica si è arricchito, oltre che di macromolecole, anche di strutture supramolecolari [10, 11]. Queste strutture sono enti del piano di complessità macromolecolare, o configurano altri piani di complessità? Questa ampia problematica non può essere trattata qui e, per una sua analisi dal mio punto di vista, si fa riferimento al Capitolo 4 del mio già citato libro L’interpretazione chimica del vivente.
[1] P. Oppenheim, H. Putnam, Unity of Science as a Working Hypothesis in Concepts, Theories, and the Mind-Body Problem (Eds. H. Feigl, M. Scriven, G. Maxwell), University of Minnesota Press, Minneapolis (USA), 1958, pp. 3-36.
[2] G. Villani, L’interpretazione chimica del vivente. Fondamenti sistemici delle scienze della vita, Clueb, Bologna, 2023, Conclusione.
[3] M. P. Banchetti-Robino, G. Villani, From the Atom to Living Systems: A Chemical and Philosophical Journey Into Modern and Contemporary Science, Oxford University Press, New York, 2023, Conclusion.
[4] G. Villani, https://www.academia.edu/video/jYG2Zl
[5] E. Ghibaudi, L. Cerruti, G. Villani, Structure, shape, topology: entangled concepts in molecular chemistry, Found. Chem., 2020, 22, 279-307.
[6] R. G. Wolley, Must a molecule have a shape?, J. Am. Chem. Soc., 1978, 100, 1073-1078.
[7] G. Villani, L’interpretazione chimica del vivente. cit., Capitolo 2.
[8] A. E. Mirsky, L. Pauling, On the structure of native, denatured, and coagulated proteins, in Proceedings of the National Academy of Sciences USA, 1936, 22, 439-447.
[9] G. Villani, L’interpretazione chimica del vivente. cit., Capitolo 5.
[10] J.-M. Lehn, Supramolecular Chemistry – Scope and Perspectives Molecules, Supermolecules, and Molecular Devices (Nobel Lecture), https://doi.org/10.1002/anie.198800891.
[11] V. Balzani, A. Credi, M. Venturi, Molecular Devices and Machines – Concepts and Perspectives for the Nanoworld, Weinheim (DE), Wiley-VCH, 2008.
1 https://www.britannica.com/science/missing-link 30/09/2024: “In the latter half of the 19th century, a common misinterpretation of Charles Darwin’s work was that humans were lineally descended from existing species of apes. To accept this theory and reconcile it with the hierarchical Great Chain of Being, some fossil ape-man or man-ape seemed necessary in order to complete the chain. Today it is recognized that the relationship of modern humans to the present anthropoid apes (e.g., chimpanzees) is through common ancestors rather than through direct descent”.
2 In inglese: “Those sciences that are concerned with the molecular aspects of the properties of matter, principally chemistry, but also molecular physics and biochemistry, are founded on the belief that all experiments involving molecules can be understood in terms of the relative dispositions of the constituent atoms in the molecules. This idea of molecular structure (or “molecular shape”) has been fundamental to the development of our understanding of the physicochemical properties of matter and is now so familiar and deeply ingrained in our thinking that it is usually taken for granted – it is the central dogma of molecular science”.