L’elettrochimica e l’idrogeno verde
Roberto Soldà
e-mail: roberto.solda@libero.it
Indice
2. Primo esperimento: un approfondimento relativo al principio di conservazione dell’energia
3. Secondo esperimento: un approfondimento relativo alla pila a combustibile a idrogeno
4. Terzo esperimento: un approfondimento relativo alla pila a neutralizzazione acido-base
Abstract. Currently, electrochemistry is very much involved in research related to the production of green hydrogen. In this paper, to deepen some elementary knowledge of basic electrochemistry related to the production of green hydrogen, three experiments are proposed. With little time expenditure, they can be linked to the electrochemistry laboratory experiences indicated for the first two years of secondary school.
Keywords: idrogeno verde; pila a combustibile; cella a neutralizzazione acido-base
Attualmente la ricerca scientifica e industriale è molto impegnata nella produzione di energia e combustibili alternativi in grado di contribuire a mitigare la crisi energetica e nello stesso tempo l’inquinamento ambientale a livello globale.
A tale proposito, la scissione dell’acqua mediante elettrolisi viene proposta come un approccio molto promettente per la produzione di H2, definito “verde” quando si usa elettricità da fonti rinnovabili senza emissioni di CO2.
In quest’ambito è anche molto attiva la ricerca relativa alla tecnica elettrochimica denominata con l’acronimo ABEFB (batteria a flusso elettrochimico acido-base), basata sulla pila a neutralizzazione acido-base, in grado di produrre H2 senza richiedere energia elettrica e anzi producendone [1].
Negli esperimenti di seguito proposti si approfondiscono alcuni concetti di elettrochimica di base inerenti alla produzione dell’idrogeno verde che di solito non vengono trattati, o che vengono introdotti solo teoricamente.
A tale scopo vengono presentati tre esperimenti da effettuarsi nel corso delle attività di laboratorio relative al primo biennio della scuola secondaria di secondo grado.
2. Primo esperimento: un approfondimento relativo al principio di conservazione dell’energia
Prerequisiti
Leggi di Faraday
Effetti di una corrente elettrica in un circuito
Lavoro elettrico: Lel =V × Q
Strumenti e reagenti
Voltametro di Hoffmann
Elettrodi platino o grafite
Alimentatore di corrente continua con reostato e cursore
Soluzione di H2SO4 preparata sciogliendo 2 cm3 di H2SO4 al 96% in 1000 cm3 di H2O
Tempo richiesto per l’esperimento
Circa 2 ore (incluso quello per la verifica delle leggi di Faraday)
Premessa
In alcuni testi di chimica di base, per illustrare la legge di conservazione dell’energia nelle reazioni chimiche, si prende in esame la seguente reazione esotermica:
H2(g) + 1/2 O2(g) ⇄ H2O(l) + 286 KJ/mole (1)
evidenziando che il calore sviluppato in un calorimetro (sotto forma di energia termica) è equivalente all’energia elettrica (sotto forma di lavoro elettrico) consumata nella reazione inversa di decomposizione dell’acqua ottenuta mediante elettrolisi:
286 KJ/mole + H2O(l) ⇄ H2(g) + 1/2 O2(g) (2)
Ebbene, in base alle competenze degli allievi, è possibile sfruttare l’esperimento di elettrolisi dell’acqua e gli stessi dati sperimentali ottenuti per la verifica delle leggi di Faraday anche per la verifica della legge di conservazione dell’energia relativa alla reazione (1).
A tale scopo, prima di iniziare l’attività di laboratorio, è utile richiamare i seguenti concetti.
- La legge di conservazione dell’energia
- Il bilancio energetico in un circuito elettrico assemblato per elettrolisi pari a
Energiaelettrica totale applicata = Lelettrico per elettrolisi acqua + Heffetto termico
La quantità di lavoro elettrico Lel consumata per l’elettrolisi dell’acqua viene espressa in Joule e si ottiene con la formula Lel =V × Q in cui Q è la carica elettrica in Coulomb e V è la differenza di potenziale in Volt necessaria per effettuare il trasferimento della carica elettrica Q da un elettrodo all’altro della cella elettrolitica.
In particolare, evitando considerazioni di termodinamica che presenterebbero ovvie difficoltà per allievi di un corso di chimica di base, si fa notare che, essendo necessaria una carica Q di due Faraday per decomporre elettroliticamente una mole d’acqua, dalla formula suddetta risulta:
V =Lel/Q = 286 /2 × 96485 = 1,48 V
Itinerario didattico
Gli studenti effettuano l’attività di laboratorio seguendo la procedura riportata nel testo in dotazione o nel manuale di laboratorio.
Quindi, sfruttando i dati ottenuti mediante l’esperimento relativo alle leggi di Faraday con il voltametro di Hoffmann, gli allievi possono calcolare, tramite la legge generale dei gas, le moli di H2 sviluppate e quelle di H2O decomposte.
Poi, ponendo in evidenza il rapporto fra le moli di H2O decomposte e i Coulomb (Qa) usati per decomporle, si aiutano i ragazzi a impostare la proporzione per ottenere i Coulomb (Qb) usati per decomporre 1 mol di H2O:
Qa : mol H2O decomposte = Qb : 1 mol H2O decomposta
calcolando così:
Qb = Qa/mol H2O decomposte
Infine, si ottiene il lavoro elettrico per decomporre 1 mol di H2O dalla seguente relazione:
Lel = Qb × 1,48
A titolo di esempio, si riportano i dati sperimentali e numerici elaborati da studenti del primo biennio di un corso di chimica di base di un istituto tecnico non a indirizzo chimico negli anni ‘80 del secolo scorso.
Condizioni sperimentali
Elettrolisi di H2O con voltametro di Hoffmann di una soluzione acquosa ottenuta portando 2 cm3 di H2SO4 al 96% a un volume di 1000 cm3; pressione atmosferica = 101,3 kPa; temperatura = 20° C; batteria da 12 V; intensità di corrente = 0,1 A; durata elettrolisi = 30 minuti.
Dati sperimentali ottenuti
Tempo: 30 minuti (1800 secondi)
Quantità di carica: Qa= i × t = 0,1 × 1800 = 180 C
Volume di H2 ottenuto = 21,30 cm3
Volume di O2 ottenuto = 10,50 cm3
Elaborazione dati
Le mol di H2 prodotte si ottengono usando l’equazione di stato di gas, PV = nRT, e cioè:
101, 3 × 21,3 10-3 = n(H2) × 8,31 × 293
da cui:
n(H2) = 8,86 × 10–4
Considerando che mol H2Odecomposte = mol H2prodotte, si ha anche che:
mol H2O decomposte = 8,86 × 10–4
Allora la quantità di carica Q per decomporre 1 mol di H2O si ottiene da:
180 : 8,86 × 10–4 = Q : 1 mol H2Odecomposta
Q = 20,34 × 104 C
A questo punto è possibile calcolare il lavoro elettrico Lel per decomporre 1 mol di H2O:
Lel = 20,34 × 104 × 1,48 = 301 KJ
Pertanto, l’errore percentuale commesso dagli studenti è:
E% = 100 × (301 – 286)/286 = 5,2 %
Nota: anche altri gruppi di studenti hanno riportato errori percentuali compresi tra il 4% e 6%
3. Secondo esperimento: un approfondimento relativo alla pila a combustibile a idrogeno
Prerequisiti teorici e sperimentali
Conoscenze e abilità di elettrochimica a livello di chimica di base.
Sapere utilizzare gli strumenti per esperimenti di elettrochimica di base proposti nelle indicazioni curricolari per il primo biennio della scuola secondaria di secondo grado.
Reagenti e strumenti di misura
Soluzione diluita di NaHCO3
Contenitore di vetro
Tappo con due elettrodi di grafite (carboncini estratti da una pila scarica e inseriti nel tappo)
Pila di 4,5 V
Voltmetro o tester
1 led
Tempo richiesto per l’esperimento
Circa 2 ore
Premessa
È noto che diversi anni fa, a livello di chimica di base, veniva proposto come approccio sperimentale al funzionamento di una pila a combustibile a idrogeno, un esperimento collegato all’elettrolisi dell’acqua [2].
Infatti, dopo avere effettuato l’elettrolisi dell’acqua, utilizzando procedure già note (ad esempio l’elettrolisi di una soluzione acquosa di NaHCO3 con due carboncini estratti da una pila scarica), interrompendo l’esperimento e collegando i due elettrodi con una lampadina da 1V o altro equivalente rivelatore di corrente, è possibile verificare sperimentalmente che la cella elettrolitica “si può trasformare” in una particolare cella elettrochimica il cui funzionamento è basato sulle due semi-reazioni di seguito riportate.
Anodo H2(g) ⇄ 2H+ + 2e–
Catodo 1/2O2(g) + 2H+ + 2e– ⇄ H2O(l)
La reazione totale, quindi, è:
H2(g) + 1/2O2(g) ⇄ H2O(l)
Tale reazione è inversa di quella implicata nell’elettrolisi dell’acqua.
Pertanto, anche se in un articolo del J. Chem. Educ. [3] si dimostra che tale pila presenta limitazioni e inconvenienti dovuti al fenomeno di polarizzazione, si ritiene comunque che l’esperimento sia adeguato ad approfondire in un corso di chimica di base l’interconversione tra energia chimica ed elettrica.
Attività di laboratorio
Seguendo le modalità operative come quelle indicate sopra, gli allievi pervengono alle seguenti osservazioni:
• durante l’elettrolisi, gli elettrodi si rivestono ciascuno di una “guaina” di gas rispettivamente di H2 e O2;
• scollegando la pila esterna e collegando i due elettrodi a uno strumento misuratore di tensione, si rileva una certa differenza di potenziale FEM che però (a intensità di corrente nulla) non rimane costante nel tempo;
• scollegando la pila esterna e collegando i due elettrodi ad un led, si nota accensione del led, la cui luce diventa sempre più flebile a mano a mano che le bollicine di idrogeno e ossigeno diminuiscono nel tempo.
A titolo di esempio, si riporta in figura 1 il grafico della FEM in funzione del tempo ottenuto dopo l’interruzione dell’elettrolisi dell’acqua, usando una soluzione diluita di NaHCO3 in un contenitore di vetro sigillato mediante tappo contenente due elettrodi di grafite (carboncini estratti da una pila scarica e inseriti nel tappo) e una pila di 4,5V.
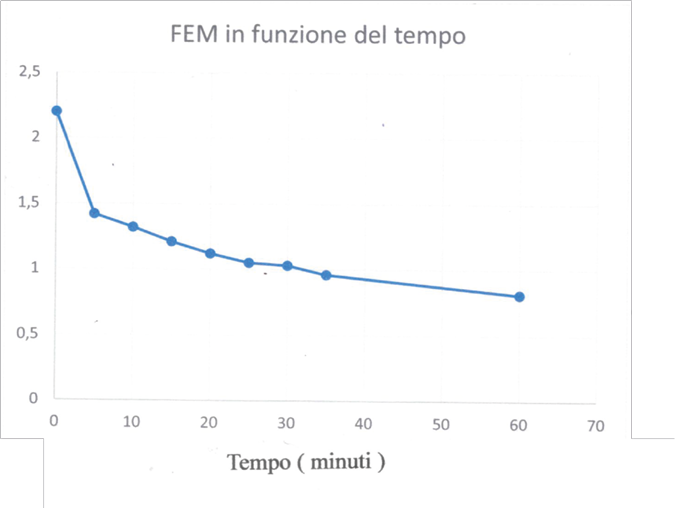
Figura 1. FEM in funzione del tempo dopo aver scollegato la pila esterna
Conclusione
I ragazzi, basandosi sulle loro semplici osservazioni relative all’esistenza della corrente e alla differenza di potenziale rilevate all’interruzione dell’elettrolisi dell’acqua, concludono abbastanza facilmente che la cella si è trasformata in un dispositivo in grado di produrre energia elettrica, cioè appunto una particolare pila.
Utilizzando le loro nozioni di elettrochimica di base, forniscono la seguente interpretazione:
Con l’interruzione dell’elettrolisi, gli elettrodi “cessano di essere inerti” e si comportano come gli elettrodi ad idrogeno e ad ossigeno di una pila a combustibile a idrogeno.
Poi, tramite un’immagine del dispositivo di una pila combustibile a idrogeno commerciale, apprendono in modo significativo e non mnemonico che:
- il suo funzionamento è basato sul processo opposto all’elettrolisi;
- le semi-reazioni di ossidazione e riduzione e la reazione globale sono le stesse implicate nella pila usata nel loro esperimento.
Inoltre, anche con l’ausilio dell’insegnante, gli studenti comprendono che la diminuzione della FEM nel tempo della “pila” (utilizzando l’idrogeno e l’ossigeno prodotti con l’elettrolisi) dimostra che essa non rappresenta realmente una pila a combustibile.
Infatti, la FEM di una pila, finché non viene usata, deve rimanere costante nel tempo; invece, in questo caso la FEM diminuisce nel tempo perché, non essendo separati i due elettrodi e le due semi-reazioni, avviene il cortocircuito interno.
4. Terzo esperimento: un approfondimento relativo alla pila a neutralizzazione acido-base
Il funzionamento della pila a neutralizzazione acido-base non viene trattato nel primo biennio della scuola secondaria di secondo grado, ma solo eventualmente nel triennio delle scuole a indirizzo chimico.
Tuttavia, è possibile fornire una prima informazione a livello di chimica di base mediante un approccio sperimentale induttivo sfruttando adeguatamente l’esperienza relativa alle pile.
Prerequisiti teorici e pratici
Conoscenze relative al fenomeno dell’elettrizzazione e quello relativo all’interfaccia fra due materiali (e in particolare fra un elettrolita e un elettrodo).
Concetti e conoscenze di elettrochimica di base.
Equazione di Nernst (opzionale).
Sapere individuare praticamente, mediante l’utilizzo adeguato del tester, l’anodo ed il catodo di una pila, le relative semi-reazioni di ossidazione e di riduzione e, quindi, dedurre (eventualmente anche con l’ausilio dell’insegnante) la relazione tra tali semi-reazioni e il segno di ciascun elettrodo di una pila.
Reattivi e strumenti
Soluzione acquosa di NaOH 1M e una soluzione acquosa di HCl 1M
Due elettrodi di grafite (due mine di matita o due carboncini estratti da una pila scarica)
Ponte salino costituito da una striscia di carta da filtro bagnata con una soluzione satura di KNO3
Voltmetro o tester
Lamina di Cu e soluzione satura di CuSO4 per elettrodo di riferimento Cu/CuSO4 (sol. satura) (opzionale)
Tempo necessario per l’esperimento
Anche in questo caso sono richieste circa 2 ore (incluso il tempo per l’esperienza relativa alle pile)
Discussione preliminare
Prima di procedere all’attività di laboratorio è opportuno richiamare alcuni concetti elementari relativi al fenomeno di elettrizzazione e alla teoria del doppio strato e, in particolare, sottolineare che, in ciascuna semi-cella di una pila, si ha la presenza di un equilibrio, come quello sotto riportato, fra la forma ossidata (OX) e la forma ridotta (RED) della coppia redox:
OX + ne– ⇄ RED
Così gli allievi possono comprendere abbastanza facilmente che anche nella soluzione di NaOH 1M ([H+] =10–14 M) è presente l’equilibrio:
2H+ + 2e– ⇄ H2
implicante appunto la presenza di ioni idrogeno.
E, a tale proposito, l’insegnante può riferire che, sperimentalmente a 20 °C, è risultato:
pressione di H2 in sol. acq. di NaOH 1 M =10–34 bar
pressione H2 in sol. acq. di HCl 1 M = 10–24 bar
(Un eventuale approfondimento è riportato in appendice)
Procedimento
Si propone agli allievi di allestire la pila seguente rappresentata (in prima approssimazione) con lo schema seguente:
C/Na+ (1 M), OH– (1 M)//H+ (1 M), Cl– (1 M)/C
In questo modo, seguendo le stesse modalità operative indicate per lo svolgimento dell’esperienza dedicata alle pile e, basandosi sulle loro osservazioni e misure, gli allievi possono giungere da soli alle seguenti conclusioni:
• la FEM della pila è 0,546 V
• a circuito aperto, l’elettrodo della semi-cella contenente NaOH 1 M ha carica e potenziale negativi, ossia funziona da anodo, mentre l’elettrodo nella semi-cella contenente HCl 1 M ha carica e potenziale positivi e, quindi, funziona da catodo
• a circuito chiuso, gli elettroni migrano dalla semi-celle con NaOH alla semi-cella con HCl e solo al catodo si osservano bollicine di gas (idrogeno)
• al saggio con cartina di pH si verifica che il pH tende a 7 in entrambe le due semi-celle
Quindi, in maniera autonoma apprendono senza difficoltà il motivo per cui questa pila è chiamata “a neutralizzazione” e, in particolare, perché questa pila, oltre a produrre energia elettrica, è in grado di fornire anche idrogeno.
Generalmente, invece, per quanto riguarda le semi-reazioni e la reazione globale, è opportuno che l’insegnante spieghi che le semi-reazioni implicate nella loro pila a neutralizzazione sono:
Anodo 2OH– + H2 ⇄ 2H2O + 2e–
Catodo 2H+ + 2e– ⇄ H2
Reazione globale 2OH– + H2(NaOH) + 2H+(HCl) ⇄ 2H2O + H2(HCl)
Pertanto, lo schema reale della pila da loro costruita è:
C/H2(g, p =10–34 bar), NaOH (1 M)//HCl (1 M), H2 (g, p= 10–24 bar)/C
È importante far notare agli studenti che questo schema rende ragione del fatto che la FEM misurata è inferiore a quella prevista in base ai potenziali standard:
FEMº = Eºcatodo – Eºanodo = 0 – (– 0,83V) = + 0,83 V
che si riferiscono, appunto, alle condizioni standard per le quali lo schema sarebbe:
C/H2(g, p =1 bar), NaOH (1 M)//HCl (1 M), H2 (g, p = 1 bar)/C
I tre esperimenti ragguppati insieme in questo articolo sono stati proposti singolarmente in classi diverse e in anni diversi.
Comunque, ogni esperimento ha generalmente suscitato notevole interesse da parte della maggioranza degli allievi e ha contribuito ad avvicinare gli studenti all’elettrochimica, approfondendo sperimentalmente alcuni concetti notoriamente di difficile comprensione a livello di chimica di base.
Sono grato ai professori Maria De Nobili e Renzo Bortolomeazzi dell’Università di Udine, all’ingegnere Renato Ballerino e all’amico Pasquale Fetto per l’interessamento e le fruttuose osservazioni che hanno contribuito a migliorare la stesura di questo articolo.
[1] A. Saez, V. Montiel, A. Aldaz, An acid -base electrochemical flow battery as energy storage system, International Journal of Hydrogen Energy, 2016, 41, 17801.
[2] M. Lewis, G. Waller, La chimica: fatti e idee, Zanichelli Editore, Bologna, 1984.
[3] S. Roffia, V. Concialini, C. Paradisi, The interconversion of electrical and chemical energy - The electrolysis of water and the hydrogen-oxygen fuel cell, J. Chem. Educ., 1988, 65(3), 272.
[4] Conversion of reference electrode potentials, Education Basics-Curtin University, 2020.
[5] R. Cozzi, P. Protti, T. Ruaro, Analisi chimica: moderni metodi strumentali - Teoria e strumentazione, Editrice Clued-ESU, Milano, 1986.
Approfondimento con l’equazione di Nernst
Con la strumentazione usata per l’esperienza relativa alla misura di FEM delle pile, si possono fare assemblare le due pile seguenti:
(A) Cu/CuSO4 (sol. satura)//HCl (1 M)/C
(B) C/NaOH (1 M)//CuSO4 (sol. satura)/Cu
nelle quali si fa notare che sono presenti le due seguenti semi-celle:
HCl (1 M)/C C/NaOH (1 M)
accoppiate alla semi-cella sotto riportata che funziona come elettrodo di riferimento (E° = 0,318 V) [4]:
Cu/CuSO4 (sol. satura)
In questo modo, a 20 °C, si misurano le due seguenti FEM:
FEM della pila (A) = 0,546 V
FEM della pila (B) = 0,140 V
Si può, quindi, ricavare il valore del potenziale, Eh, a 20 °C delle due semi-celle accoppiate alla semi-cella di riferimento:
semi-cella HCl (1 M)/C Eh = 0,724 V (pH = 0)
semi-cella C/NaOH (1 M) Eh = 0,178 V (pH = 14)
Ricordando che:
Eh = 0,029 × log [H+]2/pH2
nota [H+] nelle due semi-celle, si può calcolare per entrambe la pressione di H2 che risulta:
pH2 in sol. acq. di NaOH 1 M =10–34 bar
pH2 in sol. acq. di HCl 1 M = 10–24 bar
Alternativamente si perviene agli stessi risultati applicando a 20 °C la seguente equazione:
rH = 34,4 × Eh + 2pH
in cui rH = –logpH2, una grandezza introdotta da Mansfield Clark (analoga a pH) che esprime l’attività ossidante o riducente di un sistema [5].