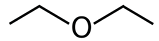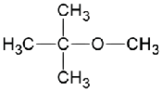GreenLab: un approccio green nel laboratorio di chimica organica
Andrea Burato, Silvia Recchia e Federica Stazi
I.I.S. Ferraris-Fermi di Verona
e-mail:stazi.federica@ferrarisfermiclass.it
Indice
Abstract. The organic chemistry lab in schools, traditionally characterized by use of hazardous reagents and toxic solvents, represents an environment where exposure to harmful substances can be frequent, both for students and teachers. Therefore, one of the most significant challenges facing this discipline today concerns the application of Green Chemistry principles, with the aim of making the laboratory a safer and more sustainable place. Making a teaching laboratory greener, especially one focused on organic chemistry, can represent a true revolution encompassing many aspects: from the use of less hazardous substances to the reduction of waste, from employing sustainable solvents to optimizing resources. The challenge lies in transforming traditional teaching methods, often long-standing, into practices that not only maintain educational effectiveness but also adhere to safety and sustainability standards. This article aims to explore the possibilities of applying Green Chemistry in school laboratory activities, providing concrete examples and emphasizing the importance of a responsible and conscious approach in training future chemistry professionals.
Keywords: chimica verde; sostenibilità; laboratorio di chimica organica; standard di sicurezza; riduzione dei rifiuti
Rendere più sostenibile il laboratorio di chimica organica di un triennio tecnico in una scuola a indirizzo chimico come la nostra è stata la conseguenza di una graduale presa di coscienza da parte di tutti i docenti della disciplina. Il confronto con i responsabili scolastici della sicurezza, i corsi di formazione in tema e la costante riflessione sulle attività didattiche proposte, ha trasformato quella che all’inizio sembrava quasi un’imposizione dall’alto in una opportunità sia pratica che etica.
Non nascondiamo che l’aspetto economico ha inciso sulle nostre scelte: i costi dello smaltimento dei reflui tossici sono sempre più onerosi e i prodotti chimici sempre più costosi. I costi di un laboratorio di chimica per una scuola sono sempre più proibitivi a fronte di risorse sempre più esigue.
Inoltre, le normative sulla sicurezza (D. Lgs. 81/2008, REACH e CLP) impongono il divieto di utilizzare alcune delle sostanze presenti in molte procedure “storiche” di laboratorio di chimica e sottolineano il principio di prevenzione sostituendo l’uso delle sostanze pericolose (tossiche acute o a lungo termine) con sostanze meno pericolose o, meglio ancora, non pericolose.
A tal proposito ricordiamo che gli studenti nei laboratori sono equiparati a lavoratori e i docenti sono considerati preposti.
Così, partendo dall’analisi delle esperienze che da anni venivano proposte agli studenti del triennio dell’istituto tecnico tecnologico a indirizzo Chimica, Materiali e Biotecnologie, presenti in molti libri di testo per la scuola e proposte anche in molti corsi universitari, abbiamo iniziato a sostituire, dove possibile, i composti (come fenolo) e i solventi (come i solventi clorurati o l’etere dietilico) pericolosi con analoghi più innocui; inoltre, abbiamo preferito metodiche che evitassero la produzione di volumi eccessivi di reflui tossici o che prevedessero un impegno energetico più basso (ad esempio, sintesi a temperatura ambiente, anziché a lento riflusso).
La ricerca di substrati meno pericolosi ci ha ben presto indirizzati verso le matrici naturali, soprattutto vegetali, da cui, ad esempio, con una semplice distillazione in corrente di vapore, possono essere estratti oli essenziali ricchi di sostanze organiche altamente funzionalizzate e, quindi, didatticamente molto utili.
Il processo di transizione al “green” ha coinvolto anche gli studenti, che sono diventati soggetti attivi nelle attività di ricerca di sostanze e metodi alternativi, rendendoli ancor più consapevoli e responsabili, sviluppando competenze non solo disciplinari, ma anche di cittadinanza attiva. Tra queste competenze spicca la consapevolezza dell’impatto delle proprie azioni e dei propri comportamenti sull’ambiente e la conseguente capacità di progettare e sviluppare soluzioni alternative sostenibili. Un’altra competenza sviluppata è quella di comprendere le implicazioni sociali delle proprie azioni in laboratorio e di sviluppare una visione più ampia del ruolo che la chimica svolge nella società. Infine, attraverso questo percorso, gli studenti hanno allenato il pensiero critico attraverso un compito di realtà: rivedere le metodiche tradizionali per renderle più sostenibili senza comprometterne l’efficacia. Questo li prepara ad affrontare, una volta entrati nel mondo del lavoro, le sfide professionali con spirito innovativo, a collaborare e cooperare con gli altri in modo costruttivo, rafforzando le capacità di team working e relazionali.
Anche dal punto di vista metodologico, il processo ha permesso di trasformare la didattica laboratoriale di tipo trasmissivo (“ti insegno come deve essere, verifichi che sia vero”) in una didattica innovativa, capovolta e attiva.
La Green Chemistry, o chimica verde, è un approccio progettuale che mira a sviluppare processi e prodotti chimici sostenibili, riducendo l’impatto ambientale e promuovendo l’efficienza delle risorse. Si basa su dodici principi fondamentali che non solo guidano la ricerca e l’industria chimica, ma promuovono anche una cultura di responsabilità ambientale e sostenibilità [1].
1. Prevenire gli sprechi: è meglio prevenire la generazione di rifiuti piuttosto che trattarli o bonificarli una volta generati.
2. Massimizzare l’economia atomica: i processi chimici dovrebbero massimizzare l’uso degli atomi, minimizzando i materiali non utili, in modo che il prodotto finale contenga la massima proporzione di materiali di partenza.
3. Progettare sintesi chimiche più sicure: ogni qualvolta sia possibile, i metodi di sintesi dovrebbero essere progettati per impiegare e produrre sostanze caratterizzate da un livello ridotto o dall’assenza di tossicità per la salute umana e per l’ambiente.
4. Progettare sostanze chimiche più sicure: i prodotti chimici dovrebbero essere progettati per assolvere efficacemente la funzione desiderata, riducendo allo stesso tempo la tossicità.
5. Utilizzare solventi e ausiliari più sicuri: l’uso di sostanze ausiliarie (ad es., solventi, mezzi di separazione, ecc.) dovrebbe essere reso superfluo ogni volta che ciò sia possibile o altrimenti risultare innocuo.
6. Aumentare l’efficienza energetica: i processi chimici dovrebbero essere condotti a temperatura e pressione ambientali, quando possibile, per ridurre il consumo energetico.
7. Utilizzare materie prime rinnovabili: quando possibile, utilizzare materie prime rinnovabili, anziché risorse esauribili.
8. Riduzione dei derivati: minimizzare o eliminare l’uso di derivati chimici, che possono richidere passaggi supplementari e aumentare i rifiuti, come gruppi bloccanti o protettivi, o qualsiasi modifica temporanea.
9. Utilizzare catalizzatori: i reagenti catalitici (quanto più possibile selettivi) sono da preferire ai reagenti stechiometrici.
10. Progettare prodotti e sostanze chimiche per degradarsi dopo l’uso: i prodotti chimici dovrebbero essere progettati in modo che alla fine della loro funzione si degradino in prodotti innocui e non persistano nell’ambiente.
11. Analizzare in tempo reale per la prevenzione dell’inquinamento: è necessario sviluppare metodiche analitiche che consentano il monitoraggio e il controllo in tempo reale dei processi allo scopo di identificare tempestivamente la formazione di sostanze pericolose.
12. Ridurre al minimo il rischio di incidenti: le sostanze e le forme in cui queste vengono impiegate in un processo chimico dovrebbero essere scelte in modo da ridurre al minimo il rischio di incidenti di natura chimica quali, per esempio, il rilascio di sostanze, le esplosioni o gli incendi.
Nel nostro processo di cambiamento ci siamo concentrati soprattutto sui principi 1, 3 e 5.
Il salto paradigmatico ha coinvolto ovviamente anche la metodologia didattica e l’organizzazione del lavoro in laboratorio. Tradizionalmente, i ragazzi erano abituati a iniziare la lezione in laboratorio con la spiegazione e la dettatura della metodica, illustrando i punti salienti e le tecniche: il modello di fondo era dunque quello trasmissivo.
Abbiamo pensato di stravolgere la didattica di laboratorio scegliendo, dove possibile, un apprendimento per scoperta, quindi attivo, in cui gli studenti esplorano e costruiscono le proprie conoscenze attraverso l’esperienza diretta. Nel contesto dell’attività di laboratorio di chimica organica, questo cambiamento paradigmatico è stato particolarmente significativo: invece di limitarsi a verificare conoscenze già assodate, gli studenti sono stati incoraggiati a formulare ipotesi, condurre esperimenti e analizzare criticamente i risultati.
L’organizzazione del lavoro ha previsto:
• metodiche complete, ricche di tutti gli aspetti pratici, tecnici e teorici per ogni esperienza, disponibili su LMS (Learning Management System);
• video-metodiche per la didattica capovolta; ogni esperienza è stata introdotta mediante una videolezione da guardare a casa in cui veniva spiegata, per punti salienti, la metodica di laboratorio arricchita da quiz o problem solving; quindi, in laboratorio i ragazzi arrivavano già preparati, conoscendo gli obiettivi e il protocollo operativo, pronti per esporre i propri dubbi, per porre domande e approfondire solo gli aspetti più significativi dell’esperienza;
• per ogni esperienza è stata chiesta la produzione di schemi a blocchi delle procedure e di tabelle di raccolta dei dati;
• è sempre stata effettuata la caratterizzazione (anche strumentale) delle sostanze prodotte o purificate;
• ogni esperienza si è conclusa con la discussione collettiva e, a seconda del tipo di attività, è stata prevista la somministrazione di test di autovalutazione, o test di verifica strutturata, o la produzione di una relazione scritta guidata.
Ritornando alla svolta “green”, cercando di perseguire il quarto principio della Green Chemistry, ovvero utilizzare reagenti e materiali il meno tossici possibile, abbiamo approfondito lo studio delle matrici vegetali, in particolare dell’estrazione di olii essenziali e della loro caratterizzazione. La composizione degli olii essenziali è costituita da sostanze organiche ricche di gruppi funzionali molto diversi tra di loro che possono essere studiati mediante semplici saggi di laboratorio. La loro estrazione è semplice (basta una distillazione in corrente di vapore), ma la loro caratterizzazione è dal punto di vista didattico molto efficace e ricca di spunti di riflessione. La stessa sostanza, estratta all’inizio dell’anno scolastico, può essere caratterizzata e ripresa successivamente per ulteriori analisi, a mano a mano che si procede con la programmazione. Questa non è altro che l’applicazione di una didattica a spirale, un approccio che prevede che gli studenti affrontino gradualmente concetti complessi, partendo da nozioni di base sui gruppi funzionali e le loro caratteristiche chimiche.
In un primo momento, si possono introdurre le tecniche di estrazione, come la distillazione o l’estrazione con solvente, affinché gli studenti comprendano i principi fondamentali alla base di questi metodi. Successivamente, si può passare all’analisi in laboratorio, dove gli studenti identificano e caratterizzano i gruppi funzionali presenti negli olii essenziali estratti, utilizzando tecniche come la spettroscopia IR e la cromatografia. Questo percorso consente di rivedere e approfondire le conoscenze acquisite in precedenza, stimolando il pensiero critico e la comprensione profonda dei nuclei concettuali proposti. In tal modo, gli studenti non solo acquisiscono competenze tecniche, ma promuovono un apprendimento significativo e duraturo.
Cristallizzazione dell’acido sorbico
La prima parte della didattica laboratoriale della chimica organica prevede lo svolgimento di esperienze atte ad acquisire la manualità di base su alcuni processi che si ripeteranno poi in esperienze più complesse, come quelle di sintesi. Tra queste, la prima tradizionalmente affrontata è la purificazione di una sostanza per cristallizzazione, che prevede le seguenti fasi:
• analisi della curva di solubilità della sostanza da purificare e scelta del solvente
• montaggio dell’apparecchiatura di riflusso
• filtrazione a caldo delle impurezze insolubili
• filtrazione su buchner del prodotto cristallizzato
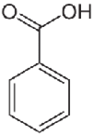
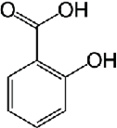
Tradizionalmente, i libri di testo propongono substrati quali acido benzoico o salicilico, che sono poco rispondenti ai requisiti green (Tabella 1).
Tabella 1. Indicazioni di rischio dell’acido benzoico e salicilico
|
SOSTANZA |
PITTOGRAMMI |
FRASI H |
|
|
ACIDO BENZOICO |
|
|
H315 Provoca irritazione cutanea. H318 Provoca gravi lesioni oculari. H372 Provoca danni agli organi (polmoni) in caso di esposizione prolungata o ripetuta se inalato. |
|
ACIDO SALICILICO |
|
|
H302 Nocivo se ingerito. H318 Provoca gravi lesioni oculari. H361d Sospettato di nuocere al feto. |
Il nuovo substrato green proposto è l’acido sorbico, un acido organico utilizzato come antimicrobico e antifungino negli alimenti, nei cosmetici e nei farmaci. Nell’Unione europea è utilizzabile come additivo alimentare con il codice E 200 in diversi alimenti a diverse concentrazioni massime.2 Ecco alcuni esempi:
• sulla buccia dei limoni freschi 20 mg/kg
• frutta secca 1000 mg/kg
• alcuni latticini e formaggi 1000 mg/kg
• confetture/marmellate a basso tenore di zucchero 1000 mg/kg
• birra 200 mg/kg
Sono anche autorizzati il sorbato di potassio (E 202) e il sorbato di calcio (E 203). Il sorbato di sodio (E 201) non è un additivo autorizzato nella UE a causa della dimostrata genotossicità.
Come si vede (Tabella 2), l’acido sorbico ha interessanti applicazioni industriali che possono essere richieste agli studenti in termini di approfondimento personale; inoltre, dalle frasi H si osserva chiaramente un drastico calo nella gravità degli Hazard.
Tabella 2. Indicazioni di rischio dell’acido sorbico
|
SOSTANZA |
PITTOGRAMMI |
FRASI H |
|
ACIDO SORBICO |
|
H315 Provoca irritazione cutanea. H318 Provoca gravi lesioni oculari. |
Per quanto riguarda le proprietà fisiche, anche per l’acido sorbico, come gli altri, il solvente di cristallizzazione è l’acqua. Dai dati di letteratura la curva di solubilità rispecchia i requisiti per il processo di cristallizzazione, ovvero bassa solubilità a basse temperature, con un incremento deciso a mano a mano che la temperatura sale: passando dalla temperatura di 20 °C a 100 °C, la solubilità dell’acido sorbico in acqua aumenta di 25 volte (Figura 1).
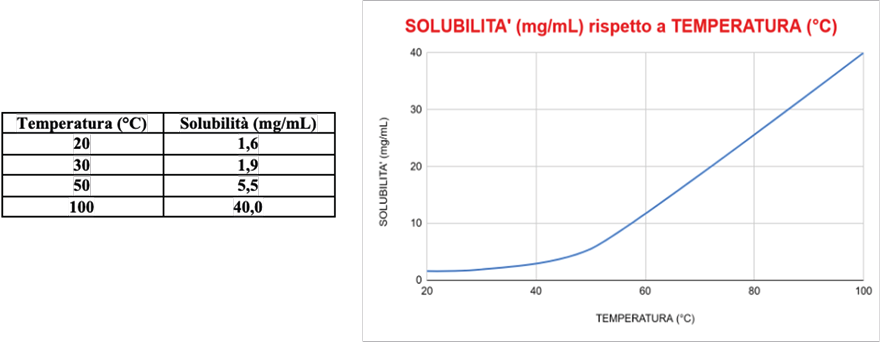
Figura 1. Curva di solubilità dell’acido sorbico
Estrazione con solvente
Subito dopo la cristallizzazione, generalmente si propone l’estrazione con solvente che prevede i seguenti passaggi:
• studio della polarità dei substrati da estrarre e della relativa solubilità
• scelta degli opportuni solventi di estrazione
• uso dell’imbuto separatore
Tra le metodiche proposte comunemente si trova l’estrazione della caffeina, che però utilizza il diclorometano, un solvente alogenato ormai in disuso nei laboratori scolastici.1 Già diversi anni fa è stata introdotta la separazione mediante estrazione di una miscela acido benzoico/saccarosio utilizzando come solventi etere dietilico e acqua. Sia l’acido benzoico, come visto prima, che l’etere dietilico presentano però delle problematiche a livello di tossicità e pericolosità nella manipolazione, sicuramente inferiori al diclorometano, ma comunque non ancora nell’ottica green che si sta implementando. Come in precedenza il substrato è stato sostituito, anche in questo caso, dall’acido sorbico. Dall’analisi della Tabella 3 si osserva che la solubilità dell’acido sorbico in acqua è influenzata dallo stesso saccarosio: aumentando la percentuale (%) di saccarosio la solubilità in acqua diminuisce, favorendo così l’estrazione con solvente.
Tabella 3. Solubilità dell’acido sorbico in acqua, etanolo e in presenza di saccarosio

Relativamente alla scelta del solvente, oggigiorno sono disponibili [3] diverse tabelle di classificazione dei solventi (Tabella 4), elaborate dalle aziende internazionali, quali per esempio Pfizer [4].
Tabella 4. Classificazione dei solventi in base alla tossicità
|
Preferibile |
Utilizzabile |
Indesiderato |
|
Acqua Acetone Etanolo 2-Propanolo 1-Propanolo Acetato di etile Acetato di isopropile Metanolo Etil metil chetone 1-Butanolo terz-Butanolo |
Cicloesano Eptano Toluene Metilcicloesano Metil terbutil etere Isoottano Acetonitrile 2-Metiltetraidrofurano Tetraidrofurano Xileni Dimetil solfossido Acido acetico Glicole etilenico |
Pentano Esano (e isomeri) Diisopropil etere Dietil etere Diclorometano Dicloroetano Cloroformio Dimetil formammide N-Metilpirrolidinone Piridina Dimetil acetato Diossano Dimetossietano Benzene Tetracloruro di carbonio |
Inizialmente si è pensato di sostituire il dietil etere con il metil t-butil etere, ma anche questo solvente presenta diversi svantaggi, tra cui la difficoltà di recupero al rotavapor e, quindi, il suo utilizzo. Tali difficoltà sono state superate scegliendo l’acetato di etile, classificato “preferibile” grazie alla possibilità di recuperarlo facilmente e riutilizzarlo, in un’ottica di riduzione dei rifiuti (Tabella 5).
Tabella 5. Confronto tra le indicazioni di rischio e le proprietà fisiche dei tre solventi utilizzati nelle estrazioni
|
SOSTANZA |
PITTOGRAMMI |
FRASI H |
PROPRIETÀ FISICHE |
|
|
DIETIL ETERE |
|
|
H224 Liquido e vapori altamente infiammabili. H302 Nocivo se ingerito. H336 Può provocare sonnolenza o vertigini. |
PUNTO DI EBOLLIZIONE A 1 ATM 34,6 °C TEMPERATURA DI |
|
METIL t-BUTIL ETERE |
|
|
H225 Liquido e vapori facilmente infiammabili. H315 Provoca irritazione cutanea. |
PUNTO DI EBOLLIZIONE A 1 ATM 55,3 °C TEMPERATURA DI AUTOACCENSIONE 460 °C |
|
ACETATO DI ETILE |
|
|
H225 Liquido e vapori facilmente infiammabili. H319 Provoca grave irritazione oculare H336 Può provocare sonnolenza o vertigini |
PUNTO DI EBOLLIZIONE A 1 ATM 77 °C TEMPERATURA DI |
Saggi di insaturazione
Tra le esperienze che didatticamente seguono le due precedentemente illustrate, nell’ambito dello studio degli alcheni, vi è il saggio di insaturazione: tradizionalmente il reattivo utilizzato è una soluzione di bromo in acido acetico al 90%, mentre si impiega l’etere dietilico per sciogliere i substrati da testare.
L’alternativa green consiste in una soluzione acquosa di KMnO4 all’1% che presenta la stessa efficacia in termini di immediatezza della reazione e suo riconoscimento (scompare la colorazione viola e precipita MnO2). Anche i substrati devono essere scelti in modo appropriato: a tal proposito si possono utilizzare sostanze che provengono dalla natura come l’eugenolo, presente nell’olio essenziale estratto dai chiodi di garofano, o lo stesso acido sorbico. L’uso dello stesso substrato utilizzato in prove precedenti applica il concetto di didattica a spirale, che permette allo studente di osservare una stessa molecola da diversi punti di vista, rendendo più significativo l’apprendimento.
Tutte le esperienze sono accompagnate da due strumenti didattici fondamentali: una tabella di raccolta dati e uno schema a blocchi della sequenza delle operazioni svolte in laboratorio (Figure 2 e 3).
Entrambi questi strumenti sono un valido aiuto per gli studenti, soprattutto per quelli con disturbi specifici di apprendimento (DSA).
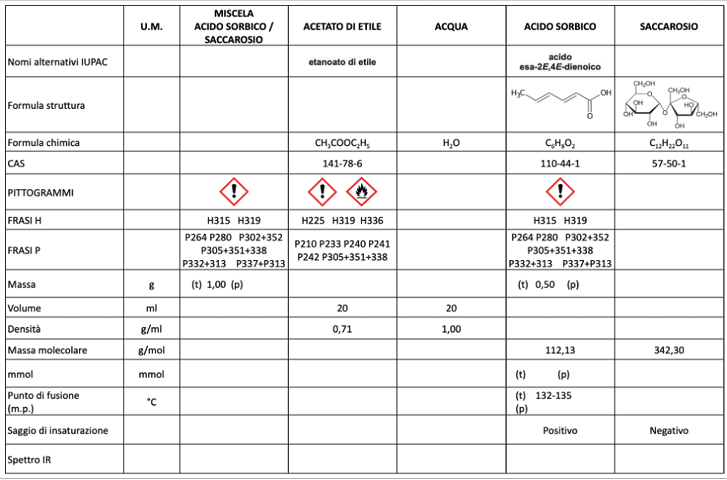
Figura 2. Tabella di raccolta dei dati dell’esperienza
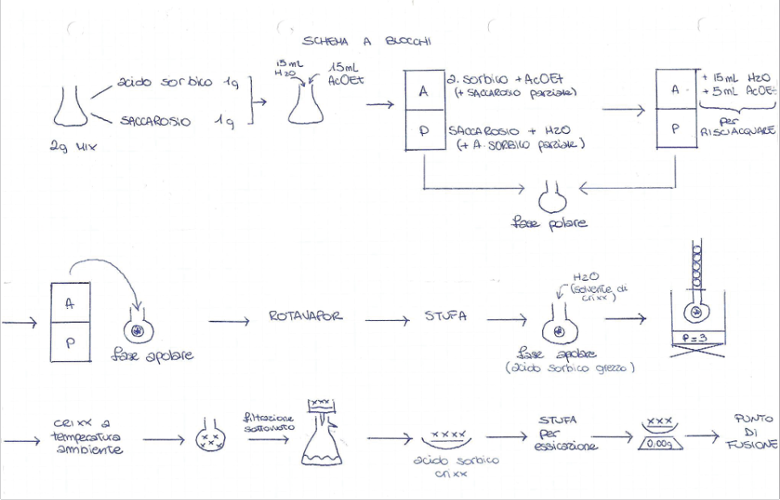
Figura 3. Schema a blocchi dell’esperienza (A. Scattolini, studentessa del terzo anno)
La tabella di raccolta dati è uno strumento essenziale per facilitare l’osservazione e la registrazione dei risultati. Essa permette agli studenti di organizzare le informazioni, visualizzare i risultati rendendo più immediata l’interpretazione delle informazioni, facilitando analisi e confronti, e riflettere sull’operato.
Lo schema a blocchi è un altro strumento molto efficace che permette la visualizzazione dei passaggi operativi e aiuta gli studenti a comprendere meglio le fasi dell’esperimento, rendendo il processo più fluido e meno soggetto a errori. In particolare per studenti con DSA, schematizzare le informazioni consente di ridurre il carico cognitivo, permettendo loro di concentrarsi su aspetti specifici e operazioni critiche. Inoltre, gli studenti possono riferirsi allo schema per ricordare i passaggi, aumentando la loro autonomia durante le attività pratiche.
L’uso di questi strumenti didattici non solo supporta l’apprendimento degli studenti con DSA, ma è un esempio di didattica inclusiva. La loro implementazione consente di personalizzare la difficoltà e il tipo di attività in base alle necessità individuali degli studenti, utilizzando tabelle e schemi diversi per diversi livelli di competenza. In attività di gruppo, gli studenti possono collaborare nella compilazione di tabelle e nella creazione di schemi, sviluppando competenze sociali e di team working.
Ogni esperienza si conclude con un momento di verifica sommativa, mentre nel corso della stessa è possibile utilizzare griglie di osservazione per ottenere anche una valutazione formativa. Le tipologie di verifica sommativa proposte, che possono essere complementari, sono due.
1) Test strutturato attraverso Moduli Google. Viene somministrato al termine dell’esperienza, presenta domande sui principi teorici, sul protocollo sperimentale, nonché anche sulla compilazione del quaderno di laboratorio, requisito fondamentale soprattutto per il percorso di PCTO. L’uso dei Moduli Google per i test offre numerosi vantaggi didattici come:
- accessibilità e facilità d’uso, perché gli studenti possono completare il test in modo flessibile, utilizzando dispositivi che già conoscono
- immediatezza dei risultati, dal momento che la correzione automatica consente agli insegnanti di fornire un feedback tempestivo;
- varietà di tipologia di domande, perché è possibile includere diverse tipologie di domande (multiple choice, vero/falso, aperte), stimolando così diversi livelli di pensiero critico e analisi.
2) Relazione in classe. La classica relazione di laboratorio, se svolta a casa, perde di affidabilità e di immediatezza, quindi si predilige prevedere la sua somministrazione durante l’orario scolastico. La relazione svolta in classe è una relazione guidata (sono presenti domande specifiche che individuano il percorso logico da seguire), che favorisce la ricostruzione del percorso laboratoriale e la riflessione critica su di esso. È divisa in diverse sezioni: 1) principi teorici, 2) sostanze utilizzate con analisi SDS, 3) procedura sperimentale, 4) raccolta dati sperimentali e calcoli, 5) risultati e conclusioni.
In conclusione, l’approccio descritto rappresenta un’opportunità fondamentale per rinnovare il laboratorio di chimica organica in modo sicuro e sostenibile. Attraverso l’integrazione dei principi della Green Chemistry, possiamo non solo ridurre l’uso di sostanze pericolose e solventi tossici, ma anche creare un ambiente di apprendimento che valorizza la salute e la sicurezza di studenti e insegnanti. Questo articolo ha dimostrato come sia possibile implementare metodologie didattiche innovative che non solo mantengano la qualità dell’insegnamento, ma promuovano anche pratiche ecocompatibili. L’adozione di approcci “green” non è solo una risposta alle esigenze di sicurezza, ma rappresenta anche un passo verso la formazione di professionisti più consapevoli e responsabili, capaci di affrontare le sfide ambientali del futuro. Investire nella sostenibilità dei laboratori scolastici è quindi un imperativo educativo che può avere ripercussioni positive non solo sul percorso formativo degli studenti, ma anche sull’intero settore della chimica. La trasformazione del laboratorio di chimica organica in uno spazio “green” è una sfida ambiziosa, ma i benefici in termini di salute, sicurezza e responsabilità ambientale giustificano pienamente questo impegno.
[1] P. T. Anastas, J. C. Warner, Green Chemistry: Theory and Practice, Oxford University Press, New York, 1998, p.30. By permission of Oxford University Press (https://www.acs.org/greenchemistry/principles/12-principles-of-green-chemistry.html)
[2] https://it.wikipedia.org/wiki/Acido_sorbico#cite_note-11
[3] https://pubs.rsc.org/is/content/getauthorversionpdf/C4GC01149J
[4] https://pubs.rsc.org/en/content/articlehtml/2008/gc/b711717e
Appendice
Procedura di laboratorio per la cristallizzazione dell’acido ascorbico
Materiali
Pallone da 100 mL
Cilindro da 50 mL
Imbuto Buchner
Beuta da vuoto da 250 mL
Refrigerante a bolle
Navicella o pesafiltri
Bilancia tecnica
Mantello riscaldante
Strumento per punto di fusione
|
REAGENTI |
CAS |
H |
QUANTITÀ |
MM (g/mol) |
Solubilità (20 °C) |
|
Acido sorbico |
110-44-1 |
|
1,00 g |
1112,13 |
1,56 g/L |
|
Acqua distillata |
50 mL |
Procedimento
1. Pesare in una navicella o in un pesafiltri 1,00 g di acido sorbico e travasare in palloncino da 100 mL.
2. Aggiungere 50 mL di acqua distillata e mescolare.
3. Collocare sul palloncino un refrigerante a bolle.
4. Riscaldare con mantello riscaldante fino a completa solubilizzazione, regolando la temperatura in modo da mantenere un riflusso costante.
5. Lasciare raffreddare a temperatura ambiente fino alla formazione dei cristalli.
6. Quando la cristallizzazione è completa, raccogliere i cristalli utilizzando la filtrazione sottovuoto con imbuto di buchner; in caso rimanga del solido nel pallone, raccogliere i cristalli utilizzando qualche mL di acque madri.
7. Lavare il solido raccolto con 5 mL di acqua distillata.
8. Mettere il filtro con i cristalli su un vetrino di orologio in stufa per far evaporare il solvente (temperatura stufa: 90-95 °C).
9. Pesare il solido secco e calcolare la resa %.
10. Misurare il punto di fusione della sostanza (p.f. teorico acido sorbico: 132-135 °C).
Smaltimento dei rifiuti
Le acque madri si possono gettare nel lavandino.
Procedura di laboratorio per l’estrazione con solvente
Materiali
Beuta da 100 mL
Imbuto separatore da 100 mL
Imbuto di vetro
Palloncino da 100 mL
Bilancia
Agitatore magnetico
Strumento per punto di fusione
Rotavapor
|
REAGENTI |
CAS |
Pittogrammi |
QUANTITÀ |
MM (g/mol) |
Densità (g/mL) |
|
|
Saccarosio |
57-50-1 |
-- |
Miscuglio 1:1 |
342,30 |
||
|
Acido sorbico |
110-44-1 |
-- |
112,13 |
|||
|
MTBE o AcOEt |
60-29-7 |
|
|
20mL |
0,71 |
|
|
Acqua distillata |
-- |
20 mL |
18,00 |
1,00 |
||
|
Sodio solfato anidro |
7757-82-6 |
-- |
q.b. |
142,04 |
||
Procedimento
1. Pesare 1,00 g di miscuglio saccarosio/acido sorbico e trasferirlo in una beuta da 100 mL.
2. Aggiungere 20 mL di acqua distillata e 20 mL di MTBE o AcOEt (sotto cappa).
3. Solubilizzare a freddo mediante agitazione magnetica.
4. Trasferire, dopo aver rimosso il magnete, in imbuto separatore; agitare e sfiatare.
5. Lasciare riposare e spillare la fase acquosa sottostante in un becher.
6. Travasare la fase organica in una beuta perfettamente asciutta facendola uscire dal collo dell’imbuto.
7. Aggiungere alla fase organica nella beuta sodio solfato anidro.
8. Filtrare su cotone e raccogliere il filtrato in pallone (preventivamente pesato) da 100 mL.
9. Evaporare il MTBE (tirare a secco) con rotavapor.
10. Misurare la massa del palloncino tirato a secco e ricavare la massa di acido sorbico.
11. Misurare il punto di fusione.
12. Eventualmente cristallizzare come descritto nel primo esempio di attività pratica.
Smaltimento dei rifiuti
Fase acquosa: reflui organici acquosi.
1 H315 Provoca irritazione cutanea, H319 Provoca grave irritazione oculare, H336 Può provocare sonnolenza o vertigini, H351 Sospettato di provocare il cancro, H420 Nuoce alla salute pubblica e all’ambiente distruggendo l’ozono dello strato superiore dell’atmosfera.