Colorimetria e cinetica di soluzioni di solfato di rame
Laura Fortunato e Ilaria Turturiello
IISS Cezzi De Castro Moro, Maglie (Lecce)
e-mail: laura.fortunato@outlook.com
Con la collaborazione degli alunni della II A dell’indirizzo Costruzione, Ambiente e Territorio (CAT): E. V. Blasi, B. Colizzi, M. Corvaglia, G. A. D’Aquino, G. P. De Santis, G. De Vito, C. Fachechi, A. Fanciullo, F. P. Giannetta, L.M. Leanza, A. Muscatello, A. L. Placido, J. P. Santese, A. P. Toma, N. Vizzino, A. Zaminga
Indice
3. Analisi dei dati e risultati
Abstract. Can the variation in the concentration of a CuSO4 solution be measured either as a change in absorbance or as a change in the color of the solution? Additionally, is measuring the temperature change during an exothermic reaction a good approach to study the kinetics of a reaction as the concentration of a reactant varies? These are the two research questions that emerged during laboratory activities with the students of class II A (CAT) at the IISS Cezzi De Castro Moro in Maglie (Lecce), which led to the scientific investigation presented in this work.
Keywords: didattica laboratoriale; colorimetria; cinetica; effetto della temperatura
Quando la didattica laboratoriale arricchisce il metodo del learning by doing, ovvero l’apprendimento attraverso il fare, con attività prettamente rispondenti alle domande degli studenti, allora si crea un processo di apprendimento partecipativo ancora più incentrato sullo studente.
Il lavoro proposto in questo articolo è una risposta a quelle che sono state le riflessioni e le domande degli studenti della II A dell’indirizzo Costruzione, Ambiente e Territorio (CAT) dell’Istituto Cezzi De Castro Moro di Maglie (LE), durante le lezioni teoriche sull’assorbanza di soluzioni acquose e sulle modalità di calcolo della velocità di una reazione.
In dettaglio, tale lavoro punta a chiarire la relazione tra l’assorbanza e il colore di una soluzione e a studiare la cinetica delle reazioni chimiche attraverso l’analisi della variazione della temperatura.
Questi obiettivi sono stati raggiunti all’interno di due attività sperimentali condotte nel laboratorio scolastico, orientate a un apprendimento pratico e partecipativo.
Oltre alle competenze scientifiche e sperimentali, gli alunni hanno avuto la possibilità di acquisire competenze nell’uso di strumenti di misura avanzati (data logger, colorimetro, sensore di temperatura), nell’utilizzo di risorse tecnologiche per la ricerca (motori di ricerca accademici e strumenti di intelligenza artificiale) oltre a sviluppare competenze critiche e riflessive come la capacità di formulare ipotesi, riflettere e indagare su questioni scientifiche complesse.
La riflessione stimolo della prima sperimentazione è focalizzata sull’esistenza o meno di una relazione tra l’assorbanza di una soluzione acquosa e l’intensità del suo colore.
In letteratura, per determinare la concentrazione incognita di una soluzione, si misura sia l’assorbanza [1] che la tonalità del colore di questa soluzione [2].
Una variazione della concentrazione delle soluzioni, infatti, comporta sia una variazione del valore dell’assorbanza sia una variazione del colore di tali soluzioni. L’obiettivo di tale lavoro è capire se la variazione della concentrazione, misurata come variazione dell’assorbanza, ha lo stesso andamento della variazione della concentrazione, misurata come variazione di colore, e, inoltre, dedurre se tali misure possono essere usate indistintamente.
Per determinare la variazione di colore è stato utilizzato il metodo HSL (Hue, Saturation, Lightness), in quanto, a differenza di quello RGB, consente di distinguere fra le varie tonalità del colore e, secondo quanto riportato in alcuni lavori [3], può sostituire il concetto di assorbanza in determinati intervalli di concentrazione delle soluzioni (non troppo diluite, né concentrate).
Le soluzioni acquose usate nella sperimentazione contengono, come soluto, il solfato di rame (o solfato rameico, CuSO4) che è un composto chimico molto solubile in acqua capace di dare soluzioni con una marcata colorazione blu. Questa proprietà lo rende particolarmente adatto in esperimenti chimici in cui è utile la variazione della tonalità di colore.
La seconda domanda di ricerca è scaturita durante lo studio dei fattori che influenzano la cinetica di una reazione chimica. L’obiettivo della sperimentazione è verificare se la misurazione della variazione di temperatura durante una reazione esotermica è un buon approccio per studiare la cinetica di una reazione al variare della concentrazione di un reagente.
Anche per questa seconda sperimentazione, la reazione chimica studiata ha coinvolto il solfato di rame (CuSO4), che in soluzione acquosa libera ioni rame (Cu2+) e ioni solfato (SO42–). Come secondo reagente è stato usato l’alluminio (Al).
La reazione può essere rappresentata come segue:
3CuSO4 + 2Al → 3Cu + Al2(SO4)3 + calore
La reazione comporta l’ossidazione dell’alluminio e la riduzione dello ione rame (Cu2+) con rilascio di calore. L’alluminio metallico, infatti, appena immerso in una soluzione di CuSO4, passa in soluzione come ione alluminio (Al³⁺). Nel frattempo, lo ione rame (Cu²⁺), presente nella soluzione di solfato di rame, passa allo stato metallico (Cu).
La reazione procede solo con l’aggiunta di cloruro di sodio (NaCl), il sale da cucina, e il motivo consiste nel fatto che l’alluminio, quando esposto all’aria, forma naturalmente un sottile strato di ossido di alluminio (Al2O3) sulla sua superficie che lo protegge e gli impedisce di reagire con sostanze chimiche, come il solfato di rame. Quando si aggiunge il sale da cucina alla soluzione, esso si dissocia nei suoi ioni e gli ioni cloruro (Cl⁻) derivanti sono in grado di interagire con lo strato di ossido di alluminio, indebolendolo e disgregandolo. Una volta che lo strato di ossido è rimosso, l’alluminio metallico sottostante può partecipare alla reazione chimica presa in esame, che è esotermica, in quanto rilascia energia sotto forma di calore.
Per determinare la velocità di reazione si può seguire l’andamento nel tempo di una qualsiasi grandezza misurabile che varia in funzione della concentrazione dei reagenti o dei prodotti, come massa, volume o variazioni di colore [4]. Essendo la reazione esotermica, si è deciso di misurare la velocità di tale reazione considerando l’andamento della temperatura nel tempo.
La velocità di una reazione chimica, inoltre, è influenzata dalla concentrazione dei reagenti.
L’obiettivo del lavoro è verificare se la misurazione della variazione di temperatura durante una reazione esotermica è un buon approccio per studiare la velocità di reazione al variare della concentrazione di un reagente.
Per la ricerca bibliografica su questo vasto argomento, oltre all’utilizzo del classico motore di ricerca Google Scholar [5], agli alunni è stato proposto l’utilizzo di strumenti di Intelligenza Artificiale come Elicit [6], al fine di effettuare una cernita degli articoli maggiormente rispondenti all’obiettivo di ricerca. Si è dedotto che gli studi selezionati, particolarmente ampi, analizzano come la variazione della temperatura nelle reazioni esotermiche interviene nella misurazione della velocità di reazione, soprattutto attraverso il calcolo della “costante cinetica”, fondamentale parametro dipendente dalla temperatura, presente nella formula della velocità di reazione [7].
La prima domanda di ricerca mira a verificare se la misurazione della variazione della concentrazione di soluzioni di CuSO4, effettuata attraverso la variazione dell’assorbanza di tali soluzioni, è correlata alla stessa misurazione effettuata attraverso la variazione dell’intensità del colore.
Quando una radiazione elettromagnetica attraversa una soluzione, alcune lunghezze d’onda vengono assorbite dalle molecole presenti nella soluzione stessa.
L’assorbanza è una grandezza che misura la capacità di una soluzione di assorbire la luce a una determinata lunghezza d’onda.
L’assorbimento di energia è quindi strettamente dipendente dalla struttura molecolare.
La legge di Beer-Lambert stabilisce che l’assorbanza (A) è proporzionale alla concentrazione (C) del soluto e alla lunghezza del percorso ottico (l):
A = ε × l × C
dove A è l’assorbanza, ε è il coefficiente di assorbimento molare (M-1cm-1) specifico per ciascun composto a una data lunghezza d’onda, l è il cammino ottico (spessore della cuvetta) e C è la concentrazione del soluto.
Nelle indagini i primi due fattori rimangono costanti in modo da verificare che il cambiamento dell’assorbanza è direttamente collegato alla concentrazione della soluzione.
Solitamente si misura l’assorbanza di soluzioni a titolo noto per determinare la concentrazione di una soluzione incognita per interpolazione, riportando i valori sperimentali su un grafico che presenta in ascissa la concentrazione di tali soluzioni e in ordinata l’assorbanza [1].
Per misurare l’assorbanza è stato utilizzato il setup sperimentale del colorimetro della Data Harvest [8].
Il colorimetro che è un dispositivo che misura l’assorbimento di una soluzione a una specifica lunghezza d’onda della luce.
In 4 matracci da 100 ml e uno da 50 ml sono state preparate delle soluzioni a concentrazione nota di CuSO4·٥H2O. La quantità di soluto da utilizzare, per raggiungere la concentrazione voluta, è stata calcolata partendo dalle concentrazioni selezionate (0,1 M - 0,15 M - 0,2 M - 0,25 M - 0,3 M), e dal volume delle varie soluzioni (corrispondente al volume dei matracci utilizzati: 100 ml e 50 ml) [9].
Dopo aver pesato la quantità di soluto necessarie (Figura 1) sono state preparate le soluzioni relative alle concentrazioni assegnate (Figura 2) e inserite nelle cuvette di misura del colorimetro.

Figura 1. Pesata del solfato di rame

Figura 2. Le soluzioni a concentrazione nota
Il setup sperimentale della Data Harvest (Figura 3), fornito dalla scuola, consta di un data logger, un colorimetro, 4 filtri, 5 cuvette in cui abbiamo versato le 5 soluzioni di solfato di rame.

Figura 3. Setup sperimentale della Data Harvest per la misurazione di assorbanza
Secondo quanto riportato sul manuale di istruzioni del colorimetro, come standard di riferimento è stata utilizzata la soluzione di CuSO4 più concentrata che, agendo sulla manopola di controllo, forniva una lettura di assorbanza pari a 0,7. In ogni misurazione è stato posizionato il filtro rosso in dotazione (scelto in quanto dava la maggiore intensità di radiazione assorbita) nella fessura anteriore del colorimetro. Inoltre, in ogni misurazione le cuvette contenenti la soluzione da analizzare sono state inserite nel colorimetro.
Per l’acquisizione e la visualizzazione dei dati è stato usato il software scientifico EasySense2 dal quale i dati sono stati esportati in formato .csv e analizzati con un foglio di calcolo Excel, al fine di ottenere il grafico dell’assorbanza in funzione della concentrazione delle soluzioni di solfato di rame.
Il colore di una soluzione dipende dalle lunghezze d’onda della luce che essa assorbe o trasmette. Ad esempio, una soluzione che assorbe principalmente lunghezze d’onda blu apparirà di colore giallo (poiché il blu è assorbito e il giallo è trasmesso).
La scala RGB (Rosso, Verde, Blu) è comunemente utilizzata per rappresentare i colori in formato digitale. Tuttavia, tale modello non è direttamente correlato alla lunghezza d’onda della radiazione in quanto rappresenta solo la quantità di ciascun colore primario (rosso, verde, blu) presente in un determinato colore.
In questo lavoro si è utilizzato il metodo HSL che permette di definire i colori in base alla loro tonalità (colore), saturazione (intensità) e luminosità (luminosità).
La tonalità (Hue) indica il colore specifico sulla ruota dei colori (ad esempio, rosso, verde, blu); è un valore in gradi sulla ruota dei colori da 0 a 360. Ad esempio, 0 (o 360) corrisponde al rosso, 120 al verde e 240 al blu.
La saturazione (Saturation) misura l’intensità del colore. Valori più alti indicano colori più vividi, mentre valori più bassi si avvicinano al grigio; è un valore percentuale da 0% a 100%: 100% rappresenta il colore pieno, senza sfumature di grigio, 0% è completamente grigio e, quindi, non si vede più il colore.
La luminosità (Lightness) rappresenta la luminosità del colore. Valori più alti sono più chiari, mentre valori più bassi sono più scuri quindi 0% corrisponde a un’assenza di luce (scuro), 50% significa che la quantità di luce presente è la metà di quella completa (né scuro né chiaro) e 100% corrisponde alla presenza di luce completa.
L’HSL, quindi, è un modello di colore che tiene conto della tonalità del colore. Quando la concentrazione di una sostanza colorata aumenta, la tonalità del colore cambia.
Utilizzando le stesse 5 soluzioni di solfato di rame pentaidrato usate per la misura dell’assorbanza, si è proceduto alla misurazione dell’HSL attraverso l’utilizzo dell’applicazione “Colorassist” installata sullo smartphone.
Secondo le indicazioni della brochure “Smartphones in Science Teaching” [3], ogni matraccio è stato posizionato su un foglio di carta bianca a 14 cm dalla posizione in cui è stato fissato lo smartphone. Un altro foglio di carta bianca, posizionato a 4 cm di distanza dal matraccio, ha costituito lo sfondo della sperimentazione.
La telecamera dello smartphone è stata puntata sulla parte più larga del matraccio (Figura 4). Per ogni matraccio è stato annotato il valore HSL che è stato riportato su un foglio di calcolo Excel in funzione della concentrazione molare delle soluzioni analizzate.

Figura 4. Misura del colore delle soluzioni di solfato di rame con il metodo HSL
La seconda domanda di ricerca studia la cinetica di una reazione esotermica misurandone la temperatura e verificando l’influenza della concentrazione dei reagenti sulla velocità di reazione.
La velocità di una reazione è la variazione della concentrazione molare dei reagenti, ∆[R], o dei prodotti, ∆[P], nell’intervallo di tempo ∆t:
La reazione considerata è esotermica, in quanto rilascia calore sotto forma di energia termica. Tale energia viene prodotta durante la formazione dei prodotti in seguito alla rottura dei legami nei reagenti e la formazione di nuovi legami nei prodotti. Quindi, per misurare la velocità di reazione, invece di considerare la variazione della concentrazione molare dei reagenti o dei prodotti, si è deciso di considerare la variazione di temperatura di tale reazione nel tempo.
La velocità di una reazione chimica è, inoltre, influenzata dalla concentrazione dei reagenti. Se la concentrazione di un reagente aumenta, la probabilità di collisioni efficaci tra le molecole di reagente aumenta, e, di conseguenza, la velocità della reazione aumenta. Si è, quindi, voluto constatare la variazione di temperatura di tale reazione anche al variare della concentrazione inziale di un reagente.
Per misurare la variazione di temperatura durante la reazione chimica è stato utilizzato il sensore di temperatura della Data Harvest [10].
Sono state preparate delle soluzioni di solfato di rame a diverse concentrazioni (0,1 M, 0,2 M, 0,3 M, 0,4 M, 0,6 M e 0,8 M) e una soluzione di cloruro di sodio 3 M.
Sono stati ritagliati dei fogli di alluminio di dimensioni 10 cm × 10 cm che sono stati ripiegati più volte al fine di poterli inserire nei becher contenenti le soluzioni.
Partendo dalla soluzione a concentrazione minore di CuSO4, si è versata la soluzione di cloruro di sodio nel becher ed è stato inserito il sensore di temperatura. Appena l’alluminio metallico è stato immerso nella soluzione risultante si è partiti con l’effettuare la misura della temperatura durante tutto il corso della reazione (Figura 5).
Quando l’alluminio reagisce con il solfato di rame si osserva, infatti, un aumento di temperatura dovuto al rilascio di calore durante la reazione esotermica [11]. Durante il corso della reazione, come si evince dalla figura 6, la soluzione, inizialmente dal colore azzurro, si è fatta sempre più scura a mano a mano che l’alluminio è passato in soluzione e il rame è diventato metallico, depositandosi sotto forma di grumi sul fondo del becher.

Figura 5. Setup sperimentale della Data Harvest per la misurazione di temperatura: una soluzione di CuSO4, una soluzione di NaCl e un foglietto di alluminio

Figura 6. Vari step della reazione
Tale procedura è stata ripetuta per tutte le soluzioni di solfato di rame a diversa concentrazione.
Sulla base dei calcoli stechiometrici effettuati, usando la soluzione di solfato di rame 0,6 M, la reazione avviene alla quantità stechiometrica.
Usando il software scientifico EasySense2, i dati sono stati esportati in formato .csv e analizzati con un foglio di calcolo Excel, al fine di ottenere il grafico che riporta la variazione di temperatura durante il corso della reazione in funzione del tempo. Tale grafico è stato ottenuto per ogni soluzione di solfato di rame analizzata.
3. Analisi dei dati e risultati
La misurazione dell’assorbanza, seguendo la legge di Lambert-Beer, ha portato a un grafico di assorbanza in funzione della concentrazione di solfato di rame con andamento lineare crescente (Figura 7a). Infatti, aumentando la concentrazione di una sostanza colorata in una soluzione, l’assorbanza aumenta. Questo perché più molecole assorbenti sono presenti, più luce verrà assorbita.
Anche la misurazione del valore HSL delle soluzioni presenti in ogni matraccio, in funzione della concentrazione molare delle soluzioni analizzate ha riportato un andamento lineare crescente (Figura 7b). Una soluzione di solfato di rame ha infatti una tonalità di colore blu. Aumentando la concentrazione di una soluzione la tonalità si sposta verso tonalità più intense di blu.
Come espresso precedentemente, una variazione della concentrazione delle soluzioni, infatti, comporta sia una variazione del valore dell’assorbanza sia una variazione del colore di tali soluzioni. Dai grafici ottenuti la variazione della concentrazione misurata come variazione dell’assorbanza ha lo stesso andamento della variazione della concentrazione misurata come variazione di colore. I coefficienti angolari delle due rette risultano, però, diversi.
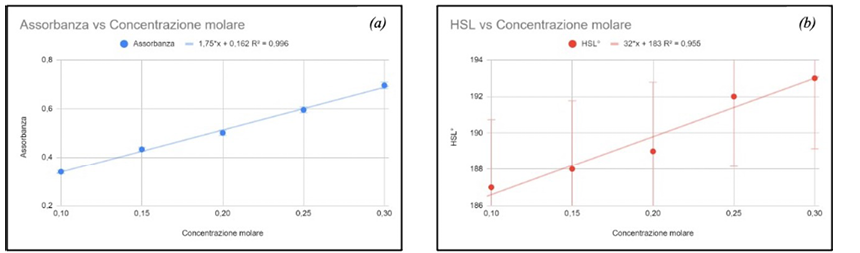
Figura 7. Grafico dell’assorbanza (a) e del valore HSL (b) in funzione della concentrazione molare delle soluzioni di solfato di rame
Per quanto riguarda i dati raccolti durante la reazione esotermica della seconda sperimentazione, al fine di ricavare la velocità di tale reazione, si sono riportati i valori della temperatura rispetto al tempo per ognuna delle soluzioni a diversa concentrazione (Figura 8). Ad ogni concentrazione corrisponde una curva di un determinato colore.
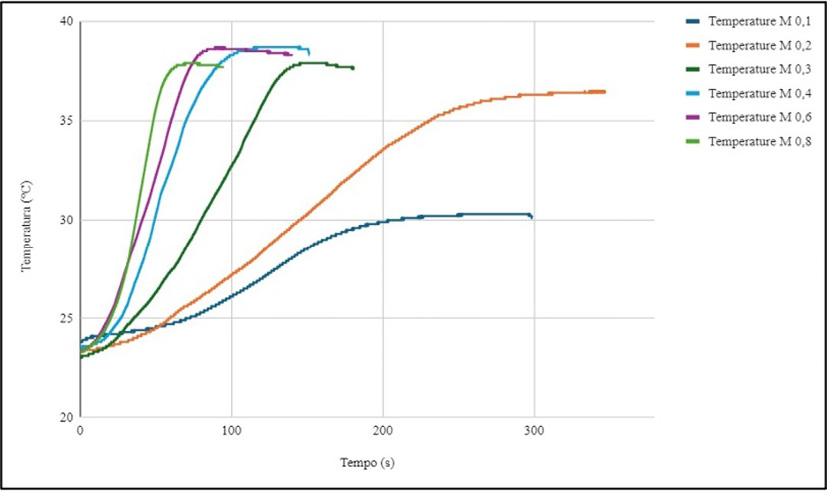
Figura 8. Grafico della temperatura in funzione del tempo per ognuna delle soluzioni a diversa concentrazione
Negli istanti iniziali della reazione, l’aumento di temperatura è minimo, ma, con il passare del tempo, la temperatura aumenta fino ad arrivare ad un valore massimo. Tale valore è la temperatura finale dei prodotti che indichiamo come Tmax. Successivamente si nota una situazione di stabilità, a volte seguita da un graduale abbassamento di tale temperatura.
Ipotizzando di calcolare la velocità di reazione misurando la pendenza delle curve di figura 8 attraverso la funzione “pendenza” di Excel, si ottiene il grafico di figura 9(a) in cui si evidenzia una relazione tra concentrazione delle soluzioni di solfato di rame e velocità della reazione. Maggiore è la concentrazione del reagente CuSO4, maggiore è la velocità della reazione.
Nel grafico di figura 9(b) si riportano i valori della temperatura Tmax in funzione della concentrazione molare delle soluzioni di solfato di rame: la Tmax aumenta all’aumentare della concentrazione del reagente fino al raggiungimento di un valore massimo corrispondente alla quantità stechiometrica (0,6 M). Oltre tale valore, la temperatura finale dei prodotti diminuisce.
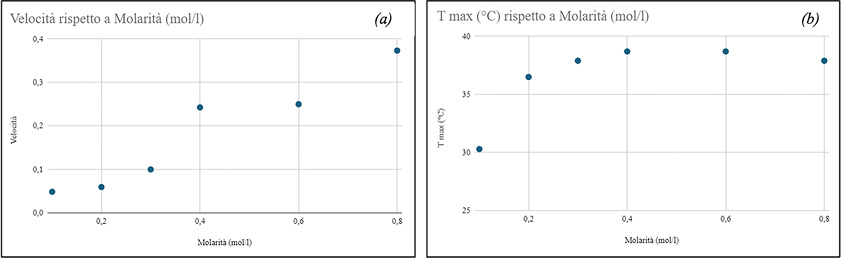
Figura 9. Grafico della velocità (a) e del valore di Tmax (b) in funzione della concentrazione molare delle soluzioni di solfato di rame
La prima sperimentazione è servita a capire se la variazione della concentrazione misurata come variazione dell’assorbanza ha lo stesso andamento della variazione della concentrazione misurata come variazione di colore, e, inoltre, a dedurre se tali misure possono essere usate indistintamente.
Analizzando i risultati della prima sperimentazione, l’assorbanza di soluzioni di solfato di rame a diverse concentrazioni presenta un grafico con andamento lineare. Anche la variazione della tonalità del colore in funzione della concentrazione delle soluzioni segue un andamento lineare. Tuttavia, i coefficienti angolari delle due rette sono diversi. Si potrebbe dedurre che le due misure non sono interscambiabili.
Dai valori di assorbanza e tonalità di colore ottenuti, si deduce, infatti, che la variazione di assorbanza, dal punto di vista procedurale più complessa da attuare, fornisce dati quantitativi precisi, mentre la misura della variazione della tonalità del colore, tecnicamente più semplice da realizzare, può essere utilizzata solo per una stima qualitativa della concentrazione. In sintesi, entrambe le tecniche sono valide per ricavare informazioni sulla concentrazione di soluzioni a concentrazione incognita, ma, da quando dedotto, la scelta deve dipendere dalle esigenze specifiche dell’analisi e dalla precisione richiesta. È importante aggiungere che, per misurare l’intensità di una soluzione con maggiore precisione, sarebbe stato necessario utilizzare altri strumenti specifici, come ad esempio uno spettrofotometro [12].
L’obiettivo della seconda sperimentazione è stato, invece, quello di verificare se la misurazione della variazione di temperatura durante una reazione esotermica è un buon approccio per studiare la cinetica di una reazione al variare della concentrazione di un reagente.
Per quanto riguarda i principali risultati dedotti dallo studio effettuato, la misura dell’inclinazione delle curve relative alla variazione di temperatura della reazione in funzione del tempo è una buona stima della velocità di reazione. Tale inclinazione aumenta all’aumentare della concentrazione di solfato di rame. Se ne deduce che la velocità di reazione aumenta con l’aumento della concentrazione del solfato di rame. A concentrazioni più elevate di solfato di rame, infatti, la reazione procede più rapidamente, portando a un aumento più rapido della temperatura. A concentrazioni più basse, la reazione procede più lentamente, con un aumento di temperatura più graduale.
Si può osservare anche che, all’aumentare del valore della concentrazione delle soluzioni fino al valore 0,6 M, valore a cui la reazione avviene alla quantità stechiometrica, si ottiene un crescente valore della Tmax.
Maggiore è la concentrazione del reagente CuSO4, maggiore è il calore rilasciato dalla reazione e, di conseguenza, maggiore è la temperatura finale dei prodotti.
In corrispondenza della soluzione a concentrazione maggiore, 0,8 M, valore in cui la quantità di reagente CuSO4 è superiore alla quantità stechiometrica, la temperatura finale dei prodotti diminuisce.
La diminuzione della Tmax è probabilmente dovuta al fatto che, essendo più elevata la velocità della reazione, anche il processo di conversione dei reagenti nei prodotti si velocizza e l’energia termica rilasciata dalla reazione viene distribuita più rapidamente nell’ambiente circostante, comportando un abbassamento della temperatura finale dei prodotti.
Da questa seconda sperimentazione, misurando la variazione di temperatura al variare della concentrazione di solfato di rame, sono state ottenute informazioni preziose sulla cinetica di una reazione esotermica.
[1] J. Doe, S. Smith, Using absorbance to determine the concentration of CuSO4, Simple Lab-Report, Anoka- Ramsey Community College, 2013 (https://www.yumpu.com/en/document/view/50518471/sample-lab-report-anoka-ramsey-community-college).
[2] https://ls-osa.uniroma3.it/esperimenti/scienze/s3/ (ultimo accesso, 1 ottobre 2014).
[3] https://www.science-on-stage.eu/sites/default/files/material/smartphones_in_science_teaching.pdf (ultimo accesso, 1 ottobre 2014).
[4] G. Valitutti, M. Falasca, P. Amadio, Chimica: molecole in movimento. Volume unico., Zanichelli, Bologna, 2022.
[5] https://scholar.google.com/ (ultimo accesso, 1 ottobre 2014).
[6] https://elicit.com/ (ultimo accesso, 1 ottobre 2014).
[7] https://www.chimica-online.it/download/legge-cinetica.htm (ultimo accesso, 1 ottobre 2014).
[8] https://store.data-harvest.co.uk/colorimeter-sensor (ultimo accesso, 1 ottobre 2014).
[9] https://ls-osa.uniroma3.it/esperimenti/scienze/s3/ (ultimo accesso, 1 ottobre 2014).
[10] https://store.data-harvest.co.uk/smartq-temperature-sensor (ultimo accesso, 1 ottobre 2014).
[11] http://www.madscientist.altervista.org/chimica/esperimenti/scaldcu/alcu.htm (ultimo accesso, 1 ottobre 2014).
[12] https://farelaboratorio.accademiadellescienze.it/esperimenti/scienze/54 (ultimo accesso, 1 ottobre 2014).