Indice
1. Introduzione all’unità didattica
2. Focus sugli esperimenti: l’acqua è speciale
3. Focus sulle teorie atomiche: com’è fatta l’acqua?
Abstract. This paper reports an interdisciplinary teaching unit design for a 4th grade of a primary school and tested in the outskirt of Bologna aimed to investigate three of the properties of water (surface tension, capillarity, and solvent power) by using the “hands-on, minds-on” approach of the 5Es instructional model.
The three properties of water were investigated at both macro and sub-micro level. The experiments were designed to be performed autonomously by the students; two atomic theories were explored with multimedial teaching material to deepen the peculiar behavior of water molecule.
Keywords:unità didattica; laboratorio; 5Es instructional model; cooperative learning; peer tutoring; interdisciplinarietà; proprietà dell’acqua; teoria atomica
1. Introduzione all’unità didattica
Alla scoperta dell’acqua! è un’unità didattica interdisciplinare sulle peculiarità dell’acqua, progettata a partire dalle Indicazioni Nazionali2 [1] e realizzata in modalità laboratoriale con metodologie didattiche attive (5Es instructional model, cooperative learning e peer tutoring).
L’unità didattica è trasversale alle scienze; tratta, infatti, argomenti di chimica, biologia, fisica e matematica; inoltre, esplora alcuni aspetti etici e sociali legati all’acqua, come ad esempio l’accesso all’acqua potabile e il concetto di acqua invisibile. Ha una durata di 33 ore ed è stata realizzata come progetto di tesi di laurea in Scienze della Formazione Primaria in una classe quarta dell’Istituto Comprensivo di Granarolo dell’Emilia, in provincia di Bologna.
Alla scoperta dell’acqua! si compone di cinque fasi, due valutazioni formative, ciascuna con un successivo incontro di recupero, e una valutazione sommativa (Figura 1).
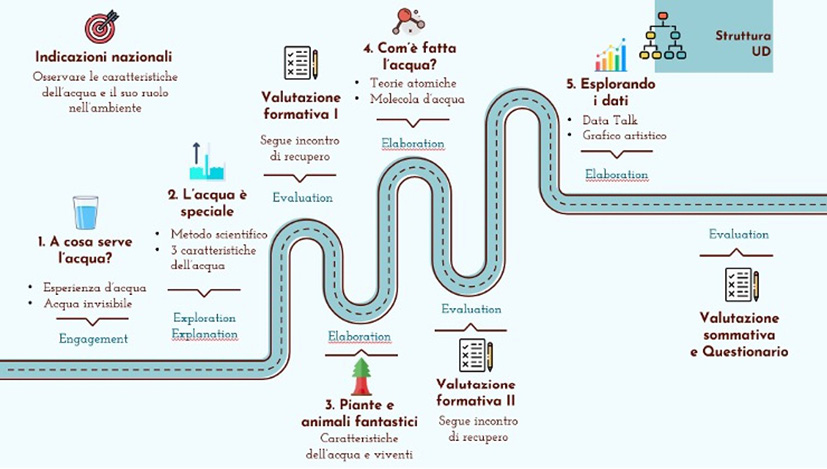
Figura 1. Struttura dell’unità didattica Alla scoperta dell’acqua!
L’attività didattica parte dal vissuto quotidiano dei bambini e delle bambine nel loro rapporto con l’acqua per ampliarne il concetto di utilizzo fino a estenderlo all’acqua invisibile [2]; successivamente i bambini e le bambine esplorano, mediante esperimenti eseguiti in autonomia con l’applicazione del metodo scientifico, l’acqua come sostanza peculiare focalizzandosi su tre delle sue caratteristiche: potere solvente, capillarità e tensione superficiale. La trattazione dei contenuti comincia da un livello “macro” (esperimenti con l’acqua con effetti visibili a occhio nudo) e si addentra in un livello “sub-micro” (teorie atomiche, comportamento dell’acqua a livello molecolare), sempre considerando l’osservazione del mondo circostante e l’importanza delle caratteristiche dell’acqua per i viventi (in particolare la sequoia, il tardigrado e i gerridi). Conclude il percorso una riflessione sull’acqua da un punto di vista sociale (utilizzo dell’acqua nei settori produttivi e accesso all’acqua potabile nei vari Paesi) e personale (il rapporto intimo di ciascun bambino e bambina con l’acqua) grazie a un Data Talk [3] e alla realizzazione di un “grafico artistico” [4], basato sull’utilizzo dell’acqua durante una intera giornata.
L’unità didattica è stata sviluppata attraverso le 5 fasi del 5Es instructional model (Engagement, Exploration, Explanation, Elaboration, Evaluation), con una differenza rispetto al modello classico: sono state inserite due valutazioni formative seguite da due incontri di recupero prima della valutazione sommativa, in accordo con la metodologia del Mastery learning di Bloom [5].
2. Focus sugli esperimenti: l’acqua è speciale
2.1 La classe come comunità scientifica
La classe è stata trasformata in una comunità scientifica, così come previsto dall’approccio dell’Inquiry-based Science Education in cui si situa il metodo del 5Es instructional model [6]. Posti a semicerchio davanti alla LIM, i bambini e le bambine hanno guardato cinque brevi video3 che narravano le biografie e le scoperte di cinque tra chimici e chimiche: Antoine-Laurent de Lavoisier; Dmitrij Ivanovič Mendeleev; Marie Skłodowska Curie; Rosalind Franklin e Raychelle Burks.
Dopo ogni visione venivano poste molte domande: Lavoisier è vivo? Come è morto? Perché hanno rubato la foto di Rosalind? Chi l’ha rubata? Cosa succede se si rompe il DNA? Perché il marito di Marie Curie è morto? Perché Marie non ha fatto il brevetto?
Solitamente nella scuola primaria le scienze si studiano a prescindere dalla storia di chi ha contribuito a svilupparle, a parte, forse, nominare alcuni personaggi ritenuti geniali (Pitagora, Galileo, Einstein e pochi altri); non è prassi diffusa trattare una storia della scienza collegandola a scoperte e invenzioni; quindi, spesso la scienza appare come monolitica, soggetta a giustapposizioni sempre migliorative e non a cambiamenti di paradigma, errori, fallimenti, ricerche ancora in corso cominciate centinaia di anni prima, collaborazioni tra scienziati [7]. Conoscere, seppur sommariamente, le biografie degli scienziati è un passo verso la contestualizzazione delle scienze in un flusso storico; inoltre, genera un interesse e una curiosità che spingono a voler saperne di più.
I gruppi erano composti da quattro persone per favorire una migliore riuscita del lavoro e ogni partecipante era dotato di uno speciale “pass scienziato”, cioè un’immagine plastificata corredata di nastro colorato in modo da poterla indossare come una collana. L’immagine recava anche le date di nascita e di morte in modo da poter situare lo scienziato o scienziata nel tempo. Inoltre, applicando la metodologia del cooperative learning [8], ogni membro del gruppo ricopriva uno specifico ruolo per contribuire al raggiungimento dell’obiettivo. I ruoli erano assegnati casualmente tramite delle carte appositamente preparate4 e, nel corso delle attività, i ruoli sono stati ricoperti a turno da ciascun bambino o bambina, così che tutti hanno avuto la possibilità di sperimentare tutti i ruoli (Figura 2).

Figura 2. Un esempio di “pass scientifico” e una carta dei ruoli
2.2 L’aula come laboratorio di chimica
L’aula si è trasformata in un laboratorio: i banchi sono stati disposti a isole per formare cinque “Stazioni sperimentali”, dotate di tutto il necessario affinché i gruppi potessero svolgere gli esperimenti in completa autonomia (Figura 3).

Figura 3. Una Stazione sperimentale
Ciascuna Stazione sperimentale conteneva:
- un Vademecum per spiegare cosa sono le stazioni sperimentali e come utilizzarle e per descrivere i compiti dei vari ruoli dei membri del gruppo (Sperimentatore, Osservatore, Esperto, Mediatore);
- le istruzioni per realizzare gli esperimenti;
- il materiale per effettuare gli esperimenti, diverso in ciascuna Stazione;
- le Schede di osservazione, ovvero gli strumenti cartacei per raccogliere dati e formulare ipotesi;
- 1 timer per rendere il tempo “visibile” e facilitare così il rispetto dei tempi da parte del gruppo.
Ciascun gruppo ha avuto 30 minuti di tempo per eseguire l’esperimento in ciascuna Stazione, osservare il fenomeno e formulare una ipotesi che spiegasse il fenomeno osservato. Dopo l’utilizzo, la Stazione veniva lasciata pulita e ordinata per il gruppo successivo.
Gli esperimenti contenuti nelle Stazioni riguardavano tre peculiarità dell’acqua (tensione superficiale, capillarità e potere solvente), ma questi concetti non erano stati in alcun modo introdotti alla classe: era stato semplicemente accennato che l’acqua possiede delle caratteristiche speciali da scoprire tramite il metodo sperimentale. Come accade in una ricerca scientifica, gli scienziati e le scienziate non avevano le risposte alle proprie domande, così hanno raccolto dati, discusso, modificato le variabili degli esperimenti, quando necessario, e condiviso le proprie idee con la Comunità scientifica per trovare una teoria. I gruppi sono riusciti a svolgere questo percorso di ricerca con grande autonomia perché guidati dai materiali didattici preparati appositamente. La presenza dell’insegnante non serviva a dare risposte ma, come una sorta di “enzima”, facilitava lo sviluppo della ricerca attraverso domande e osservazioni.
Di seguito una breve descrizione degli esperimenti di ciascuna Stazione sperimentale, corredate delle immagini dei gruppi al lavoro.
- Stazione 1: potere solvente. I bambini e le bambine avevano a disposizione varie sostanze da sciogliere in acqua per poi annotare le loro osservazioni in una griglia dettagliata in modo funzionale alla formulazione di un’ipotesi5 (Figura 4).

Figura 4. Potere solvente: i bambini e le bambine mescolano
le sostanze all’acqua e annotano i risultati
- Stazione 2: tensione superficiale. I bambini e le bambine hanno contato quante gocce d’acqua si potevano mettere su di una moneta da 5 centesimi di euro prima che l’acqua debordasse e, poi, hanno formulato un’ipotesi che spiegasse il fenomeno6 (Figura 5).

Figura 5. Tensione superficiale: i bambini e le bambine
contano quante goccioline d’acqua riescono a mettere su di una moneta
- Stazione 3: tensione superficiale. I bambini e le bambine hanno messo dell’acqua in un piattino, poi hanno spolverato del pepe sulla superficie dell’acqua annotando le osservazioni. In seguito, hanno intinto la punta di un bastoncino nel sapone per piatti e lo hanno appoggiato delicatamente sulla superficie dell’acqua. Dopo aver osservato e annotato ciò che era accaduto, hanno cercato una spiegazione (Figura 6).

Figura 6. Tensione superficiale: i bambini e le bambine osservano
cosa succede immergendo un bastoncino intinto nel sapone
in una ciotola con acqua spolverata di pepe
- Stazione 4: capillarità. I bambini e le bambine hanno realizzato un fiore di carta che si apre una volta appoggiato sulla superficie dell’acqua. Osservandolo, hanno formulato un’ipotesi per rispondere alla domanda: perché il fiore si apre? (Figura 7).

Figura 7. Capillarità: i bambini e le bambine preparano
un fiore di carta che si apre a contatto con l’acqua
- Stazione 5: capillarità. I bambini e le bambine hanno trasferito dell’acqua colorata da un bicchiere a un altro con un ponte di carta assorbente e poi hanno formulato un’ipotesi per spiegare perché ciò succede (Figura 8).

Figura 8. Capillarità: i bambini e le bambine preparano un ponte di carta
assorbente per trasferire l’acqua colorata da un bicchiere all’altro
2.3 Esperimenti di verifica e condivisione nella comunità scientifica
Dopo l’incontro in cui i gruppi hanno realizzato gli esperimenti, sono state analizzate tutte le ipotesi formulate dei vari gruppi (ciascuna Stazione aveva cinque ipotesi, una per gruppo): poiché alcune di queste avevano dei fattori in comune, è stata preparata una presentazione power point per riflettere collettivamente, notando le somiglianze e le differenze tra le varie ipotesi e ragionando su come potevano essere messe alla prova. Un esempio è l’ipotesi formulata da tre gruppi secondo la quale l’acqua rimaneva sulla moneta perché aveva dei bordi leggermente rialzati. L’esperimento è stato, allora, ripetuto utilizzando un dischetto di metallo delle stesse dimensioni della moneta, ma senza bordi. In ognuno di questi casi sono stati i bambini e le bambine o, meglio, è stata la comunità scientifica che, discutendo, ha proposto la variazione dell’esperimento necessaria a verificare le ipotesi. Non è stato introdotto il concetto di “variabile” negli esperimenti ma, in pratica, è quanto la classe è riuscita a fare: identificare le variabili da modificare per avere una conferma o una confutazione delle proprie supposizioni. Lo scopo dell’incontro era la condivisione dei risultati nella comunità scientifica per arrivare alla formulazione di un’ipotesi condivisa. In pratica, gli Esperti di ciascuna Stazione sperimentale si sono riuniti con i dati raccolti e le ipotesi formulate dai cinque gruppi e hanno discusso. Per facilitare le interazioni, i gruppi avevano a disposizione una infografica dal titolo “Come condividere le idee nella comunità scientifica”, che spiegava come procedere,7 e degli appositi fogli da compilare, denominati “Documento di condivisione dei risultati”, specifici per ciascuna Stazione sperimentale8 (Figura 9).

Figura 9. Un gruppo di Esperti condivide risultati
e ipotesi dei vari gruppi per giungere ad un’ipotesi comune
Dalle discussioni ciascun gruppo di Esperti ha formulato le seguenti ipotesi.
- Stazione 1: Alcune sostanze si sciolgono, ma altre non si sciolgono, dipende dalle sostanze che sono. Molte si sciolgono. Il fatto che una sostanza si sciolga o meno viene attribuito alle caratteristiche delle sostanze, in realtà questo dipende dall’interazione tra le sostanze e l’acqua. È stato, invece, correttamente osservato che “molte” si sciolgono, ovvero che la maggior parte delle sostanze analizzate sono solubili in acqua.
- Stazione 2: Le gocce si uniscono e la moneta ha una grandezza più elevata e perché l’acqua contiene ossigeno e fa ingrandire la goccia unendosi all’acqua. Il gruppo ha poi articolato la propria ipotesi dicendo che le gocce d’acqua possono unirsi perché la moneta è più grande di una goccia; quindi, offre una superficie sufficientemente ampia per far unire le gocce: diversamente, l’acqua deborderebbe subito, dopo la seconda goccia. Il fenomeno è spiegato dal fatto che l’acqua “contiene ossigeno”, e che questo ossigeno, in qualche modo non specificato, ingrandisce la goccia d’acqua. Ma perché? Perché, secondo il gruppo, più acqua significa più ossigeno, quindi aumentano le gocce d’acqua si aumenta l’ossigeno. Qualcuno, nel gruppo, conosceva la formula chimica dell’acqua, sapeva quindi che contiene O, ossigeno: da qui il loro ragionamento. La classe ha studiato gli stati di aggregazione della materia, sa che l’ossigeno è un gas, e che il gas si espande. Nonostante non sia ciò che accade in realtà, è interessante il fatto che il gruppo abbia ipotizzato una ragione legata alla composizione molecolare dell’acqua.
- Stazione 3: L’acqua e il detergente sono sostanze diverse e quindi fanno allontanare il pepe verso i bordi. Il fenomeno è correttamente spiegato dall’interazione tra due sostanze che sono “diverse”, in qualche modo non compatibili, e che “quindi” fanno allontanare il pepe. L’allontanamento del pepe è coerentemente visto come conseguenza dell’interazione tra le altre due sostanze.
- Stazione 4: La carta ha una consistenza diversa dall’acqua se tu metti l’alluminio non si indebolisce perché non assorbe l’acqua. Il gruppo ha considerato come “protagonista” del fenomeno “il fiore di carta”, il fatto che la carta ha una consistenza diversa dall’acqua e ha fatto riferimento all’esperimento mentale realizzato, quello del fiore di carta alluminio (che purtroppo non avevamo a disposizione in quel momento). Il gruppo ha messo a confronto la carta con l’acqua, osservando che hanno due “consistenze” diverse. Cosa sono queste “consistenze”? Il gruppo ha risposto che significa che sono fatte in modo diverso e che una assorbe l’altra. Il perché questo succeda non è stato compreso, ma il fatto dell’interazione, della relazione tra le due cose - l’acqua e la carta - è stato oggetto di riflessione: l’interazione tra acqua e carta dà l’assorbimento, mentre l’interazione tra acqua e alluminio no.
- Stazione 5: L’acqua passa da un bicchiere all’altro perché viene assorbita dalla carta. Anche questo gruppo non è riuscito a dare una motivazione del perché la carta riesca ad assorbire l’acqua. Gli esperimenti mentali fatti con una sostanza diversa al posto dell’acqua (metallo fuso e plastica fusa) sono forse troppo lontani dall’esperienza dei bambini e delle bambine e, anche osservando la carta assorbente controluce alla finestra, non hanno percepito la sua texture come dotata di spazi vuoti che l’acqua poteva riempire, probabilmente perché, in effetti, non è così chiaro osservando a occhio nudo che la carta abbia del “vuoto” dentro.
Per concludere l’incontro, partendo dalle esperienze e dalle riflessioni fatte, sono state trattate le tre caratteristiche dell’acqua nominandole, fornendo una spiegazione e vari esempi tratti dalla vita di tutti i giorni, con l’ausilio di tre presentazioni power point e quattro infografiche di riepilogo appositamente preparate. La spiegazione si è svolta in modo dialogico: la classe ha partecipato attivamente rispondendo a domande mirate e ricevendo feedback immediati. Inoltre, i bambini e le bambine erano liberi di rivolgersi domande tra di loro e di ricevere spiegazioni dai compagni.
Un’ultima considerazione: la capillarità si è dimostrata, di fatto, la caratteristica dell’acqua più complicata da capire, anche dopo la spiegazione, perché i “tubicini” lunghi e stretti in cui l’acqua può “arrampicarsi” non erano visibili nella carta utilizzata negli esperimenti. L’effetto è stato finalmente chiaro quando è stata mostrata dell’acqua colorata che risaliva dentro due tubicini di vetro: erano state mostrate delle immagini simili nella spiegazione, ma erano statiche e, quindi, i bambini e le bambine non erano riusciti a visualizzare la risalita dell’acqua. Quando l’hanno osservata dal vivo, rimanendo sorpresi dalla velocità con cui l’acqua risale, hanno capito il fenomeno della capillarità.
3. Focus sulle teorie atomiche: com’è fatta l’acqua?
3.1 Perché trattare le teorie atomiche alla Scuola primaria?
Le Indicazioni Nazionali citano l’acqua e le sue proprietà in più punti e in nessuno si parla esplicitamente di “atomi” e “molecole”, neppure negli obiettivi della scuola secondaria di primo grado. D’altra parte, le Indicazioni raramente elencano contenuti specifici, essendo disegnate sulla base delle competenze che gli alunni dovrebbero acquisire al termine della loro formazione; spetta dunque alla progettazione del Collegio docenti e alla programmazione del singolo insegnante decidere quali contenuti trattare per raggiungere gli obiettivi generali forniti delle Indicazioni, stabilendo obiettivi specifici, contenuti, metodi e strumenti didattici in linea con le Indicazioni stesse.
Per quanto riguarda questo contesto, i bambini conoscevano già termini come “atomo”, “quantico”, “molecola”, “elettrone” e anche formule di alcune molecole, come H2O e CO2. Sono, infatti, termini e concetti utilizzati in diversi ambiti e contesti quotidiani: nei notiziari (spesso riferendosi all’inquinamento e al riscaldamento globale), nell’intrattenimento, nei documentari disponibili nelle piattaforme di streaming, in contenuti disponibili su YouTube e in libri rivolti all’infanzia [9-12].
Si è anche constatato che le conoscenze che i bambini avevano dell’atomo erano frammentate e spesso inesatte e che la classe era molto incuriosita dall’argomento, facendo molte domande.9
Inoltre, come sottolineato da A.H. Johnstone con il suo celebre lavoro del 1993 [13], l’apprendimento dei concetti scientifici passa attraverso la conoscenza delle relazioni tra i tre livelli concettuali, macro, sub-micro e simbolico: la mancanza di attenzione nella collocazione di un concetto chimico all’interno di ciascuno di questi tre livelli potrebbe creare confusione nella comprensione di concetti scientifici di base. Nel caso specifico di questo contributo, si tratta di spiegare la capacità delle molecole d’acqua di formare legami a ponte idrogeno, interazione fondamentale per comprendere le sue proprietà speciali.
Tenendo in considerazione tutto questo, abbiano deciso di introdurre l’atomo in modo più dettagliato, trattando dunque le teorie atomiche, il che ha reso necessario impiegare il concetto di modello, fondamentale per la comprensione della scienza, scoprendo anche che nessun modello è perfetto e definitivo, ma perfettibile. I modelli ci permettono di spiegare i fenomeni e di fare previsioni, spesso molto accurate, ma non sono “la realtà”: questo concetto complesso e astratto, così fondamentale per l’avanzamento della conoscenza, può diventare più comprensibile se applicato a qualcosa di concreto, come appunto questo percorso di scoperta dell’acqua.10
3.2 Due modelli dell’atomo
La prima parte di questo incontro prevedeva un brainstorming volto a rendere esplicite le idee della classe rispetto alla natura dell’acqua, rispondendo alla domanda: Di cosa è fatta l’acqua? Tuttavia la classe aveva già affrontato la questione accennando agli atomi e alle molecole, per cui si è scelto di eliminare questa parte. Dopo una prima attività di “riscaldamento” in cerchio, funzionale all’attivazione del corpo e a ripercorrere quanto realizzato fino a quel momento, i bambini e le bambine si sono seduti a semicerchio davanti alla LIM in cui era proiettata una presentazione power point guida dell’incontro, dal titolo Di cosa sono fatte tutte le cose?
La presentazione power point era strutturata in modo da ripercorrere brevemente le tappe che hanno portato alla formulazione dei modelli atomici di Rutherford e Bohr. Si è deciso di presentare entrambi i modelli perché il modello di Rutherford è il più conosciuto, la sua rappresentazione grafica è riportata nei libri di testo, mentre il modello a gusci, essendo più accurato, è fondamentale per comprendere la formazione delle molecole.
In seguito, i ragazzi sono stati divisi in gruppi per la prima attività pratica: avevano a disposizione sette mattoncini LEGO® per costruire il massimo numero possibile di combinazioni in dieci minuti. Il gioco è stato vissuto come una gara ed è risultato molto divertente. Inizialmente i gruppi montavano una combinazione di mattoncini, poi la smontavano completamente e ne rimontavano una nuova, ma rapidamente hanno capito che non era necessario tutto questo lavoro: per ottenere una nuova combinazione era sufficiente spostare un mattoncino alla volta. In tal modo sono riusciti a realizzare centinaia di combinazioni diverse e a rendersi conto di quante possibilità offrono sette semplici mattoncini, che rappresentavano altrettanti atomi (Figura 10).
In seguito, è stato affrontato il concetto di “modello” e, quindi, sono stati presentati il modello di Rutherford, quello planetario, e il modello a gusci di Bohr.
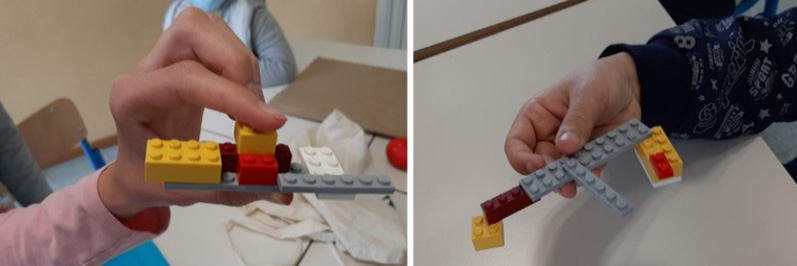
Figura 10. Due esempi delle numerose combinazioni di mattoncini LEGO® realizzate
Poiché nello studio delle scienze i modelli che descrivono un fenomeno non sono solo un passaggio di informazioni, ma sono anche il risultato di un ragionamento sul fenomeno, erano state progettate varie attività per rappresentare atomi e molecole e, quindi, per manipolare i concetti [14].
La classe si è divisa nei gruppi della comunità scientifica per rappresentare i modelli atomici utilizzando spago, tappi e colla (Figura 11).

Figura 11. Un esempio di rappresentazione dei modelli atomici con spago e tappi di bottiglia
Dopo la visione dei lavori dei gruppi, è stata posta una domanda: Secondo voi, quanto è grande un atomo? Tutti sono stati concordi nel dire che un atomo è piccolissimo, ma risultava difficile fare paragoni per esprimere quanto. Con la visione di un breve video di TedEducation dal titolo Just how small is an atom?11 e una presentazione power point, la classe ha preso familiarità con le dimensioni degli atomi.
L’incontro è proseguito con un gioco di memoria visiva: sono stati mostrati solo per pochi secondi il modello planetario e il modello a gusci; i bambini e le bambine sono stati invitati a disegnare i due modelli. Lo stesso esercizio è stato ripetuto chiedendo di rappresentare le particelle atomiche (Figura 12).
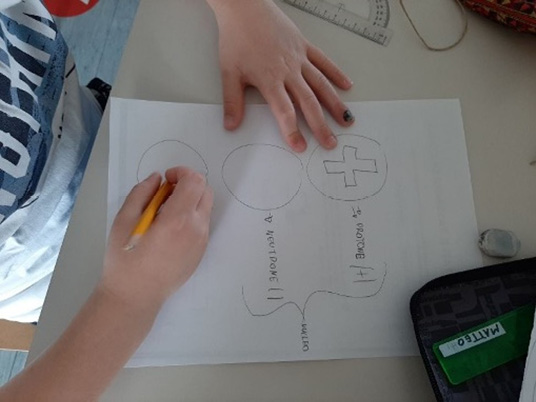
Figura 12. Un bambino rappresenta i tipi di particelle
che compongono l’atomo nel gioco di memoria
3.3 La molecola d’acqua
Nell’incontro successivo si è proseguita l’esplorazione del mondo degli atomi.
Per riprendere quanto fatto in precedenza, sono state poste una serie di domande collegate tra loro: Di cosa sono fatte tutte le cose? Che cos’è un atomo’? Si può vedere un atomo? e altre ancora.12
Ciascun gruppo hai poi avuto a disposizione della pasta di sale per realizzare i due modelli, senza disporre di un’immagine guida (Figura 13).

Figura 13. Due modelli di atomi realizzati in pasta di sale
A questo punto, per evitare che la rappresentazione del modello fosse un puro atto mnemonico, è stata fornita un’altra consegna per i lavori di gruppo: “Modellate due atomi con 1 elettrone, 1 protone e 0 neutroni per ciascun atomo”. In questo modo i bambini e le bambine hanno iniziato a manipolare la rappresentazione cogliendone la stessa essenza, e cioè che c’è un nucleo attorno al quale girano, in orbite concentriche, uno o più elettroni (in questo caso un solo elettrone).13 Non tutti i gruppi hanno realizzato correttamente gli atomi, perché qualcuno ha inserito anche il neutrone nel nucleo; è stato chiesto, allora, di rileggere la consegna e di controllare con attenzione: l’errore è stato corretto e sono stati realizzati due atomi uguali.
Era arrivato il momento di porre delle domande sugli atomi per cominciare a capire come “funzionano”, come interagiscono tra di loro: Gli atomi sono tutti uguali? Quanti sono i tipi di atomi esistenti in natura? Queste domande hanno permesso di parlare degli elementi e del fatto che tutto ciò che compone il nostro universo è dato dalla combinazione di soli 92 tipi di atomi. L’attività che coinvolgeva le combinazioni di mattoncini LEGO® dell’incontro precedente è stata molto d’aiuto per figurarsi come sia possibile che un numero che appare così esiguo possa essere sufficiente a formare un numero di combinazioni così grande da non essere concepibile.
La classe era ora pronta a considerare l’interazione tra atomi in modo più specifico: Come fanno gli atomi a unirsi? Cosa succede quando gli atomi si uniscono con un legame covalente?14 È stato, quindi, chiesto ai gruppi di realizzare un legame covalente con i loro due atomi di idrogeno in pasta di sale, utilizzando il modello atomico a gusci (Figura 14).
Avendo considerato uno dei “meccanismi” che permette agli atomi di unirsi, è stato possibile passare alla molecola d’acqua.15
Trattando la molecola, per ragioni di funzionalità, è stato cambiato il modello di riferimento, utilizzando sia quello a calotte che quello a sfere e bastoncini. La classe ha esplorato la molecola d’acqua grazie ad alcune simulazioni computerizzate:16 il vantaggio del multimediale, in questo caso, è che ha permesso di “osservare” le molecole in 3D, di capire che sono costantemente in movimento e che non hanno un sotto o un sopra.

Figura 14. Il legame covalente tra due atomi di idrogeno
Il fatto di mostrare diversi tipi di modelli è utile per evitare (o, quantomeno, correggere) “l’ostacolo didattico” postulato dalla Teoria delle situazioni didattiche di Brousseau [15]: il modo in cui scegliamo di presentare un concetto è fondamentale e, se noi lo presentiamo sempre allo stesso modo, quello che il discente può interiorizzare è solo la rappresentazione che noi gli offriamo, identificandola con il concetto stesso.
Dopo aver scoperto la molecola d’acqua e riflettuto sulle diverse rappresentazioni, i gruppi hanno costruito le proprie molecole in 3D. Ciascun gruppo aveva a disposizione un vasetto di pongo colorato e degli stuzzicadenti e, in caso desiderasse avere pongo di colori diversi, poteva proporre degli scambi agli altri gruppi (Figura 15).

Figura 15. Alcune delle molecole d’acqua realizzate
3.4 Tensione superficiale, capillarità e potere solvente a livello molecolare
L’ultimo incontro dedicato al mondo atomico e molecolare si è incentrato sulle caratteristiche dell’acqua. Il fatto di riproporre le caratteristiche dell’acqua a livello molecolare si basa sulla concezione di Jerome Bruner della conoscenza “a spirale” [16] nel curriculum di studi: inizialmente la classe ha sperimentato, descritto e spiegato alcuni comportamenti peculiari dell’acqua; ora studia nuovamente questi comportamenti a un livello più profondo, grazie alla conoscenza dei modelli atomici.
L’incontro è iniziato con un Quiz. Nonostante non ci fossero premi in palio, l’idea ha catturato l’attenzione dei gruppi: il gioco ha motivato tutti a impegnarsi e a dare il proprio meglio. L’inserimento di elementi di gamification, come il punteggio e i badge, è stato utile per far vivere in modo ludico un’attività che altrimenti non lo sarebbe stata. Le domande erano di due tipi, aperte e chiuse, e il punteggio variava a seconda del tipo di domanda.
Terminato il Quiz, i bambini e le bambine si sono seduti a semicerchio davanti alla LIM per continuare il viaggio nel mondo delle molecole. Il power point di riferimento si intitolava Come sono le molecole d’acqua nei vari stati? e mostrava un breve video17 di una simulazione del comportamento delle molecole d’acqua nei diversi stati di aggregazione.
A questo punto è stato affrontato il concetto di polarità, che si è rivelato complicato da comprendere: il concetto che una molecola d’acqua sia polare, abbia cioè un polo positivo e uno negativo, un po’ come una calamita, è fondamentale per capire come funzionano i legami a ponte idrogeno e, quindi, per capire anche le proprietà degli stati di aggregazione.
Lo stesso termine “polo” ha generato confusione, perché quasi tutti avevano in mente il polo come bioma, associandolo al freddo e al ghiaccio, e non alle due zone opposte di un qualcosa, nel nostro caso di una calamita, o di una molecola.
Il problema di comprensione è stato chiaro quando è stato richiesto ai gruppi di realizzare dei legami a ponte idrogeno con della carta alluminio tra le molecole in pongo: nessun gruppo ha realizzato correttamente la consegna. La “tendenza” più diffusa è stata quella di collegare tra loro la parte della molecola corrispondente all’atomo di ossigeno, probabilmente perché più grande degli atomi di idrogeno.
È stato, allora, mostrato nuovamente alla classe il video delle molecole d’acqua nei tre stati di aggregazione, dicendo di fare molta attenzione ai legami a ponte idrogeno, fermando anche il video quando necessario. Inoltre, sono state riviste le slide di spiegazione della polarità della molecola d’acqua e le slide in cui erano rappresentate varie molecole d’acqua legate tra loro da legami a ponte idrogeno. In tal modo, i gruppi sono stati in grado di modificare quanto avevano realizzato, posizionando correttamente i legami (Figura 16).18

Figura 16. Molecole d’acqua unite da legami a ponte idrogeno
in modo scorretto (a sinistra) e in modo corretto (a destra)
Una volta studiati i legami a ponte idrogeno è stato possibile chiudere il cerchio tornando alle tre caratteristiche peculiari dell’acqua osservate negli esperimenti e che erano state spiegate senza ricorrere al piano molecolare. Come di consueto, una presentazione power point (Perché l’acqua si comporta in modo speciale?) ha aiutato a mantenere il filo del discorso e a focalizzarsi sulle informazioni e i ragionamenti essenziali.
4. Valutazione degli apprendimenti
Per la valutazione sono stati utilizzati due tipi di prove:
- la prova pratica, in cui era richiesto di svolgere esperimenti in modo completamente autonomo, senza poter chiedere all’insegnante né chiarimenti, né suggerimenti;
- la prova scritta, con diversi tipi di domande: aperte, a scelta multipla, a risposta multipla, ordinamento e vero/falso; spesso era richiesto anche di motivare la risposta, in modo da avere accesso al ragionamento che il bambino aveva usato per rispondere.
Per ciascuna prova sono stati indicati i criteri di determinazione dei punteggi.
Le domande erano formulate sulla base degli obiettivi specifici e testavano fino al livello di “analisi” così come inteso nella tassonomia di Bloom [17].
Il feedback formativo è stato fornito in un colloquio individuale personalizzato con ciascun alunno al termine dell’incontro di recupero, con inclusa la visione della prova: in questo modo era possibile verificare nell’immediato se l’incontro di recupero19 era stato efficace.
Il feedback è stato dato sia in modo visivo, con grafici a torta o a barre (in caso di confronto tra le prove) per permettere di vedere a colpo d’occhio il raggiungimento percentuale dell’obiettivo, sia in modo scritto, più analitico, per evidenziare i punti di forza e di debolezza (Figura 17).
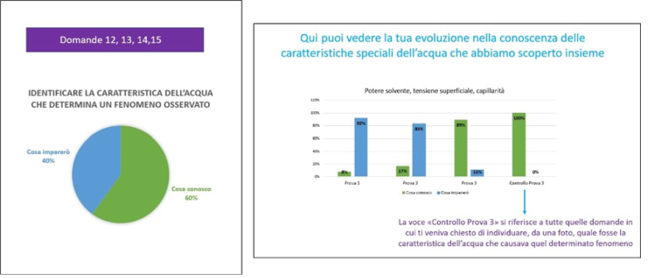
Figura 17. Un esempio di grafico a torta (a sinistra) e di grafico a barre
(a destra) usati per dare un feedback sull’apprendimento
Al termine dell’unità didattica è stato chiesto alla classe di compilare un questionario di gradimento in cui era stata inserita una domanda specifica per avere riscontro dell’utilità – o meno – dei feedback grafici: tutti i bambini e le bambine hanno risposto che i grafici permettevano di avere un feedback chiaro sulla propria performance, ad esempio: Posso osservare se sono andato bene o male. Capivo in cosa andavo meglio e dove andavo peggio. Capivo i miei errori e potevo migliorare.
La percentuale di apprendimento rilevato dalla prova sommativa è dell’81% (dati aggregati), un dato che denota un buon livello. La conoscenza della parte specifica relativa ad atomi e molecole è ancora più alta: 84%. La conoscenza delle caratteristiche dell’acqua è arrivata all’81%, ed è salita all’86% se si considera la parte “di controllo”, cioè quelle domande in cui veniva mostrata una foto chiedendo di individuare qual era la caratteristica dell’acqua che determinava il fenomeno, sempre motivando la risposta.20 Questa parte ha avuto risultati migliori rispetto alla parte più nozionistica, cioè quella in cui era richiesto di definire le tre caratteristiche studiate.
Con il questionario di gradimento, i bambini e le bambine hanno indentificato gli esperimenti come l’attività più gradita, seguita a parimerito dalle attività pratiche e dai video. Inoltre, alla voce Consigli per migliorare il laboratorio, al primo posto, a parimerito, si collocano l’aggiunta di altri esperimenti e la considerazione che il percorso “va bene così com’è”. Appare, quindi, che le attività “hands on” sono state le più gradite. Le attività “minds on”, invece, cioè le discussioni nei gruppi, non sono risultate altrettanto gradite. Ciò è comprensibile, perché gli esperimenti solitamente sono divertenti, mentre le discussioni possono essere fonte di conflitto. Ma, spesso, è proprio la divergenza di opinioni che porta avanti la discussione generando comprensione. L’attività cognitivo-relazionale impiegata nelle discussioni ha bisogno di allenamento, così come ogni altra attività, e il gruppo classe non era abituato a questa modalità, a cui ha dovuto abituarsi mentre apprendeva nuovi concetti.
A questo proposito, osservando il grafico che riporta la progressione dell’apprendimento per quanto riguarda le caratteristiche dell’acqua (l’unico argomento presente in tutte e tre le prove), si osserva come, nella seconda prova, la percentuale di conoscenze apprese superi la percentuale di conoscenze ancora da apprendere: è possibile che, a quel punto dell’unità didattica, la classe avesse già cominciato a familiarizzare con le metodologie attive utilizzate, alleggerendo quindi il carico cognitivo relazionato all’apprendimento di un diverso modo di “fare lezione” (Figura 18).
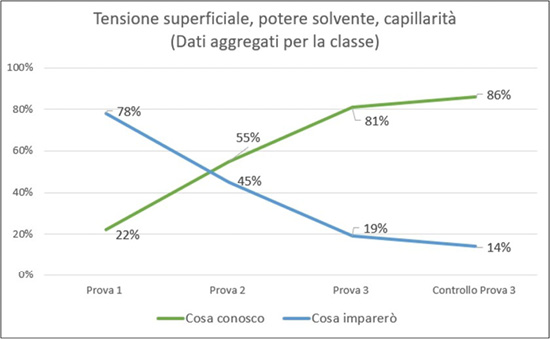
Figura 18. Grafico che traccia la progressione dell’apprendimento
delle caratteristiche dell’acqua
[1] A.A.V.V., Indicazioni nazionali per il curricolo della scuola dell’infanzia e del primo ciclo d’istruzione, Annali della pubblica istruzione, Le Monnier, Firenze, 2012, p. 68 (Osservare le caratteristiche dell’acqua e il suo ruolo nell’ambiente).
[2] https://thewaterweeat.com/
[3] https://www.youcubed.org/wp-content/uploads/2020/05/What-is-a-Data-Talk-1.pdf; https://online.stanford.edu/courses/xeduc315n-21st-century-teaching-learning-data-science
[4] https://www.dear-data.com/theproject
[5] E. Nigris, L. A. Teruggi, F. Zuccoli, Didattica generale, Pearson, Milano, 2016.
[6] M. R. Gillies, Inquiry-based Science Education, CRC Press, Ebook Edition, 2020; R. W. Bybee, The BSCS 5E instructional model: personal reflections and contemporary implications, Science and Children, 2014, 51(8), 10-13.
[7] P. R. Costa da Silva, P. R. Miranda Correia, M. E. Infante-Malachias, Charles Darwin goes to school: the role of cartoons and narrative in setting science in an historical context, Journal of Biological Education, 2009, 43(4), 175-180.
[8] D. W. Johnson, R. T. Johnson, E. J. Holubec, Cooperation in the classroom (revised), Interaction Book Company, Edina, Minnesota, 1991, pp. 1-19.
[9] S. Cerrato, La forza nell’atomo. Lise Meitner si racconta; Editoriale la Scienza, 2016.
[10] M. Barfield, La tavola degli elementi. Scopri la chimica intorno a te, Editoriale la Scienza, 2019.
[11] S. Gillingham, Esplorando gli elementi. Una guida completa alla tavola periodica, Ippocampo, 2020.
[12] L. Sciortino, La vita di un atomo raccontata da sé medesimo, Erickson, 2010.
[13] A. H. Johnstone, The development of chemistry teaching, J. Chem. Educ., 1993, 70(9), 701.
[14] M. R. Gillies, Representations, though, are more than simply transmitting information; they are integral to reasoning about the scientific phenomena, Inquiry-based Science Education, CRC Press, Ebook Edition, 2020, p. 114.
[16] J. Bruner, Verso una teoria dell’istruzione, Roma, Armando, 1982.
[17] https://cft.vanderbilt.edu/guides-sub-pages/blooms-taxonomy/
1 Laureata in Scienze della Formazione Primaria
2 Ciascuna fase di cui si compone l’unità didattica è stata costruita sulla base di obiettivi specifici relazionati all’obiettivo generale delle Indicazioni Nazionali.
3 I video sono stati prodotti utilizzando il software gratuito Da Vinci Resolve.
4 Le carte dei ruoli sono state preparate utilizzando l’app CANVA nella versione gratuita.
5 La Scheda di osservazione richiedeva di annotare, per ciascuna sostanza, se si scioglieva o meno nell’acqua e come appariva l’unione della sostanza con l’acqua. Successivamente, chiedeva di osservare la tabella nel suo complesso confrontando i dati e scrivendo le proprie osservazioni. Infine, invitava a formulare un’ipotesi per spiegare la caratteristica misteriosa dell’acqua della Stazione sperimentale. Le sostanze erano: farina, sale, olio, terra, aceto, solfato di rame.
6 La Scheda di osservazione chiedeva di stimare, prima di condurre l’esperimento, quante goccioline d’acqua fosse possibile mettere sulla moneta da 5 centesimi di euro prima che l’acqua debordasse: tutti i gruppi hanno sottostimato il numero di goccioline e si sono poi sorpresi scoprendo che era possibile mettere più goccioline di quelle che si aspettavano.
7 L’infografica riportava i passi da seguire per rendere possibile la discussione in piccolo gruppo: 1) condividete tutti i dati richiesti nel documento, annotandoli; 2) ciascuno scienziato o scienziata spiega agli altri la propria ipotesi sulla caratteristica misteriosa dell’acqua; 3) appoggiate sul banco tutti i fogli con le ipotesi; 4) raggruppate i fogli che hanno ipotesi simili; 5) discutendo, scegliete un’ipotesi, oppure formulatene una nuova basandovi su quelle presentate.
8 Per la Stazione sperimentale 1, si chiedeva di annotare in una griglia se le sostanze si scioglievano oppure no e come appariva la mescolanza di acqua e della sostanza, mettendo così a confronto in modo sinottico i dati di tutti i gruppi. Per la Stazione sperimentale 2, si chiedeva di confrontare il numero di goccioline messe sulla moneta (e questo gruppo aveva scartato l’ipotesi che fossero i bordi a contenere l’acqua, grazie all’esperimento di verifica). Per la Stazione sperimentale 3, si chiedeva di mettere a confronto, in una tabella, il movimento del pepe prima e dopo avere toccato la superficie dell’acqua con un bastoncino intinto nel detergente per piatti (e questo gruppo aveva scartato l’ipotesi che l’acqua fosse estranea al verificarsi del fenomeno grazie all’esperimento di verifica). Per la Stazione sperimentale 4, si chiedeva di mettere a confronto le osservazioni sul comportamento del fiore di carta una volta appoggiato sull’acqua. Per la Stazione sperimentale 5, si chiedeva di confrontare il trasferimento o meno di acqua da un bicchiere all’altro tramite il ponte di carta assorbente.
9 Gli elettroni sbattono l’uno contro l’altro? (Nella corrente elettrica) se tutti gli elettroni vanno da una parte, cosa ci va dall’altra? Cosa succede se un elettrone va a sbattere contro il nucleo? Quanto girano veloci gli elettroni? Dove vanno gli elettroni quando c’è l’esplosione nucleare? Come si fa una esplosione nucleare? Come si fa l’energia nucleare? Come faccio a far muovere gli elettroni? (riferito alla corrente elettrica) Come funziona la lampadina? Perché se sfrego la plastica faccio elettricità? Perché a volte prendo la scossa quando tocco la macchina? Quando si prende la scossa si muore sempre? Quando prendo la scossa, l’elettricità rimane nella mano? Se io metterei (sic) un dito in un atomo, riuscirei a toccare un elettrone? O toccherei il nucleo? Se muovo una mano nell’aria, sposto gli elettroni? Perché nell’aria c’è elettricità? Perché gli atomi fanno le radiazioni che hanno ucciso Marie Curie? Perché ci fanno morire?
10 I modelli sono strumenti di conoscenza e di studio estremamente potenti: ci consentono di comprendere concetti o situazioni, anche molto complessi, e di manipolarli per ottenere spiegazioni e per fare previsioni. Ma le rappresentazioni presentano il rischio di essere identificate con la realtà stessa. Come la mappa non è il territorio, allo stesso modo una rappresentazione di un atomo a gusci non è un atomo. Sebbene possa sembrare scontato, oppure possiamo pensare di esserne consapevoli, nella pratica commettiamo spesso l’errore di confondere le due cose, facendo coincidere la realtà con la sua rappresentazione. Ad esempio, i modelli non sono in scala, perché la distanza tra il nucleo e gli elettroni è troppo vasta per entrare in foglio o in una slide. I modelli sono statici e bidimensionali, mentre in realtà ogni parte dell’atomo si muove continuamente ed è tridimensionale nello spazio. Per cercare di veicolare il concetto la mappa non è il territorio applicato agli atomi, nei tre incontri dedicati al mondo atomico e molecolare sono state preparate alcune slide ad hoc.
11 È stata estrapolata la parte del video https://www.youtube.com/watch?v=yQP4UJhNn0I in cui si parla delle dimensioni dell’atomo, tralasciando quella in cui si tratta della densità del nucleo, ed è stato realizzato un doppiaggio in italiano in modo da non dover usare i sottotitoli a cui i bambini e le bambine non sono abituati e che avrebbe reso ancora più difficile la comprensione dei concetti trattati.
12 Ciascuna slide è animata in modo da far apparire prima solo la domanda e poi, al secondo clic, la risposta, per dare il tempo alla classe di riflettere e rispondere.
13 Alla classe è stato detto che ciascun guscio ha un numero massimo di elettroni che può “ospitare”, ma non abbiamo visto nel dettaglio quanti. La consegna richiedeva di rappresentare un solo elettrone, perché non ci fosse ambiguità sul numero di orbite.
14 Il legame covalente è stato l’unico tipo di legame affrontato durante l’unità didattica, perché funzionale alla comprensione della molecola d’acqua. Però, alla classe è stato detto che esistono altri tipi di legami, ma che non li avremmo trattati.
15 La finalità di questa parte dell’unità didattica era quella di utilizzare i modelli atomici e molecolari al fine di una maggiore e più profonda comprensione dell’acqua e delle sue particolari caratteristiche; quindi, non ci si è soffermati a studiare altri tipi di molecole.
16 Sono state utilizzate le simulazioni gratuitamente offerte dall’università del Colorado: https://phet.colorado.edu/it/
17 Il video mostrato in classe è un adattamento di un video prodotto dall’Associazione EURESIS e reso disponibile su YouTube a questo indirizzo: https://video.link/w/7gJ4d
18 L’argomento della polarità è poi stato trattato approfonditamente nell’incontro di recupero dopo la seconda valutazione formativa, anche con l’utilizzo di calamite e di modellini in plastica delle molecole d’acqua.
19 Sono stati pianificati i due incontri di recupero dopo aver visto i risultati delle due prove formative. Per realizzare gli incontri, è stato chiesto ai bambini e alle bambine, che avevano raggiunto il 70% dei risultati apprendimento, di fare da tutor.
20 Se l’individuazione era corretta, ma non veniva fornita alcuna motivazione, oppure veniva data una motivazione non giusta, il punteggio assegnato era 0. Se il bambino o la bambina riconosceva nella foto una caratteristica che non era stata prevista e la motivava adeguatamente, riceveva un punteggio pieno. Ad esempio, in una immagine in cui c’era una bustina di tè nell’acqua si era pensato al potere solvente, ma ci sono state risposte che hanno indicato, giustamente, anche la capillarità.