
Una pagina di Storia della Chimica per la Didattica:
lo sviluppo della teoria molecolare della capillarità
Vincenzo Villani
Dipartimento di Scienze, Università degli Studi della Basilicata
e-mail: vincenzo.villani@unibas.it
Abstract. The development of understanding of the molecular nature underlying the phenomenon of capillarity and the relation of this with the surface tension underlying the formation of drops and bubbles can become a useful teaching tool in establishing the cause-effect link between the molecular microscopic world and the observed macroscopic world.
The chemist uses capillarity in many forms in daily practice, for example in the thin layer chromatography technique, and surface tension in problems of solubility and emulsion stability. However, the depth of these ideas goes far beyond and represents an important page in the history of chemistry and physics, and the development of these concepts is exciting and of educational value. This is a highly interdisciplinary topic, little addressed in teaching programs, but the historical perspective facilitates its exposition and introduces in an innovative way the role of molecular interactions underlying macroscopic phenomena.
Although Leonardo already intuited the presence of “hidden” cohesive forces in the formation of a drop, it is in the hands of Laplace’s genius that the molecular theory of capillarity is completely developed and despite the outdated hypothesis, it reaches today.
The rise (or lowering) of the level of a liquid in a capillary tube still aroused wonder in the 18th century and greatly disturbed temperature and pressure measurements using liquids in capillary tubes. Today, the idea that it was the gravitational force of the interaction between atoms and molecules responsible for the phenomenon may seem naive, but in truth it was a huge step forward towards a unified vision of the forces of Nature from the atom to the universe. The debate in the 19th century was fierce and profound, it mobilized the greatest minds of the time Laplace, Maxwell, Gauss... Laplace’s theory constituted the solution and the starting point for subsequent studies. The same interactions were placed by the chemist Berthollet at the basis of the chemical affinities, responsible of the reactivity. Then the fundamental laws were deduced, and it was established that the phenomenon of capillarity is due to the surface tension of liquids and this to the short-range attractive and repulsive molecular interactions at the interface.
Keywords: Teoria della capillarità; tensione superficiale; interazioni molecolari; affinità chimica
Tensione superficiale di un liquido, fenomeni di capillarità, interazioni molecolari all’interfaccia, sono concetti complessi e poco utilizzati nella didattica, ma strettamente connessi tra loro che possono costituire un fil rouge interdisciplinare capace di legare in una relazione di causa-effetto il livello microscopico delle molecole a quello macroscopico osservato. In verità, facendo riferimento a fenomeni ben noti, ripercorrendo lo sviluppo storico e l’interpretazione particellare della materia che ne fu data da Newton prima e successivamente da Ampère, Berthollet e Laplace [1-4], è possibile chiarire senza perdita di rigore questi concetti e sviluppare utili analogie didattiche per illustrare le interazioni atomiche e molecolari.
In questo percorso, cominciamo da una semplice domanda: perché le gocce e le bolle sono sferiche? È un’osservazione tanto comune che rischia di cessare di meravigliarci; tuttavia, questa intrigante proprietà è carica d’informazione e può diventare il vettore di concetti profondi. La sfericità è dovuta alla tensione superficiale che rende elastica la superficie libera dei liquidi. Allora, la forma sferica risulta una conseguenza della minima energia superficiale, ottenuta rendendo minima l’area superficiale; infatti, la sfera è la forma geometrica che ha il più basso rapporto superficie-volume: dato un certo volume, l’area superficiale è la più bassa possibile. A sua volta, la tensione superficiale all’interfaccia è la risultante tra le forze di coesione del liquido e le forze di adesione solido-liquido.
Fu il genio di Leonardo a intuire e descrivere per la prima volta la profondità del problema (Codice Atlantico, 1478-1518):
La gravità di una goccia d’acqua è dupla: una comune a tutti i corpi la spinge verso il centro della Terra, l’altra, sua propria, la spinge verso il centro della sua massa; ma di questa non veggo nell’umano ingegno modo di darne scienza, ma dire come si dice della calamita che attira il ferro, cioè che tal virtù è occulta proprietà, della quale è infinita la natura.
E che dire della capillarità? Come è noto un liquido si innalza (o si abbassa, a seconda dei materiali in gioco) in un capillare, sfidando apparentemente la forza di gravità: l’acqua s’innalza in un capillare di vetro e il mercurio si abbassa, rispetto al livello del liquido nel serbatoio. Solo nel XIX secolo il genio di Laplace dimostrò che la tensione superficiale e la capillarità sono due facce della stessa medaglia e la prima è causa della seconda: è la pressione generata dalla superficie libera del liquido (il cosiddetto menisco) che innalza la sottostante colonna di liquido, fino all’equilibrio tra la pressione esercitata verso l’alto e il peso della colonna sottostante. Dunque, le interazioni molecolari alla superficie di un liquido sono la causa della tensione superficiale e la tensione superficiale del liquido è la causa dei fenomeni capillari.
La capillarità era uno spiacevole effetto parassita che falsava le misure di temperatura nei primi termometri a mercurio inventati nel 1705 da Fahrenheit, entusiasta per la bella invenzione [5]:
Quando realizzai il termometro a mercurio (imperfetto sotto molti modi) il risultato rispose alla mia preghiera, e con grande piacere della mente osservai la verità che l’acqua bolle a un determinato grado di calore.
Tensione superficiale e capillarità intervengono in molti e importanti fenomeni comuni e applicativi. L’acqua bagna in modo diverso una superficie idrofoba o idrofila. Fu Young nel 1804 a scoprire il parametro chiave di questa interazione, l’angolo di contatto: una goccia si spande su una superficie idrofila fino a un angolo di contatto tendente a zero; al contrario, si contrae su una superficie idrofoba formando un angolo maggiore di 90° (Figura 1).

Figura 1. Una goccia d’acqua su una superficie idrofoba (a sinistra) a idrofila (verso destra)
La bagnabilità (wetting) è una proprietà di grande interesse applicativo: oggi i chimici modulano in modo sofisticato questa proprietà, rivestendo le superfici di macromolecole con un gruppo laterale che può essere caricato o scaricato elettricamente, rendendo la superficie idrofila o idrofoba a piacimento (Figura 2) [6].
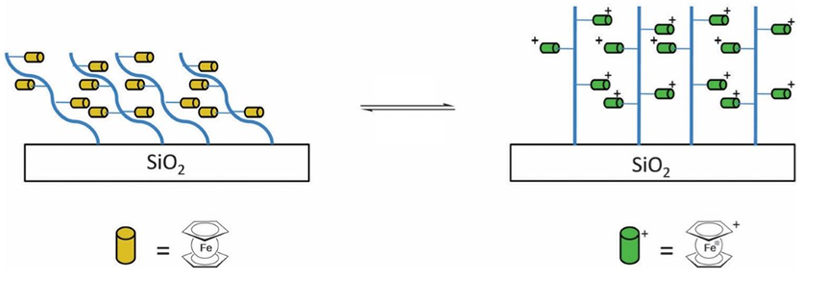
Figura 2. Una lastra di vetro decorata mediante una poliolefina con il ferrocene come gruppo laterale, in cui il ferro può essere ossidato o ridotto applicando un potenziale elettrico
La tensione superficiale controlla un gran numero di fenomeni, ad esempio, la formazione delle emulsioni, in cui minute gocce d’olio sono disperse in acqua (o viceversa, minute gocce d’acqua sono disperse in olio), grazie alla presenza di un tensioattivo (la lecitina, ad esempio) che riveste l’interfaccia della goccia d’olio di molecole solubili in acqua, rendendo miscibile l’olio in acqua e sufficientemente stabile la goccia abbassando la tensione superficiale (Figura 3).

Figura 3. Rappresentazione di un’emulsione olio in acqua: le molecole anfotere del tensioattivo stabilizzano l’interfaccia con la catena apolare nell’olio e la testa polare in acqua
Analogamente, le bolle d’aria sono disperse mediante una vigorosa agitazione meccanica nel latte, nella chiara d’uovo delle meringhe o nel cappuccino. Altresì, gli alveoli polmonari, le cellule, i batteri e i virus sono stabilizzati da una membrana di tensioattivi a base di fosfolipidi e proteine che, riducendo la tensione superficiale, rendono stabili particelle nanometriche altrimenti altamente instabili (Figura 4).

Figura 4. Una rappresentazione del Sars-Cov-2 la cui membrana è stabilizzata dalla bassa tensione superficiale
Il chimico sfrutta la capillarità nella pratica del laboratorio, ogni volta che effettua una cromatografia su carta o su strato sottile (TLC): l’eluente sale per capillarità, separando i soluti disciolti in modo riconoscibile (Figura 5). Allo stesso modo, la linfa sale dalle radici alle foglie degli alberi per capillarità nei minutissimi tubuli del tessuto conduttore (xilema e floema).

Figura 5. Separazione dei componenti di una goccia di inchiostro nero mediante TLC, utilizzando una soluzione di etanolo e acqua
La storia moderna della capillarità comincia nel XVII secolo con Alfonso Maria Borrelli e Geminiano Montanari, i grafici dell’opera di quest’ultimo contengono in modo chiaro i principali effetti capillari: la risalita del liquido in stretti tubicini, in modo inversamente proporzionale alla dimensione del foro (Figura 6).
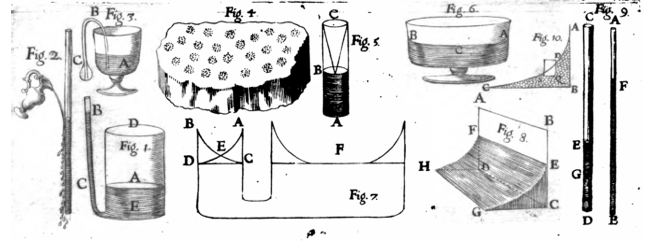
Figura 6. Gli esperimenti di capillarità di Geminiano Montanari (1667)
Fu tuttavia l’opera di Newton a rappresentare anche in questo caso lo spartiacque. Newton aderì all’atomismo, diffuso dal filosofo Pierre Gassendi (De vita et moribus Epicuri, 1647) entusiasta delle idee contenute nel De rerum Natura di Lucrezio, riscoperto da Poggio Bracciolini nel 1417. Nell’ultimo capitolo dell’Ottica del 1705 sono riportate 31 Questiones (ipotesi di lavoro), la cui soluzione è lasciata ai posteri. La XXXI è incentrata sulla natura particellare della materia e sulla natura short-range dell’attrazione intermolecolare: sensibile solo a distanze insensibili e di come sia fondamentale nei comportamenti chimici e nella capillarità:
Dalla coesione dei corpi, desumerei che le loro particelle si attraggono l’un l’altra per effetto di una certa forza, straordinariamente grande nel contatto immediato, che a piccole distanze produce gli effetti chimici e capillari e lontano dalle particelle non arriva a produrre alcun effetto percepibile dai sensi.
Utilizzando capillari di vetro con il foro della stessa dimensione, ma con pareti sottili o spesse, osservò che il liquido si innalzava (o abbassava a seconda del liquido utilizzato) nella stessa misura, dimostrando la natura short-range delle interazioni molecolari, dal momento che sono efficaci solo le interazioni all’interfaccia (Figura 7).

Figura 7. L’acqua risale nella stessa misura in capillari di vetro dalla parete sottile o spessa
Analogamente, dimostrò che un’impercettibile pellicola d’olio sulla parete interna del capillare inibiva completamente il fenomeno.
Il chimico francese Bertollet nel trattato Statique Chimique (1804), il primo trattato di Chimica teorica in senso moderno, pone in stretta relazione il fenomeno della capillarità e l’affinità chimica:
Si debbono ricercare le leggi dell’attrazione molecolare, considerando i loro effetti nei fenomeni della statica chimica e in quelli offerti dall’equilibrio dei liquidi contenuti negli spazi capillari.
In questo modo è indicata l’urgenza di chiarire la natura delle forze di attrazione molecolare alla base della reattività osservata: la capillarità risulta essere la via privilegiata in questa direzione.
La spiegazione fu infine trovata da Laplace nel 1805, in una geniale teoria fortemente matematica, che risulta essere la prima teoria molecolare in senso moderno. Considerando le molecole costituite da una massa circondata da un’atmosfera di calorico (il fluido imponderabile responsabile dei fenomeni termici), tenendo conto dell’attrazione gravitazionale massa-massa e massa-calorico e della repulsione calorico-calorico e ipotizzando un’interazione molecolare short-range, ovvero (in termini newtoniani) insensibile a distanza sensibile, senza esplicitare oltre la forza intermolecolare, ricava l’equazione di Laplace-Young della tensione superficiale (equazione 1) e la legge di Jurin dell’innalzamento/abbassamento del liquido nei capillari (in modo inverso al raggio a del foro), o tra lastre piane ravvicinate (equazione 2):
[2]
Laplace non approfondisce la natura short-range della forza gravitazionale operante a livello molecolare, ma questa sarebbe dovuta all’attrazione tra sferoidi, piuttosto che tra masse puntiformi, che si esercita quando la distanza intermolecolare è comparabile alla dimensione dei corpi interagenti: tuttavia, essendo incognita la forma molecolare e le distanze in gioco non gli è possibile spingere oltre l’analisi:
Le affinità dipenderebbero dalla forma delle molecole integranti e dalle loro rispettive posizioni, e si potrebbe con la varietà di queste forme, spiegare tutte le varietà delle forze attrattive, e ricondurre così a una sola legge generale tutti i fenomeni della fisica e dell’astronomia. Tuttavia, l’impossibilità di conoscere le figure delle molecole e le loro distanze mutue, rende queste spiegazioni vaghe e inutili al progresso delle scienze.
Infine, Poisson (1831), allievo di Laplace, conferma le equazioni del maestro e include nel calcolo la variazione della densità del liquido all’interfaccia.
In conclusione, e con una bella analogia didatticamente utile, possiamo dire che le molecole, nella visione dei chimici e fisici d’inizio Ottocento si comportano come bolle di sapone: si attirano fortemente quando vengono a contatto, ma altresì resistono allo schiacciamento, raggiungendo una stabile configurazione d’equilibrio (Figura 8).

Figura 8. La configurazione d’equilibrio di due bolle di sapone a contatto
sotto l’azione della tensione superficiale e della pressione dell’aria
[1] André-Marie Ampère - Opere (a cura di Mario Bertolini), Classici della Scienza, UTET, Torino, 1969.
[2] V. Villani, La geniale teoria delle combinazioni chimiche di André-Marie Ampère, Rendiconti Accademia Nazionale delle Scienze detta dei XL, Memorie di Scienze Fisiche e Naturali, 2019, vol. XLIII, 197.
[3] Opere di Pierre Simon Laplace (a cura di Orietta Pesenti Cambursano), Classici della Scienza, UTET, Torino, 1967.
[4] V. Villani, Molecole e Interazioni molecolari nella teoria della capillarità, Rendiconti Accademia Nazionale delle Scienze detta dei XL, Memorie di Scienze Fisiche e Naturali, 2022, vol. XLVI, 151.
[5] A. Baracca, A. Rossi, Materia e Energia, Feltrinelli, Milano, 1978.
[6] R. Pietschnig, Polymers with pendant ferrocenes, Chem. Soc. Rev., 2016, 45, 5216.