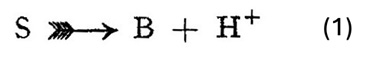
I contributi di J. N. Brønsted e di T. M. Lowry
alla definizione di acidi e basi1
Franco Calascibetta
Gruppo Nazionale di Fondamenti e Storia della Chimica
Indice
4. Brevi riflessioni conclusive
Abstract.The two physical chemists Johannes Nicolaus Brønsted (1879-1947) and Thomas Martin Lowry (1874-1936) are usually jointly credited with the definition of acids and bases in terms of acceptors and donors of H+ ions. Each on his behalf, in a completely independent manner, in the same year, 1923, they in fact published two articles from which the aforementioned definition originates. We aim to analyze the contents of these articles to illustrate the different paths taken by the two scientists to arrive at this result.
Keywords: definizioni di acidi e basi; Johannes N. Brønsted; Thomas M. Lowry
Nell’agosto del 1923, nel fascicolo numero 8 del volume 42 della rivista Recueil des travaux chimiques des Pays-Bas venne pubblicato un articolo, scritto dal chimico danese Johannes Nicolaus Brønsted dal titolo “Einige Bemerkungen über den Begriff der Säuren und Basen” (Alcune osservazioni sul concetto di acidi e basi) [1]. Qualche mese prima, nel gennaio dello stesso anno, sulla rivista inglese Journal of the Society of Chemical Industry era stato pubblicato un articolo intitolato “The uniqueness of hydrogen” (L’unicità dell’idrogeno) a firma del chimico inglese Thomas Martin Lowry [2]. Come è noto sono queste le due pubblicazioni che segnarono l’introduzione della teoria, secondo la quale acidi e basi sono specie chimiche in grado rispettivamente di cedere e accettare ioni idrogeno. I due scienziati operavano entrambi nel campo della chimica fisica, ma differenti furono i presupposti attraverso cui arrivarono indipendentemente a conclusioni analoghe. In questo studio cercherò di descrivere più dettagliatamente i percorsi che seguirono in queste loro ricerche.
Johannes Nicholaus Brønsted era professore di chimica fisica all’Università di Copenhagen dal 1908. I suoi studi si erano ispirati inizialmente a quelli del connazionale Julius Thomsen (1826-1909) volti a determinare l’affinità chimica misurando il lavoro massimo di un processo chimico. Brønsted, però, invece di utilizzare determinazioni calorimetriche, si servì di misurazioni della forza elettromotrice per celle galvaniche. Da qui era passato a ricerche sulla determinazione delle costanti di affinità, sulla solubilità e sull’interazione specifica degli ioni [3]. Nell’ambito di esse, avrebbe poi pubblicato nel 1924, con Victor K. La Mer (1895-1966), un articolo sulla relazione tra i coefficienti di attività e la forza ionica della soluzione [4], relazione derivata teoricamente negli stessi anni da Peter Debye (1884-1965) ed Erich Hückel (1896-1980).
Fu questo interesse per l’elettrochimica che probabilmente condusse Brønsted a riflettere sulla teoria, fondata decenni prima da Svante Arrhenius (1859-1927). Lo portò, infatti, a proporre una rivisitazione dei concetti di acido e base rispetto a quanto fissato dal chimico svedese. Il suo scopo era indicato sin dal titolo e veniva chiaramente illustrato nel paragrafo introduttivo:
Dalla enunciazione della teoria della dissociazione elettrolitica da parte di Arrhenius, la definizione dominante di acidi e basi come sostanze che possono liberare ioni idrogeno o ioni idrossile in soluzione non è mai stata seriamente attaccata per quanto riguarda la definizione di acidi. Abbiamo mantenuto fermamente l’idea che il composto S2 è un acido se viene parzialmente o completamente scisso in soluzione secondo il seguente schema (Figura 1).
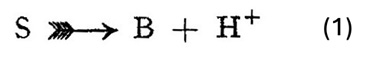
Figura 1. Relazione tra un acido e la sua base corrispondente secondo Brønsted [1]
L’articolo poi proseguiva ricordando che, dopo Arrhenius, c’erano stati timidi tentativi di definire in maniera diversa le basi, ad esempio da parte di Paul Pfeiffer (1875-1951) [5] e poi di Leonor Micaelis (1875-1949) [6], che aveva dato una prima parziale definizione di base come specie in grado di accettare ioni idrogeno, senza però sviluppare questo spunto. Quindi Brønsted così continuava:
Lo scopo del presente piccolo contributo è quello di mostrare i vantaggi che derivano da una definizione modificata di base. I vantaggi della definizione di base come sostanza in grado di legare uno ione idrogeno sono immediatamente evidenti. Nello schema (1), in cui è stabilito il concetto di acido (S), è ugualmente definito il concetto di base (B) e così il reciproco collegamento delle proprietà acide e basiche si mostra nel modo più chiaro e semplice.
Più oltre l’autore ribadiva:
Il risultato di queste considerazioni può essere formalizzato nel modo seguente: gli acidi e le basi sono sostanze capaci rispettivamente di cedere o di accettare ioni idrogeno. L’essenza di questo concetto di definizione di acidi e basi è data dall’espressione (1), in cui non si dice più niente delle proprietà di S e B. Ci riferiremo ad S e B, cioè ad un acido e ad una base che sono legati tra loro dalla relazione, come acidi e basi corrispondenti (korresponderiende).
Sottolineava quindi che gli acidi e le basi corrispondenti non potevano avere lo stesso stato di carica elettrica, portando alcuni esempi relativi alle coppie acido acetico/ione acetato, ione ammonio/ammoniaca, acido ossalico/ione ossalato (Figura 2).
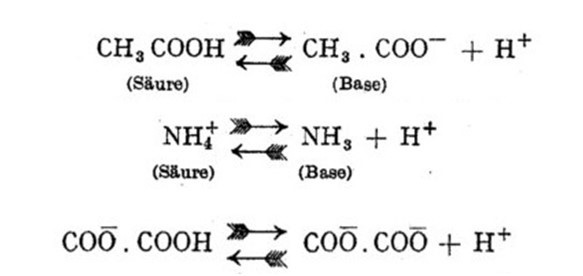
Figura 2. Esempi di coppie acido/base coniugate in Brønsted [1]
La trattazione di Brønsted così proseguiva:
L’equilibrio formulato nello schema (1) tra lo ione idrogeno e i corrispondenti acido e base può essere chiamato un equilibrio semplice acido-base. Mescolando due sistemi semplici, si ottiene un sistema doppio acido-base e un equilibrio che può essere formulato come segue (Figura 3).Questo equilibrio include una serie di reazioni importanti come la neutralizzazione, l’idrolisi, le reazioni degli indicatori ecc.

Figura 3. Sistema doppio acido/base secondo Brønsted [1]
Nella chiusura, Brønsted sottolineava come lo ione OH– non avesse una posizione particolare come portatore di proprietà basiche ed evidenziava l’analogia tra gli equilibri acido/base e quelli redox, a parte la carica opposta della specie scambiata nei due casi.
Come credo sia evidente, anche a cento anni di distanza l’articolo è perfettamente leggibile, al punto che le citazioni riportate sopra potrebbero tranquillamente essere confuse con passi di un qualsiasi manuale di chimica in uso nelle nostre scuole o nelle nostre università. L’attribuzione al chimico danese della definizione appare perciò assolutamente indiscutibile.
Thomas Martin Lowry dopo la laurea in chimica nel 1896, divenne assistente del chimico organico Henry E. Armstrong (1848-1937). Nel 1913 fu nominato professore di chimica all’Università di Londra, andando poi a occupare la nuova cattedra di Chimica Fisica presso l’Università di Cambridge, dove rimase fino alla morte.
Durante i suoi anni con Armstrong, Lowry sviluppò un interesse per l’isomerismo dinamico, vale a dire, l’interconversione spontanea di due isomeri in soluzione che porta a una miscela di equilibrio dei due. Ciò lo osservò per la prima volta con gli isomeri ottici dei derivati della canfora, un fenomeno che chiamò “mutarotazione”, poiché il percorso verso l’equilibrio era correlato con una variazione continua nella rotazione ottica della soluzione.
Dopo il suo trasferimento a Cambridge, Lowry fu coinvolto nella seconda fase dello sviluppo della moderna teoria elettronica della chimica organica, basata sull’applicazione delle idee di Gilbert N. Lewis (1875-1946) sul legame chimico come dovuto alla condivisione di coppie di elettroni [7].
Un sottoprodotto dell’interesse di Lowry per la nuova teoria elettronica della chimica organica lo portò all’interpretazione di un tipo di isomerismo dinamico, che chiamò “prototropia”, in cui i due isomeri in equilibrio venivano interconvertiti dalla migrazione di un protone all’interno di una molecola da una posizione a un’altra. Poiché i siti di attacco del protone corrispondevano a una varietà di gruppi funzionali, ciò lo indusse a mettere in discussione l’identificazione della basicità con il solo OH–, ed è da qui che probabilmente nacque il suo interesse per una ridefinizione di acidi e basi.
Se andiamo ora a esaminare brevemente l’articolo che egli pubblicò all’inizio del 1923, in base al quale nasce il riconoscimento del suo ruolo in tale ridefinizione, notiamo che il titolo “L’unicità dell’idrogeno”, al contrario di quello della pubblicazione di Brønsted, esaminata nel precedente paragrafo, non è così immediatamente riconducibile agli equilibri acido-base. Le prime righe dell’articolo di Lowry permettono di capire meglio le considerazioni dell’autore:
Più di un autore ha recentemente speso le sue energie e messo alla prova la pazienza dei suoi lettori, discutendo la questione se l’idrogeno debba essere considerato come un omologo inferiore dei metalli alcalini univalenti o degli alogeni univalenti. Questo problema, che può essere paragonato a quello ancora più antico, se l’idrogeno liquido dovesse rivelarsi un metallo o una paraffina, era di un certo interesse 50 anni fa, quando la teoria delle ottave dominava la classificazione periodica degli elementi. È curioso che sopravviva ancora in un’epoca in cui l’esistenza dei periodi con 2, 8, 18 e 32 elementi è stata così chiaramente stabilita. In queste circostanze le colonne della tavola di Mendeleev sono diventate un’ossatura puramente convenzionale, mediante la quale è possibile risparmiare spazio, e diminuire lo sforzo della memoria ... Questa forma convenzionale della tavola periodica sembra, tuttavia, occupare un posto particolarmente fermo nella mentalità dei chimici, in considerazione del fatto che problemi come quello sopra suggerito sono ancora considerati degni di considerazione. Una visione molto più chiara della relazione tra l’idrogeno e gli altri elementi univalenti si ottiene mediante la teoria elettronica della valenza enunciata da Lewis. A Lewis spetta il merito di fornire per la prima volta un quadro chiaro (insieme ad una spiegazione plausibile) di due distinti tipi di affinità chimica, la cui esistenza era stata riconosciuta in modo confuso fin da quasi cent’anni or sono.
Le argomentazioni dell’autore vanno innanzi tutto contestualizzate al periodo che stiamo esaminando, in cui la tavola periodica cessava di essere organizzata solo in base alle proprietà chimiche e diventava soprattutto un riflesso della configurazione elettronica esterna degli elementi. Notiamo inoltre l’immediato richiamo alla teoria del legame di Lewis, di cui Lowry fu fin da subito convinto sostenitore.
Lowry continuava a far riferimento a Lewis nel proseguire l’esposizione delle proprie idee:
Secondo la teoria dell’ottetto di Lewis, gli elementi devono la loro valenza alla forza potente ma misteriosa che li spinge a formare gruppi di 2, 8, 18 o 32 elettroni. Questa forza è evidentemente identica a ciò che è stata descritta per molte generazioni come “affinità chimica”, poiché è questo che determina la combinazione chimica tra gli atomi. La formazione dei gruppi stabili di elettroni, che nel caso degli elementi dal carbonio al calcio sono solitamente ottetti, può essere effettuata in due modi principali: (i) trasferendo elettroni da un atomo all’altro, ad es. da un atomo che contiene troppi elettroni rispetto a uno che ne contiene troppo pochi; o (ii) condividendo elettroni tra atomi adiacenti, in modo che due atomi entrambi carenti di elettroni possano raggiungere una condizione di completezza che nessuno dei due potrebbe raggiungere da solo. Nella maggior parte dei casi questi due tipi di valenza possono essere distinti in modo piuttosto netto, come nei casi tipici di Na+ Cl- e Cl-Cl. Nel caso degli alogeni può sorgere la domanda se la dissociazione della molecola (ad esempio del cloro nella formazione di ClCH2-CH2-Cl da C2H4 e Cl2) avvenga simmetricamente, dando origine a due atomi neutri portanti ciascuno un settetto di elettroni oppure generi un atomo che trasporta un ottetto completo (e quindi caricato negativamente) e un secondo che trasporta solo un sestetto di elettroni (e quindi caricato positivamente). Ma finché non avviene effettivamente la divisione della molecola, non vi è alcuna ragione per cui non debba persistere la simmetria della molecola e con essa il carattere completamente apolare del legame tra i 2 atomi di cloro.
Rispetto a quanto detto, l’idrogeno meritava però una considerazione particolare:
È proprio qui che diventa evidente l’unicità dell’idrogeno, poiché in questo elemento i due tipi di valenza non possono essere distinti in modo così semplice e facile. Pertanto, nel caso dell’acido cloridrico, la formula elettronica della molecola è: CI:H, la formula elettronica dell’acido ionizzato è: CI:− + H+, dove lo ione idrogeno può essere considerato provvisoriamente come un semplice nucleo nudo: un singolo protone che non trasporta alcun elettrone né nel nucleo né all’esterno. Quando lo ione idrogeno è lontano dallo ione cloro, le forze tra loro sono evidentemente elettrostatiche e di carattere polare, e l’affinità tra loro è chiaramente dovuta all’’elettrovalenza. Ma quando i due atomi sono vicini, possono essere considerati come se condividessero una coppia di elettroni e quindi uniti da una covalenza … Il comportamento unico dell’idrogeno è dovuto al fatto che una configurazione stabile può essere ottenuta sia senza elettroni, come nello ione idrogeno, sia con due elettroni, come nella molecola di idrogeno H:H.
Lowry proseguiva la trattazione mostrando come nelle molecole l’idrogeno poteva trovarsi in situazioni intermedie tra i due stati suddetti3 e, quando acquisiva lo stato di ione, evidenziava una capacità di muoversi da una parte all’altra della molecola, quella che lui, in articoli precedenti, aveva definito “prototopia”. Questo era probabilmente, nelle intenzioni di Lowry, il tema centrale dell’articolo. Ai nostri fini interessa di più arrivare alla parte finale, in cui l’autore si sofferma su HCl e le sue proprietà di acido forte:
È un fatto notevole che l’acidità forte si sviluppi apparentemente solo nelle miscele e mai nei composti puri. Anche l’acido cloridrico diventa acido solo se miscelato con acqua. Ciò può essere spiegato dall’estrema riluttanza di un nucleo di idrogeno a condurre un’esistenza isolata, sebbene sia abbastanza disposto ad attaccarsi a qualsiasi ottetto che non sia troppo ostile, o troppo completamente occupato da altri atomi per lasciare spazio a un nucleo aggiuntivo. L’effetto della miscelazione dell’acido cloridrico con l’acqua è probabilmente quello di fornire un accettore per il nucleo di idrogeno in modo che la ionizzazione dell’acido comporti solo il trasferimento di un protone da un ottetto all’altro.
Corredava l’affermazione con schemi, fra i quali quello riportato in figura 4 può essere certamente considerato un caso particolare dei sistemi doppi acido/base (Figura 3) di cui avrebbe scritto anche Brønsted qualche mese dopo.
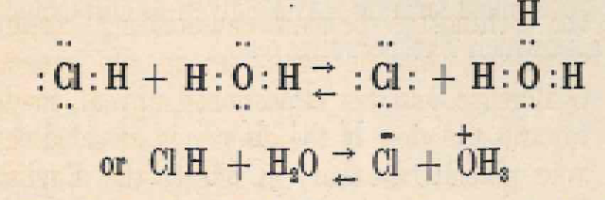
Figura 4. Reazione di HCl in acqua secondo Lowry [2]
Però Lowry è inequivocabilmente il primo ad aver sottolineato ed argomentato l’esistenza in acqua dello ione H3O+.
Anche le considerazioni seguenti risultano importanti e innovative ai fini della definizione di acidi e basi:
Si ritiene comunemente che gli alcali o le basi siano unici quanto gli acidi e che lo ione idrossile occupi una posizione altrettanto peculiare quanto lo ione idrogeno. Questa, tuttavia, è una visione ristretta, basata sul fatto che la maggior parte del nostro lavoro chimico viene svolto in presenza di acqua, se non addirittura in soluzioni acquose. La vera funzione di una base è quella di accettore di nuclei di idrogeno, e uno dei casi più semplici di neutralizzazione è l’accettazione di uno ione idrogeno da parte di una molecola di ammoniaca (Figura 5).
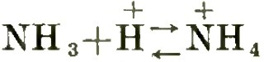
Figura 5. Il comportamento basico dell’ammoniaca secondo Lowry [2]
Se la base è sufficientemente forte, può non solo accettare i nuclei di idrogeno liberi che sono stati allontanati dalle molecole di un acido, ma può anche rubarli a composti in cui sono trattenuti solo debolmente, ad esempio dall’acqua, come nella reazione (Figura 6):

Figura 6. Reazione tra ammonica e acqua secondo Lowry [2]
In questo caso la forza della base si manifesta con la liberazione di ioni idrossile ... Lo ione idrossile è esso stesso una base forte, poiché è in grado di accettare ioni idrogeno. La combinazione dello ione idrogeno con l’idrossile è, tuttavia, quasi limitata alle soluzioni acquose, mentre la neutralizzazione mediante accettazione di un nucleo di idrogeno può avvenire in qualsiasi solvente in cui si possano produrre ioni idrogeno.
4. Brevi riflessioni conclusive
Per gli scopi espliciti del suo articolo e per tutte le argomentazioni in esso contenute, Brønsted appare certamente il principale padre della moderna definizione di acidi e basi, avendo sviluppato con chiarezza e completato alcune riflessioni preliminari di L. Michaelis. Tuttavia, anche se nell’articolo di Lowry le reazioni acido/base costituivano in effetti un corollario rispetto ai temi centrali del suo articolo, le considerazioni finali, che abbiamo riportato sopra, aggiungono qualcosa che in Brønsted non compare esplicitamente. Ciò, insieme alla non del tutto trascurabile precedenza temporale, giustifica in definitiva la doppia attribuzione della teoria ai due scienziati, malgrado le riserve che in passato furono sollevate rispetto al ruolo di Lowry [9]. C’è da dire che storicamente né Brønsted né Lowry apparvero in seguito molto interessati a sottolineare questo loro merito, avendo nella loro attività di scienziati dedicato maggiore attenzione ad altri temi e ottenuto risultati, da entrambi ritenuti più significativi. Alla fine, però, e questo vale in definitiva per tutti e due, è la definizione di acidi e basi il motivo per il quale ancor oggi essi vengono generalmente ricordati.
[1] J. N. Brønsted, Recl. Trav. Chim. Pays-Bas, 1923, 42, 718.
[2] T. M. Lowry, J. Soc. Chem. Ind., 1923, 42, 43.
[3] C. Coulston Gillispie et al., Dictionary of scientific biography, Scribner’s Sons, New York 1970, Vol. 2, 498-499.
[4] J. N. Brønsted, V. K. la Mer, J. Am. Chem. Soc., 1924, 46, 555.
[5] P. Pfeiffer, Ber. Dtsch. Chem. Ges., 1907, 40, 4036.
[6] L. Michaelis, Die Wasserstoffionenkonzentration, Verlag von Julius Springer, Berlin, 1922, p. 14.
[7] W. B. Jensen, Educación Química, 2016, 27, 175.
[8] L. Pauling, J. Am. Chem. Soc., 1932, 54, 3570.
[9] R. P. Bell, The Proton in Chemistry, Cornell University, New York, 1973, p. 4.
1 La conferenza tenuta dall’autore al Convegno della Divisione Didattica della Società Chimica Italiana aveva come tema un excursus storico sui concetti di acidi e basi. Dato il breve spazio qui a disposizione si è preferito soffermarci su una parte dei contenuti della conferenza.
2 Il simbolo S nasce ovviamente dal fatto che in tedesco (lingua in cui è scritto l’articolo originale) la parola per indicare acido è Säure.