Abstract. The Project ASSeT, currently underway at ITTS Divini in San Severino Marche, focuses on strengthening the basic tools for the mathematization of reality, both in its quantitative and qualitative aspects. Considering previous activities on stoichiometric relationships, we recognized the need to modify the symbolic description to bring it closer to the essential and systemic aspects of the particle model of chemical reactions. We consider the iconic register presented in the article suitable for this purpose and believe it should be practiced before introducing the typical formalism of chemical equations.
Keywords: Equazione di reazione; sistema chimico; reazione chimica; modello iconico microscopico
1. Introduzione: codifica simbolica dei sistemi chimici
La didattica della matematizzazione, oggetto del progetto d’istituto ASSeT (Arricchimento Strumentale per le Scienze e le Tecnologie), nel senso più ampio include la scelta dei sistemi di segni adeguati a rappresentare le entità, nel loro modificarsi nei processi chimici. Scelta non neutrale rispetto alla comprensione del processo chimico che gli studenti auspicabilmente sviluppano per gradi.
L’equazione chimica, da bilanciare, con le sue formule dei reagenti, la freccia, le formule dei prodotti, i segni “+”, ecc., condensa e astrae un vasto complesso di concetti e assunti convenzionali. Questi possono essere pienamente significativi solo per chi possieda un modello mentale del corrispondente processo di trasformazione chimica - coinvolgente moltitudini di entità elementari - e di almeno alcune caratteristiche essenziali del sistema costituito da tali mutevoli entità.
La “realtà chimica” è costituita in parte da ciò che si osserva a livello fenomenologico e si interpreta tramite concetti, come quelli di sostanza e di identità della sostanza, e, dunque, al livello macroscopico. Ma è altrettanto vero che della stessa “realtà chimica” fanno parte entità materiali ultramicroscopiche, invisibili e costituite da atomi, numericamente invarianti almeno nel contesto chimico. Il livello atomico-molecolare, in quanto non direttamente esperibile, richiede un modello dinamico. Quello che si introduce nel presente contributo riduce allo stretto necessario gli elementi concettuali e simbolici che permettono di raccordare, ossia interpretare, almeno le evidenze più generali, della reazione chimica: l’aspetto temporale, i cambiamenti associati alla formazione/scomparsa dei corpi materiali, che senza modello microscopico sarebbero interpretati come “trasmutazioni”, e gli aspetti stechiometrici, interpretabili in base all’invarianza numerica degli atomi e non alla pura algebra del bilanciamento.
Va dunque chiarito, nell’adattamento didattico della proposta, che il modello iconico serve a spiegare le sopraddette caratteristiche generali dei fenomeni chimici, stimolando cambiamenti a lungo tempo del modo stesso di percepire le reazioni chimiche da parte degli studenti. È evidente che, nello sviluppo didattico, gli studenti avranno innanzitutto avuto modo di osservare/realizzare e descrivere trasformazioni chimiche (e non-chimiche), senza il fardello simbolico, e siano stati aiutati a porsi domande, a cercare spiegazioni che poi si richiameranno nella successiva attività sul modello sistemico.
La stragrande maggioranza degli studenti si trova, invece, a gestire fin dall’inizio l’apparato simbolico dell’equazione di reazione (denominata impropriamente “reazione chimica”) senza avere sviluppato alcun modello mentale trasparente, cioè verbalizzabile tramite concetti, per il livello micro. Prove di questa affermazione sono costituite dal blocco che si riscontra sistematicamente, quando si legge l’equazione bilanciata per risolvere problemi sul reagente limitante, sulla resa di reazione, sulle variazioni di quantità e concentrazione nel passare allo stato di equilibrio. In assenza del modello mentale iconico lo studente affronta i problemi suddetti operando direttamente sul simbolico, analogamente a quanto già fatto nel “bilanciamento”: impara a bilanciare, ma non sa cosa significhi averlo fatto. A. H. Schoenfeld [1] ha coniato il termine “sospensione del senso” per questo fenomeno. Il docente tipico dice agli studenti che “si bilancia per ‘validare’ il principio di conservazione della massa di Lavoisier”. Purtroppo, ciò non basta a stabilire il legame di senso tra le manipolazioni simboliche e la realtà. La forma corretta della stessa legge, in cui è la quantità di ogni singolo elemento che si conserva, scaturisce automaticamente in modo molto chiaro lavorando con il modello iconico.
Per esempio, uno studente sa che: “3,31 g di un generico solfuro MeS, bruciando, danno 2,2 g di diossido di zolfo” e da queste sparute informazioni deve “calcolare il peso atomico dell’elemento Me”. Si blocca perché non può bilanciare l’equazione di reazione: non sa “che fine fa Me”; è aiutato dicendogli che non occorre saperlo: basta ipotizzare che tutti gli atomi di zolfo di MeS finiscono nel diossido. Ma anche questa informazione sarà processata solo dopo aver sostituito le formule di MeS, O2 e SO2 con gli atomi-iconizzati, per ricavare il rapporto stechiometrico 1:1 tra il reagente e il prodotto dati dal problema. Le entità così modellizzate, a differenza dei simboli alfanumerici, sono più simili a degli oggetti concreti, perciò sono manipolati mentalmente.
Le leggi, come quella di Lavoisier, si riscontrano nei modelli, teorici o comunque mentali, che in qualche modo devono essere messi in gioco consapevolmente. Ciò non può avvenire sui codici simbolici. Per poter ragionare al livello micro, per dare pieno significato alle varie manipolazioni e usi delle equazioni, occorre rendere espliciti entità e processi invisibili. Si devono costruire rappresentazioni mentali delle moltitudini di oggetti che “vivono” nella “realtà chimica invisibile”: qualcosa di più immaginifico e dinamico dei simboli alfanumerici, cioè “oggetti simbolici” che rispettino almeno la natura discreta, qualificabile e quantificabile, degli atomi e dei loro aggregati. Da qui la scelta di utilizzare un supporto simbolico iconico, il più semplice possibile, quale: ⒽⓄⒽ. Dunque, non molto diverso da quello che utilizzò Dalton per le “particelle ultime dei corpi omogenei” che dovevano essere necessariamente uguali per ciascun elemento costituente [2]:
Therefore we may conclude that the ultimate particles of all homogeneous bodies are perfectly alike in weight, figure, &c. In other words, every particle of water is like every other particle of water; every particle of hydrogen is like every other particle of hydrogen, &c.
Similmente, così scriveva Feynman all’inizio della sua prima “Physics Lecture”, chiedendosi quale fosse l’immagine complessiva del mondo più densa di verità costruita dalla scienza, 1-2 La materia è composta di atomi (Figura 1):
Se, in qualche cataclisma, tutta la conoscenza scientifica dovesse essere distrutta e si potesse trasmettere solo una frase alle successive generazioni, quale affermazione conterrebbe l’informazione più importante nel minor numero di parole? Io credo che sia l’ipotesi atomica (o il fatto atomico, o comunque la vogliate chiamare) che tutte le cose sono fatte di atomi, piccole particelle che si muovono in moto perpetuo, attraendosi l’un l’altra quando sono a breve distanza, ma respingendosi quando schiacciate l’una sull’altra.
In quell’unica frase, capirete, c’è un’enorme quantità di informazioni sul mondo, solo applicando un minimo di immaginazione e di pensiero” [3].
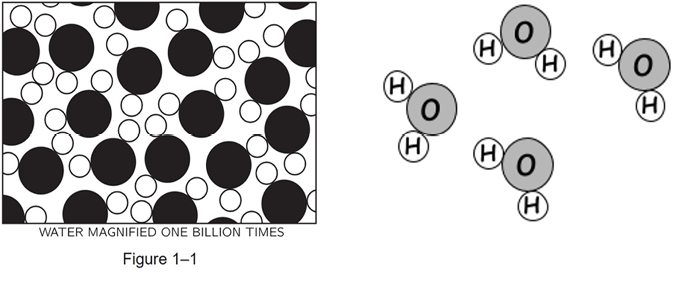
Figura 1. A sinistra, prima figura da [3]: Atoms in motion; a destra, il modello iconico del mondo atomico usato nelle nostre attività sulle reazioni chimiche
Cliccando su https://www.feynmanlectures.caltech.edu/I_01.html si scopre che l’idea e l’immagine sono sviluppate per farne una vera lezione di chimica; un vero capolavoro. Dovremmo farlo anche tutti noi.
2. La rappresentazione usata per introdurre al concetto di sistema chimico
La rappresentazione utilizzata nelle attività consiste dunque in un piccolo gruppo di atomi-iconizzati ed etichettati con i rispettivi simboli degli elementi e aggregati in modo da rispecchiare la composizione e, molto approssimativamente, la costituzione delle sostanze da essi formate. L’invarianza del numero di atomi di ogni elemento presenti nel sistema permetterà agli alunni di completare uno dei due stati del sistema (reagenti o prodotti) con le entità mancanti (atomi, molecole, unità ripetitive). Il ridotto numero di atomi è tale da permettere di contarli facilmente, ma non è il minimo possibile, come solitamente si impone nell’equazione di reazione. I numeri interi e piccoli di unità di aggregati atomici che si “introducono” nel sistema sono arbitrari, coerentemente con la libertà di caricare un recipiente di reazione con qualsivoglia quantità di ciascuna sostanza. Si previene così la frequente confusione tra i coefficienti stechiometrici e le quantità di sostanza realmente presenti.
Il numero limitato di atomi (di tre o quattro elementi al massimo) facilita la lettura spontanea dei rapporti di combinazione, ossia in termini di quantità relative, e non impedirà di immaginare moltitudini enormi, ma finite e trasformate secondo gli stessi rapporti numerici.
Tra le tipologie di aggregati si distinguono solo atomi singoli, molecole semplici e strutture continue, ma non ioni. Quello proposto è, infatti, un livello molto elementare di trattazione, in cui non entra in gioco la struttura atomica. D’altra parte, non si può rischiare la misconcezione, difficile da rimuovere, secondo cui tutte le sostanze composte sono costituite da molecole. Il modello è dunque analogo a quello di Dalton, a parte il fatto che le sostanze elementari non devono essere costituite da atomi singoli separati, come invece Dalton si ostinò a sostenere.
La seguente figura 2, utilizzata nelle istruzioni per gli alunni, rende l’idea delle azioni a loro richieste.
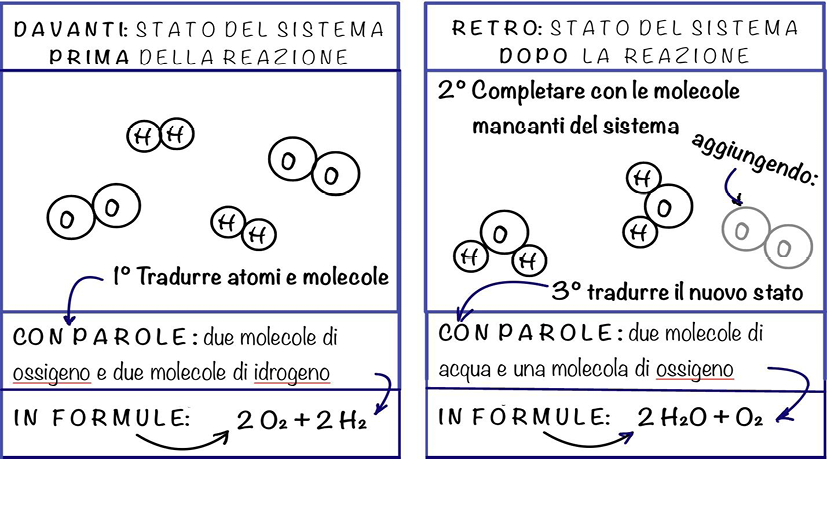
Figura 2. Schema esempio utilizzato per illustrare la prima sezione delle attività
Gli studenti, lavorando in coppia, potranno vedere solo il “prima” o il “dopo”, perché questi schemi saranno stampati avanti e dietro. Ciò li indurrà a interiorizzare gli aggregati e i loro cambiamenti, quindi a concettualizzare il processo microscopico. Saranno così predisposti ad associare o interpretare il fenomeno chimico osservato e la natura delle sostanze in gioco agli stati del sistema chimico.
Anche gli aspetti dinamici, i movimenti caotici, le unioni e le separazioni degli atomi, emergono come necessità e possono essere immaginati con la guida del docente. L’osservazione del moto browniano (praticamente dimenticata dai testi scolastici di chimica generale) potrà essere portata come evidenza di questo “motore” delle trasformazioni, da uno stato iniziale instabile del sistema a uno stato finale in cui tutte le sostanze che possono trasformarsi lo faranno. Stabilizzandosi, ma senza smettere di agitarsi; continuando l’esplorazione di stati più stabili ed eventualmente raggiungibili in tempi più lunghi.
La ricostruzione della realtà, tramite questo modello mentale, richiede la verbalizzazione delle operazioni immaginative, di andata e ritorno tra le diverse traduzioni da un linguaggio all’altro (verbale, iconico, simbolico, matematico) indicate nelle attività (Figura 2) e, quando opportuno, tra la realtà fenomenica e quella atomico-molecolare; sempre con la mediazione del compagno e del docente.
Mentre il modello iconico qui presentato descrive la reazione come una trasformazione tra diversi stati dello stesso sistema, al livello macroscopico la stessa reazione “è percepita più come una «transizione» tra due sistemi diversi che come una «trasformazione» di un solo sistema” [4]. In effetti gli enti (sostanze chimiche/molecole) messi a reagire si distruggono, e dopo di essi emergono - in modalità apparentemente “magiche” - nuove entità a costituire quello che, dal punto di vista delle proprietà osservabili, appare come un “nuovo” sistema. L’invarianza del numero di atomi nelle reazioni chimiche e nel modello garantirà una certa equidistanza - almeno al livello molecolare - tra il punto di vista chimico-fisico, il processo dinamico che si svolge in un unico sistema e il punto di vista fenomenologico. Il modello iconico si presta bene a semplificare e far comprendere la descrizione sistemica e a svelare la prospettiva trasformativa che sta dietro le apparenti “morti” e “nascite” delle sostanze.
Si supera l’elemento magico della “trasmutazione”, stimolando qualche domanda sulle possibili connessioni tra quanto si modifica nel modello iconico e quanto si osserva durante il processo dagli stati iniziale a quelli finali nel sistema chimico reale. Per esempio, nella reazione F (vedi ultima scheda nell’Appendice 3) tra ossido rameico e acido cloridrico sarà facile distinguere i casi in cui risulterà un eccesso di ossido da quelli in cui resterà un eccesso di acido e spiegarli col modello iconico.
Tutte le reazioni oggetto delle attività delle schede operative possono in effetti essere realizzate in laboratorio - con opportune precauzioni - e alcune anche dalla cattedra. Un ottimo modo per fare tutto ciò, avvicinandosi ulteriormente al movimento e alla “vitalità” del mondo ultramicroscopico, consiste nel fare “reazioni meravigliose” in una goccia e proiettarle con un microscopio USB, o anche con una semplice videocamera. I modelli sistemici delle reazioni saranno così “colorati” con dati percettivi: attraverso la microscala [5] ci si avvicina anche percettivamente alla dinamica molecolare, nella diffusione, crescita di cristalli (Figura 3) e delle bollicine, nel moto browniano, ecc.

Figura 3. Crescita di cristalli di argento su filo di rame
Il modello iconico, in una fase successiva, potrebbe rappresentare sia situazioni intermedie (compresenza di prodotti e reagenti non ancora trasformati ed eventuali intermedi di reazione), sia situazioni “finali” corrispondenti a stati d’equilibrio dinamico (coesistenza di tutte le specie reagenti e prodotte), o situazioni in cui si sviluppano reazioni collaterali. Non servono conoscenze di chimica avanzate (struttura atomica, nomenclatura, legami chimici ecc.) per rendersi conto che nell’arena del sistema chimico, una volta stabilite condizioni e concentrazioni, gli unici attori, registi e decisori di ciò che deve accadere, sono gli atomi con i loro peculiari modi di interagire; non i “bilanciamenti” o la IUPAC. Le attività permettono di sottolineare questo aspetto e prevenire l’idea “teleologica” che gli aggregati atomici “sappiano” fin dall’inizio ciò che dovranno diventare, perché “obbligati” tutti a seguire rigorosamente una certa equazione di reazione correttamente bilanciata. È questa la più diffusa misconcezione tra chi studia chimica di base ed è il risultato di una didattica sbilanciata sul livello formale. Molti docenti credono che solo conoscenze strutturali e concetti chimico-fisici avanzati permetteranno, e solo successivamente, di rispondere alle prime e più elementari domande di senso sulla natura delle reazioni. Per queste risposte basta invece la visione sistemica.
Il concetto di sistema chimico è ciò che fa la differenza tra l’algebra pura dei bilanciamenti e la chimica.
Un esempio banale su tutti, che si legge anche nei problemi degli esami universitari, è costituito dalla frase “quando la reazione raggiunge l’equilibrio…” Il suo significato diventa molto più comprensibile ammettendo che il soggetto che raggiunge l’equilibrio, ossia uno dei suoi possibili stati, è il sistema chimico, con tutte le sue particelle “jiggling and bouncing”, per citare ancora Feynman.
Dall’attività (sperimentata preliminarmente a fine a.s. 2022/23) ci aspettiamo dunque che gli studenti:
- ) pensino al sistema chimico e ai suoi componenti ultramicroscopici, in termini idealizzati, ma non tanto astrattamente quanto è richiesto per l’equazione di reazione;
- ) capiscano che uno stesso sistema chimico può trovarsi in diversi stati e che questi stati subentrano l’uno all’altro in successione temporale; non sono coesistenti come i due membri di un’equazione algebrica o i due piatti di una bilancia;
- ) codifichino con la simbologia chimica i diversi stati e al tempo stesso verbalizzino (matematizzazione e decodifica) i cambiamenti del sistema chimico al livello atomico-molecolare;
- ) capiscano che il modello sistemico iconico e i suoi atomi servono a spiegare le trasformazioni osservate e, almeno in qualche caso, si sforzino di mettere in corrispondenza i fenomeni chimici, osservati o immaginati, con i diversi stati del sistema chimico modellizzato.
Quattro sono i prerequisiti non direttamente trattati dalle attività:
- il concetto di identità di una sostanza, (proprietà, struttura e composizione);
- l’osservazione e la descrizione di evidenze o indizi della formazione/scomparsa di sostanze nelle trasformazioni (esperienza di osservazione e descrizione di trasformazioni chimiche e non);
- i concetti di elemento chimico (diverso da quello di sostanza elementare) e di sostanza composta; gli aggregati atomici, molecole e reticoli continui (definibili contestualmente);
- il modo di indicare la composizione (formula) con indici numerici assoluti (per le molecole) o relativi (per le strutture continue), che può essere anche sviluppato contestualmente.
Le lacune, da colmare con altre attività, includono:
- il fatto che, nel modello iconico dei sistemi chimici, a differenza del sistema “vero”, le molecole del solvente sono omesse per evidenti ragioni di semplificazione;
- per la medesima ragione gli stati di aggregazione non sono rappresentati (se non, parzialmente, quello solido), perché ciò richiederebbe l’utilizzo di numeri eccessivi di atomi-icona;
- per gli alunni con particolari difficoltà, il modo in cui gli aggregati di atomi si modificano può essere illustrato con dei cerchietti di cartoncino simili agli atomi-icona (che sarebbero realmente manipolabili), o con altri modelli solidi (come i mattoncini Lego®).
Tra i prodotti “collaterali” dell’attività si includono i seguenti due punti.
- Le leggi ponderali (sebbene si inverta il processo storico, dagli esperimenti e loro interpretazione alla teoria atomica). Per la legge di Dalton si potrebbe estendere l’attività modificando appositamente una scheda operativa, ma riteniamo che una volta raggiunti gli obiettivi principali dell’attività sarebbe più semplice trattare tutte le leggi ponderali con strategie consuete.
- La “scaffalatura energetica” degli stati. Il modello iconico di sistema chimico è propedeutico a concetti termodinamici, quale la stabilità energetica, che si incontra a un livello più avanzato nello studio della chimica [6]. A parità di temperatura e pressione il contenuto energetico del sistema dipende da come sono aggregati gli atomi che lo compongono. Con gli stessi atomi si possono perciò avere molti stati diversi e trasformazioni (eso/endotermiche) dall’uno all’altro (Figura 4).
Figura 4. Lo stesso sistema può trovarsi a diverse energia ed entalpia a parità di temperatura e pressione a seconda di come sono aggregati gli atomi che lo compongono
Lo stesso sistema chimico costituito da 18 atomi, 2C, 8H, 8O, potrà trovarsi, per esempio nei seguenti stati (Figura 5).
Stato +1 “tutto atomizzato”: C, C, H, H, H, H, H, H, H, H, O, O, O, O, O, O, O, O.
Stato 0 “elementare”: 2C(s); 4H2(g); 4O2(g), posto per convenzione al livello zero di entalpia.
Stato -1 “metano + ossigeno”: 2CH4(g) + 4O2(g).
Stato -2 “parzialmente combusto”: 2CO(g) + 4H2O(l) + O2(g).
Stato -3 “completamente combusto”: 2CO2(g) + 4H2O(l).

Figura 5. Le sostanze elementari C(grafite); O2(g); H2(g) e cinque tra gli stati possibili dello stesso sistema “2C, 8H, 8O” rappresentati con mattoncini Lego® (foto dell’autore)
Gli obiettivi a) e b) sono dunque finalizzati a prevenire il vuoto di significato che si verifica nel primo biennio della scuola secondaria di secondo grado quando gli studenti affrontano equazioni chimiche, bilanciamenti e calcoli stechiometrici. La pratica nella codifica c) serve a fornire uno strumento di sintesi che potrà soppiantare gradualmente le immagini iconiche degli oggetti contenuti nei sistemi chimici, ma potrà anche tradursi, con la pratica, in strumento di decodifica, dalla simbologia dell’equazione di reazione al modello mentale iconico del sistema chimico; processo che _4_corpo-testomente non si può verificare per l’assenza di un qualsiasi modello mentale esplicito e sufficientemente praticato.
Le "normali" equazioni di reazione devono essere trattate dopo queste attività di arricchimento degli strumenti concettuali necessari. Chiarendo che esse si riferiscono esclusivamente al sottosistema delle specie chimiche che si trasformano, per cui non corrispondono a stati effettivi del sistema chimico. La stessa stechiometria vale in presenza di un forte eccesso di un reagente, vale per una reazione accompagnata da altre reazioni parallele, e vale in un sistema che giunge all’equilibrio.
Nel caso della scuola secondaria di primo grado, riteniamo che sia possibile adattare le stesse attività (eventualmente limitando la traduzione nel linguaggio simbolico), assieme all’osservazione di alcune trasformazioni chimiche, e che questo sia più che sufficiente nell’ottica di far comprendere la natura delle reazioni chimiche.
In questo modo si eviterebbero molte misconcezioni comuni. I ragazzi non dovrebbero più pensare che le equazioni di reazione servono per prevedere o “calcolare” i prodotti che devono formarsi, che i coefficienti stechiometrici corrispondano alle quantità aggiunte nel sistema, che il sistema esista solo in due stati: “solo reagenti” e “solo prodotti”.
[1] A. H. Schoenfeld, On mathematics sense making: An informal attack on the unfortunate divorce of formal and informal mathematics, in J. F. Voss, D. N. Perkins, J. W. Segal, Informal reasoning and education, Lawrence Erlbaum Associates Inc., 1991 pp. 311-343.
[2] J. Dalton, A New System of Chemical Philosophy, R. Bickerstaff, Strand, London, 1808, Chap. II, p. 142. Disponibile, in alcuni stralci, come riproduzione da HardPress, Miami (FL), dal sito di Carmen Giunta: https://web.lemoyne.edu/~giunta/ea/daltonann.html (ultimo accesso, novembre 2023).
[3] R. P. Feynman, R. B. Leighton, M. Sands, The Feynman Lectures on Physics, Vol. 1, Masson ed., 1990, Cap.1, pp. 1-3.
[4] G. Villani, L’interpretazione chimica del vivente, Clueb, Bologna, 2023, pp. 14-18.
[5] B. Worley, D. Paterson, Understanding chemistry through microscale practical work, The Association for Science Education, Hatfield (UK), 2021.
[6] A. Tifi, Integrating collaborative concept mapping in case based learning, J. for Educators, Teachers and Trainers, 2013, 4(1), 154-163: https://www.ugr.es/~jett/pdf/vol04(1)_13_jett_tifi.pdf (ultimo accesso: gennaio 2024).
Collegamento alle Appendici (file pdf)
Queste includono istruzioni utilizzate nelle prime sperimentazioni dell’anno scolastico 2022-2023 e le schede operative.
Appendice 1: Sistema chimico e reazioni chimiche. Guida da leggere con gli alunni
Appendice 2: Sistema chimico e reazioni chimiche. Guida per il docente
Appendice 3: Otto schede operative pronte per la stampa, per un totale di 24 attività