Indice
Abstract. An alternative to the implementation of the classic lab notebook is proposed, in which visualization and schematization strategies are carried out in the inclusive view toward students preferring pencil over pen, drawing over text. Everything is included in a Green Organic Chemistry pathway, based on the carbonyl compounds and related aldol synthesis.
Keywords: sketchnotes; condensazione aldolica; green chemistry
L’idea di realizzare una sintesi green durante il percorso laboratoriale nella mia classe quarta “Chimica e Materiali” è scaturita in seguito al corso di aggiornamento per docenti della Scuola Nazionale di Didattica della Chimica “Giuseppe del Re” [1]tenuta nella splendida cornice di Bertinoro, dove frequentai il laboratorio dedicato alla Chimica Organica Green I e II (a cura di Luigi Fabbrizzi e Sandro Jurinovich). Durante il suddetto laboratorio vennero illustrati i principi della Green Chemistry e la loro applicazione in diverse reazioni di chimica organica, tra cui la sintesi che verrà esposta in questa trattazione. Contestualmente, prende sempre più forma e consistenza la mia convinzione riguardo alle enormi potenzialità didattiche che il visual thinking offre ai ragazzi che si trovano a dover compilare il quaderno di laboratorio, durante le esperienze che affiancano la parte teorica.
Il quaderno è uno strumento che descrive il flusso di lavoro. Raccoglie i dati sperimentali connessi a una data reazione chimica che va intesa come riproducibile da parte di qualsiasi operatore. Il quaderno stesso diventa un manuale da consultare e una guida per chiunque intenda svolgere la reazione in esame.
La compilazione del quaderno è spesso eseguita in maniera superficiale e affrettata dalla maggior parte degli studenti che non arrivano a considerare l’importanza del loro “racconto” come guida facilitatrice per altri chimici che vogliano approcciare la stessa reazione. Su questa base, da alcuni anni, invito i miei studenti a usare lo strumento del disegno e del fumetto per poter arrivare a descrivere ciò che svolgono in laboratorio in maniera visuale, mentre il testo risulta sempre insufficiente e poco efficace. La rappresentazione visuale risulta di per sé più veloce e chiara nella descrizione, soprattutto per quanto riguarda le sequenze operative di una reazione di sintesi, costringe lo studente a porre un’attenzione maggiore ai fenomeni e lo aiuta a fissare in maniera più duratura le procedure. Il quaderno risulta personalizzato e inevitabilmente più curato. Da anni, in accordo con l’insegnante tecnico-pratico, non viene richiesta più la relazione sull’attività, ma un’adeguata compilazione del quaderno personale, che viene periodicamente revisionato e commentato. Questo modo di procedere si accompagna, chiaramente, a una occasionale richiesta di restituzione dati, qualora la prova lo consenta, al termine delle due ore di laboratorio.
L’introduzione del disegno nel quaderno di laboratorio nasce, in primis, dalla scoperta dello strumento visual thinking e di uno dei suoi maggiori utilizzatori in campo scientifico, Jacopo Sacquegno, un giovane biologo molecolare che ha saputo unire queste sue competenze in una vera e propria professione, appunto lo sketchnoter [2]. In questa sede riporto quindi gli esiti della sintesi aldolica condotta nella mia classe quarta di chimici, durante l’anno scolastico 2022-23, riportando quelle che sono le conclusioni dal punto di vista didattico anche in un’ottica “visuale”, a partire dai quaderni dei miei studenti.
La sintesi del 4-metossicalcone (vedi schema in figura 1) è stata svolta in laboratorio durante la trattazione dei composti carbonilici [3], insieme all’analisi dei dodici principi della Green Chemistry [4] su cui è stato svolto il lavoro di approfondimento, descritto nella sessione di restituzione della Scuola Nazionale di Didattica della Chimica “Giuseppe del Re”, prima citata.
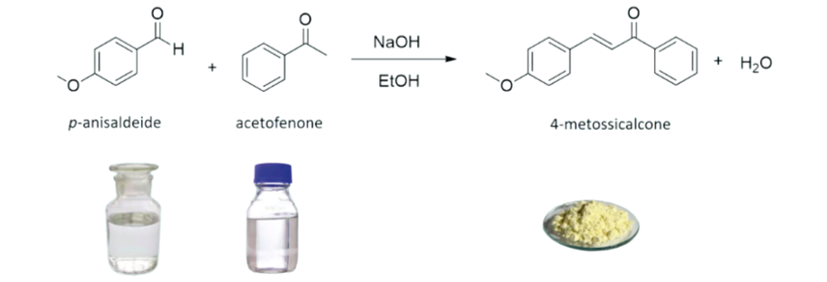
Figura 1. Schema della sintesi eseguita
La sintesi in oggetto ha indubbi vantaggi: tra tutti, la possibilità di poter far svolgere la prova ai ragazzi in completa autonomia, data la bassa pericolosità associata alla procedura, e l’alta resa che, si sa, incoraggia sempre molto gli studenti. La prova può essere svolta agevolmente durante la lezione di laboratorio, che solitamente comprende due moduli orari, o al più, dovendo seccare il prodotto, può essere conclusa nella lezione successiva, che può essere dedicata anche a una discussione di gruppo sull’esito e sulle osservazioni (ad esempio, punto di fusione e purezza, aspetto delle TLC nei vari intervalli di tempo).
L’analisi qualitativa si basa principalmente sul punto di fusione che gli studenti padroneggiano già dalla classe terza; la cromatografia su strato sottile, in questa prova, si svela in tutta la sua potenzialità, poiché gli studenti la utilizzano per valutare i tempi di reazione e la purezza del prodotto che ottengono.
La reazione è molto veloce e può essere condotta “in piccolo” con minime quantità di reagenti, a freddo e con la sola agitazione. La condensazione si svolge quasi istantaneamente tra la p-anisaldeide e l’acetofenone, secondo la procedura di seguito riportata.
- In una beuta, munita di ancoretta magnetica, sciogliere 3,0 ml (0,025 moli) di p-anisaldeide e 2,9 ml (0,025 moli) di acetofenone in 10 ml di etanolo; quindi aggiungere 1 ml di NaOH 4 M (la soluzione da incolore vira subito al giallo).
- Dopo circa 30’ determinare il grado di avanzamento della reazione in TLC (254 nm) con una miscela di eluenti (esano e acetato di etile rispettivamente nel rapporto 7:3).
- Al termine della reazione, porre la miscela in un bagno di ghiaccio per favorire la formazione dei cristalli di prodotto; filtrare poi i cristalli su Büchner, lavare con etanolo freddo (goccia a goccia) e asciugare all’aria.
- Determinare il punto di fusione del prodotto ottenuto (77-78 °C), per verificare la purezza, e calcolare la resa di reazione.
4.1 Quaderno di laboratorio, monitoraggio della reazione e analisi dei prodotti
In figura 2 sono riportate le fotografie del quaderno di laboratorio di un alunno che ha colto subito l’occasione per esprimere la sua passione per il disegno e per la chimica rappresentando la procedura della sintesi richiesta.

Figura 2. Esempio di quaderni di laboratorio degli studenti
Gli studenti, inoltre, hanno ragionato sulle TLC svolte nelle varie fasi della reazione di sintesi (Figura 3). La cromatografia su strato sottile è, infatti, uno strumento di grande utilità didattico-pratica perché consente ai ragazzi di seguire con attenzione l’avanzamento di una reazione e fare delle ipotesi sulla reattività delle molecole coinvolte.
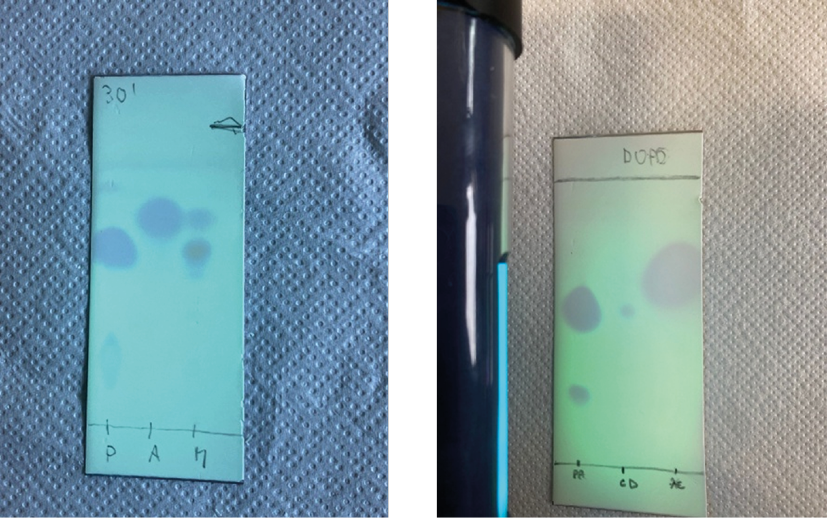
Figura 3. Foto delle lastrine da TLC riferite alla miscela di reazione (sinistra) e al prodotto dopo filtrazione (destra)
Come si può dedurre dalle lastrine eseguite dagli studenti, dopo 30’ dall’inizio della reazione, il prodotto è ben visibile essendo colorato di giallo, ma permane ancora dell’acetofenone nella miscela di reazione (Figura 3, sinistra, M è la miscela di reazione), che scompare dopo filtrazione del prodotto (Figura 3, destra, CA-calcone presenta un solo spot). L’acetofenone non reagito, essendo liquido, è stato separato dalla miscela di reazione.
Interessante sarebbe poter effettuare uno spettro IR del prodotto di reazione o, al più, discutere quelli presenti in letteratura su sintesi analoghe [5].
4.2 Calcoli delle metriche di Green Chemistry
Gli studenti, inoltre, hanno svolto i calcoli necessari per poter ottenere tre metriche fondamentali per valutare l’impatto green della reazione: la resa di reazione, l’atom economy (AE) e l’environmental factor (E-factor). I calcoli mostrati di seguito si riferiscono a un gruppo di lavoro.
Resa % di reazione
Dalla massa di prodotto ottenuta, mcalcone = 4,00 g, si può facilmente calcolare la resa di reazione
Atom Economy %
L’atom economy è un parametro che permette di quantificare quale percentuale degli atomi dei reagenti viene davvero incorporata nel prodotto desiderato e quale invece va sprecata; in altre parole, quantifica se stiamo utilizzando nel modo più proficuo possibile tutti gli atomi dei reagenti. Il parametro si calcola facendo il rapporto tra la massa molare del prodotto e quella di tutti i reagenti utilizzati.
Nel nostro esempio, l’atom economy risulta:
E-factor
L’environmental factor, indica il rapporto tra la massa totale di rifiuti e la massa di prodotto ottenuta nella reazione [6]. Con la massa totale di rifiuti si intendono tutte le sostanze e i solventi coinvolti nel processo che costituiscono un rifiuto da smaltire al termine della reazione (ad es., solventi utilizzati, reagenti non reagiti, eventuali sottoprodotti, ecc.).
Tabella 1. Masse delle sostanze utilizzate nel calcolo di E-factor
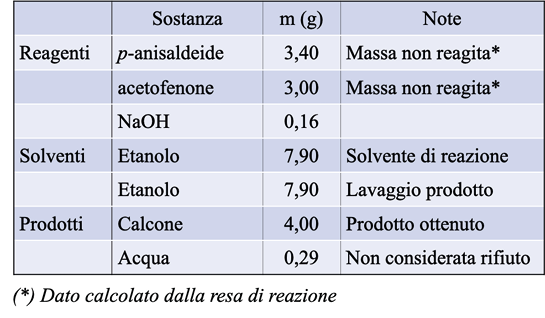
Con i dati riportati in Tabella 1 si può calcolare l’E-factor della reazione.
Nel termine mreagenti includiamo la p-anisaldeide, l’acetofenone, l’NaOH e l’etanolo, utilizzato sia come solvente di reazione che come solvente di lavaggio, mentre il prodotto di interesse è il calcone (tra i rifiuti non abbiamo considerato la massa di acqua che si forma dalla reazione):
Per la nostra reazione abbiamo ottenuto un E-factor di 4,52 e, quindi, possiamo dire che per ogni grammo di prodotto ne abbiamo circa 5 di scarto. In generale, l’obiettivo di una sintesi green è anche quello di minimizzare il valore di E-factor, in quanto più questo valore è basso, minore è la percentuale di scarti che devono essere poi smaltiti.
4.3 Feedback sull’attività svolta
A seguire, alla classe è stato somministrato un questionario (Google Moduli) sull’attività svolta, di cui si riportano di seguito i risultati.
Domande del questionario somministrato agli studenti
- Perché esiste la chimica verde?
- Ti è piaciuta la prova di sintesi del metossicalcone?
- Dal punto di vista cinetico, come puoi definire la reazione che hai condotto?
- Da cosa hai desunto che la reazione si fosse innescata?
- Quali informazioni hai potuto trarre dall’esecuzione delle cromatografie su strato sottile?
- In cosa differiscono le TLC effettuate prima e dopo la filtrazione e perché?
- La sintesi dell’aspirina è più o meno green della sintesi del metossicalcone e perché?
- È possibile, secondo te, che avvengano side reactions e perché?
Analisi delle risposte al questionario
La premessa che occorre fare è che il questionario è stato somministrato senza una restituzione collettiva in classe della prova svolta e i risultati dimostrano che, in realtà, la classe non ha compreso con efficacia ciò che sottende alla prova, almeno non in tutti i suoi aspetti.
Dall’analisi delle risposte sono emerse le seguenti criticità:
- è poco chiaro l’aspetto cinetico della reazione, cosa significhi reazione lenta/veloce;
- altrettanto poco chiaro è l’aspetto relativo alla formazione del prodotto rispetto all’innesco della reazione (secondo gli studenti la reazione si innesca solo se si forma il precipitato, il cambio di colore della miscela di reazione non è sufficiente!);
- Il concetto di reazione green è visto dagli studenti primariamente legato alla natura di reagenti e prodotti; non è ancora chiaro il concetto globale della Green Chemistry in tutti i suoi aspetti.
Sono, comunque, emersi dei punti di forza:
- gli studenti traggono grande stimolo dalle reazioni di sintesi e successiva caratterizzazione qualitativa dei prodotti;
- hanno chiaro quelli che sono gli obiettivi della chimica verde all’interno del mondo della sostenibilità ambientale che permea molte delle discipline che studiano;
- l’esecuzione delle cromatografie su strato sottile ha innescato un ottimo dialogo di confronto tra gli alunni che ne hanno colto immediatamente l’aspetto qualitativo legato al grado di avanzamento della reazione che stavano svolgendo;
- è chiaro il concetto di side-reactions e di come uno stesso reagente possa >essere coinvolto in più di una reazione possibile.
Le conclusioni al termine del percorso svolto vanno divise rispetto alle due tematiche affrontate: l’aspetto green di una reazione di sintesi organica e l’approccio “visual” nella compilazione del quaderno.
Aspetto green di una reazione di sintesi organica
Indubbiamente la sintesi proposta soddisfa in gran parte quelli che sono i dodici principi della Green Chemistry, in termini di:
- elevata economia atomica (93%)
- il basso dispendio energetico
- l’utilizzo di reagenti a bassa tossicità
- la possibilità di svolgere la sintesi in piccolo
- nessuna purificazione necessaria
- l’alta resa (68%)
- il moderato environmental factor (4,52)
Approccio visual nella compilazione del quaderno
«Il Visual Thinking è un approccio che permette di visualizzare e organizzare idee e concetti disegnando parole, sketch, diagrammi e mappe. Uno strumento efficace per individuare i concetti chiave, creare connessioni tra di essi, generare riflessioni e ispirare intuizioni; essa, combinando verbale e visuale si rivela molto efficiente (per la rapidità di rappresentare concetti complessi con delle immagini rispetto a descriverli a parole) ed efficace (per l’unione di verbale e visuale) per la memorizzazione a lungo termine, la comprensione dei concetti e la connessione delle idee» [2].
La visualizzazione del flusso di passaggi che vengono svolti durante una reazione di sintesi organica è risultata più efficace e apprezzata dagli studenti, che hanno dimostrato passione e cura verso la narrazione grafica del loro lavoro, accompagnata certamente da note e osservazioni, rispetto alla stesura classica del quaderno in forma verbale-descrittiva. Visualizzare – schematizzare – riflettere – comunicare – assorbire: secondo questa sequenza lo studente affronta l’attività sperimentale e ne fa una descrizione sul proprio quaderno di laboratorio. Ciò implica un maggiore coinvolgimento dello studente nello svolgimento della prova, un’analisi più approfondita e accurata [7] dei fenomeni e uno “storage” a medio-lungo termine delle procedure.
La passione per il visuale mi porta a curare io, in primis, ciò che accompagna le mie lezioni, le mie lavagne innanzitutto, nel tentativo di rendere meno pesante lo sforzo cognitivo dei miei studenti nel comprendere ciò che rappresento, per esempio, se spiego la reattività di un gruppo funzionale; gli spazi, i colori, le dimensioni di ciò che si descrive può rendere la codifica e la comprensione certamente più agevoli, soprattutto se si tratta di affrontare materie quali la chimica organica, dove tutto è frecce e molecole che condensano, sommano, eliminano, ramificano.
[1] https://www.soc.chim.it/it/node/3002
[2] https://jacoposacquegnographics.wordpress.com/
[3] H. Hart, L. E. Craine, D. J. Hart, Chimica Organica (settima edizione), Zanichelli, Bologna, 2012.
[4] T. Anastas, J. C. Warner, Green Chemistry: Theory and Practice, Oxford University Press, 2000.
[5] C. A. M. Afonso, et at., Comprehensive Organic Chemistry Experiments for the Laboratory Classroom, The Royal Society of Chemistry, 2016.
[6] R. A. Sheldon, The E-factor 25 years on: the rise of green chemistry and sustainability, Green Chemistry, 2017, 19, 18-43.
[7] M. M. Cooper, M. Stieff, D. DeSutter, Sketching the invisible to predict the visible: from drawing to modeling in Chemistry, Topics in Cognitive Science, 2017, 9, 902-920.