
Gli atti del Congresso di Karlsruhe del 1860
Maurizio D’Auria
Dipartimento di Scienze dell’Università della Basilicata
e-mail: maurizio.dauria@unibas.it
Indice
Abstract. During 1860 in Karlsruhe Kekulè organized an important chemistry congress with the hope to solve some problems related to the nature of atom and molecules. In this congress Stanislao Cannizzaro presented his results collected in the
Keywords: Congresso dei chimici di Karlsruhe; Kekulè; Wurtz; Cannizzaro; Atti; Giua
Qualche tempo fa ho potuto acquistare in rete un vecchio libro. Il titolo mi intrigava, l’autore rappresentava una sicurezza. Il libro era Storia della Chimica di Michele Giua, edito da Chiantore nel 1946. Si trattava di un libro mai più edito dopo questa prima edizione. A pag. 149 del testo, parlando del Congresso di Karlsruhe, si fa riferimento agli atti di questo convegno, pubblicati nel 1929 da Anschütz nell’ambito di un testo dedicato a Kekulé. Il documento era stato tradotto da M. Giua e pubblicato in italiano sulla Rivista di Chimica Scientifica ed Industriale nel 1930 [1]. Rivestendo quel documento un certo interesse, non solo da un punto di vista storico, ma anche quale possibile strumento didattico, ho cercato di recuperare l’articolo e poi ho chiesto a CnS se volesse pubblicarlo. Quello che segue è la riproduzione degli atti tradotti da Giua.
Dopo aver letto il documento sono costretto a fare alcune riflessioni sul modo in cui abbiamo descritto quello che era successo in questo congresso. Una certa vulgata ci racconta che Cannizzaro in questa sede portò il suo articolo (Sunto di un Corso di Filosofia Chimica) pubblicato sul Nuovo Cimento, ma che le sue osservazioni furono accolte con una certa freddezza, tanto che occorse del tempo per permettere alle sue vedute di prevalere nell’ambito della disciplina. Questo quadro è avvalorato anche dal fatto che nel 1871 Cannizzaro stesso ritenne opportuno ritornare sul problema al fine di correggere interpretazioni sbagliate [2].

Vediamo come abbiamo rappresentato il convegno di Karlsruhe e i suoi esiti nei testi di storia che ho a disposizione nella mia libreria (questi possono rappresentare il grado di conoscenza storica di un chimico medio). Prima di tutto: questo resoconto è stato utilizzato come fonte? Il saggio di Cerruti che accompagna l’edizione palermitana del Sunto ricostruisce le vicende del congresso di Karlsruhe utilizzando con molta efficacia il verbale che qui viene riprodotto, probabilmente ripreso dall’originale [3]. Si tratta di una descrizione estremamente dettagliata e puntuale degli avvenimenti connessi al convegno. Personalmente penso che debba essere il punto di partenza per ogni riflessione in merito. Anche Di Meo riporta fedelmente l’intervento di Cannizzaro al convegno di Karlsruhe, preso da un lavoro di Nasini, ma in questa forma appare sganciato dal contesto in cui quell’intervento era stato fatto [4].
Per quanto attiene alla valutazione degli esiti del convegno, nella Storia della Chimica di Gaudiano si legge: “La proposta di C. non fu generalmente apprezzata, e forse neanche ben capita” [5]. Una posizione simile viene presa da Torracca che scrive: “Gli interventi di Cannizzaro in favore del sistema unitario furono tra i più convincenti e apprezzati della conferenza, ma non avrebbero forse avuto altro seguito se alla fine dei lavori l’altro italiano presente a Karlsruhe […] non avesse distribuito gli estratti di un lavoro dell’amico apparso due anni prima […]” [6]. Questo tipo di interpretazione la si ritrova sia su Wikipedia (“Il Congresso di Karlsruhe si concluse senza un accordo definitivo sul problema dei pesi atomici e molecolari. Tuttavia, l’ultimo giorno del congresso vennero distribuite le ristampe di una pubblicazione del 1858 di Stanislao Cannizzaro sui pesi atomici, in cui lo scienziato utilizzò il lavoro precedente di Amedeo Avogadro. Gli sforzi di Cannizzaro esercitarono una forte e, in alcuni casi, alquanto immediata influenza sui delegati” [7]), che nell’interpretazione data da A. M. Maggio e R. Zingales, che scrivono: “L’intervento di Cannizzaro non convinse tutti i congressisti, ma quelli che lessero il Sunto ne rimasero profondamente colpiti. […] Cannizzaro diede un contributo sostanziale, fornendo un metodo per la determinazione dei pesi atomici e mettendo a disposizione dei chimici i dati indispensabili per formulare la teoria della valenza e individuare la periodicità delle proprietà degli elementi” [8]. Anche Cerruti fa notare come Cesare Pavesi avesse già prima del Congresso di Karlsruhe data ampia diffusione del testo del Sunto di Cannizzaro e che, quindi, fosse ben noto sia a Kekulé che a Wurtz [9].
Solov’ev, invece, dà un’interpretazione entusiasta circa l’esito del convegno: “Particolare successo ebbe al Congresso la relazione di Cannizzaro, intervenuto calorosamente in difesa del principio di Avogadro, esponendo in modo estremamente chiaro e convincente il giusto sistema di determinazione dei pesi molecolari e atomici basato sulla misura della densità di vapore e sulla determinazione della composizione ponderale dei composti di un o altro elemento” [10]. Che l’effetto sui presenti al Congresso degli interventi di Cannizzaro fossero rilevanti è bene espresso da Ciardi che riporta con attenzione le note positive che l’intervento di Cannizzaro ebbe sugli scienziati presenti [11].
Il quadro che esce dalla lettura degli atti mostra in tutta la sua importanza il ruolo decisivo svolto da Cannizzaro nel determinarne gli esiti. Gli atti riportano in relativo dettaglio gli interventi di Kekulé, che era stato l’ispiratore del congresso, ma soprattutto viene riportato in dettaglio un intervento di Cannizzaro, dimostrando come da subito l’interesse del convegno si sia concentrato su quello che il nostro rappresentante ebbe a dichiarare. Il ruolo di Cannizzaro appare determinante al fine di comprendere gli esiti del congresso stesso. Forse questa impressione deriva dal fatto che Cannizzaro fu l’unico a inviare il riassunto esteso del suo intervento. È vero che la deliberazione contro cui Cannizzaro si scaglia non verrà votata, ma verrà votata una mozione “tecnica”, relativa ai pesi atomici di alcuni metalli, che di fatto era prodromica all’accettazione dell’impostazione al problema data da Cannizzaro stesso.
La lettura di questo testo può essere utile per far comprendere a uno studente lo stato di confusione in cui versava la Chimica intorno al 1860. Permette, inoltre, di comprendere i meccanismi non solo scientifici, ma anche umani che portano gli scienziati a preferire un’interpretazione dei dati scientifici, permette di comprendere la difficoltà che una persona può incontrare a modificare le proprie vedute, permette infine di comprendere come, in ambito scientifico, una dottrina può lentamente prevalere.
Concludendo questa mia breve introduzione, un’altra osservazione che mi sento di fare è relativa a chi ha tradotto questo testo. Su Michele Giua sono stati scritti alcuni articoli importanti sia su La Chimica e l’Industria [12] che su CnS [13], per cui non mi dilungherò. Vale però la pena di notare che questo chimico, uno dei pochissimi che non giurò fedeltà al fascismo (cosa che gli costò il posto di professore all’Università di Torino), che visse successivamente facendo il libero professionista, incarcerato dal Tribunale Speciale dal 1935 al 1943, in clandestinità fino alla fine della guerra, nel 1945 pubblica le memorie della sua prigionia, ma anche una Storia della Scienza ed Epistemologia e nel 1946 una Storia della Chimica, estremamente chiara e documentata. Questo dimostra che Giua (che sarà poi membro della Costituente e senatore) durante la sua prigionia aveva continuato ad occuparsi attivamente dei problemi connessi all’attività scientifica e che, forse, proprio il mantenimento di questa attività intellettuale gli aveva permesso di sopravvivere a otto anni di una detenzione ingiusta.
2. Rendiconto delle sedute del Congresso Internazionale dei Chimici tenuto a Carlsruhe il 3, 4 e 5 settembre 1860
L’idea di proporre la convocazione di una riunione internazionale di chimici è stata di Kekulé. Durante l’autunno del 1859 egli ebbe occasione di conferire in proposito dapprima con Weltzien e poi con Wurtz.

Questi tre scienziati, riunitisi a Parigi verso la fine del marzo del 1860, si accordarono sui preliminari per effettuare il progetto in questione e, allo scopo di raccogliere le adesioni dei chimici più rappresentativi, redassero una prima circolare (in francese, tedesco ed inglese), nella quale, in linea generale, si mettevano in evidenza le divergenze esistenti nelle vedute teoriche dei chimici, e la necessità di prendere degli accordi. Poiché questo primo appello fu accolto con favore, si stabilì l’epoca e il luogo della riunione, inviando la seguente circolare.
Parigi, 15 giugno 1860
Egregio collega,
Il grande sviluppo fatto dalla chimica in questi ultimi anni e le divergenze che si sono manifestate nelle opinioni teoriche, rendono opportuno ed utile un Congresso che abbia per iscopo la discussione di alcune questioni importanti dal punto di vista dei progressi futuri della scienza.
I sottoscritti convocano a questa riunione tutti i chimici che per i loro lavori o la loro posizione possono prendere deliberazioni obbligatorie per tutti; ma con una discussione libera e approfondita può togliere alcuni malintesi e render facile un comune accordo sopra alcuni dei punti che seguono:
Pur senza avere la speranza che le deliberazioni dell’assemblea siano tali da conciliare tutte le opinioni e da far svanire tutti i dissidii, i sottoscritti pensano tuttavia che esse possano preparare nell’avvenire un accordo fra i chimici, almeno per quel che concerne le questioni più importanti. Una commissione potrà essere incaricata di proseguire lo studio di queste questioni, interessando Accademie e Società scientifiche che dispongono dei mezzi necessari per risolverle.
Il Congresso si riunirà a Carlsruhe il 3 settembre 1860.
Il collega Weltzien, professore al Politecnico di questa città, assume le funzioni di commissario generale; a causa di ciò, riceverà le adesioni dei membri futuri del Congresso e il giorno indicato, alle ore 9 del mattino, aprirà l’assemblea.
Allo scopo di evitare spiacevoli omissioni, i sottoscritti pregano le persone alle quali viene indirizzata questa circolare di comunicarla agli amici scienziati.
Babo, Freiburg; Balard, Parigi; Beketoff, Kansan; Boussingault, Parigi; Brodie, Oxford; Bunsen, Heidelberg; Bussy, Parigi; Cahours, Parigi; Cannizzaro, Genova; Deville, Parigi; Dumas, Parigi; Engellhardt, Pietroburgo; Erdmann, Lipsia; Fehling, Stoccarda; Frankland, Londra; fremy, Parigi; Fritzsche, Pietroburgo; Hoffmann, Londra; Kekulé, Gand; Kopp, Giessen; Hlasiwtz, Innsbruck; Liebig, Monaco; Malaguti, Rennes; Marignac, Ginevra; Mitscherlich, Berlino; Odling, Londra; Pasteur, Parigi; Payen, Parigi; Pebal, Vienna; Peligot, Parigi; Pelouze, Parigi; Piria, Torino; Regnault, Parigi; Roscoe, Manchester; Schrötter. Vienna; Socoloff, Pietroburgo; Staedeler, Zurigo; Stas, Bruxelles; Strecker, Tubinga; Weltzien, Carlsruhe; Will, Giessen; Williamson, Londra; Wöhler, Gottinga; Wurtz, Parigi; Zinin, Pietroburgo.
NB. – Le adesioni vanno inviate direttamente a Weltzien (Potitecnico, Carlsruhe), oppure a Kekulé, professore di chimica a Gand, che le trasmetterà poi a Weltzien.
Il numero degli aderenti fu considerevole e il 3 settembre 1860, 140 chimici1 si riunirono nella sala delle sedute della Seconda Camera degli Stati, locale che S. A. R. il Granduca di Baden mise a disposizione del Congresso.
Prima seduta del Congresso
Weltzien, commissario generale, apre la prima seduta col discorso seguente:
Signori,
Come presidente provvisorio ho l’onore di inaugurare un Congresso, di cui mai per lo innanzi si era visto l’eguale.
In realtà dal 1822, per incitamento di Ohen2 dietro l’esempio dei Congressi svizzeri, scienziati e medici tedeschi si riunirono quasi ogni anno a congresso nelle varie città della loro patria. L’esempio fu imitato dagli inglesi, francesi e negli ultimi anni anche dagli scandinavi.
Questi tuttavia sono studiosi, che pur dedicando le loro energie ai diversi rami delle scienze naturali, appartengono sempre ad una medesima Nazione.
L’attività scientifica di queste riunioni consiste principalmente in conferenze, che vengono tenute da ogni singolo cultore sui proprii lavori, l’argomento dei quali non è legato ad alcun programma prestabilito.
Uno scambio attivo, amichevole, rallegrato da una serie di feste, riunisce per diversi giorni gli scienziati e i medici affini per l’origine e per la lingua.
Non così questo Congresso.
Per la prima volta si sono riuniti i cultori di una scienza sola, e la più giovine di tutte: questi cultori appartengono però a quasi tutte le nazionalità. Noi apparteniamo a razze diverse, parliamo lingue diverse, ma siamo affini perché coltiviamo la medesima scienza e ci lega un interesse scientifico e ci riunisce lo stesso fine.
Noi siamo qui raccolti per lo scopo ben stabilito, di cercare di trovare una via unica in alcune questioni capitali per questa nostra bella scienza.
Nello sviluppo straordinariamente rapido della chimica, specialmente nella abbondante raccolta del materiale sperimentale, le idee teoriche dei ricercatori e le espressioni in parole e simboli sono andate molto al di là di ciò che si richiede per una comprensione reciproca e soprattutto di ciò che è utile per l’insegnamento. Per l’importanza che la chimica ha per gli altri rami delle scienze naturali, per il fatto di essere essa indispensabile per la tecnica è grandemente desiderabile dare ad essa una forma più esatta, affinché sia possibile apprenderla scientificamente in tempo più breve.
Per raggiungere questo scopo non c’era bisogno di essere costretti a proporre diverse vedute e modi di scrivere in cui le differenze hanno poca sostanza, né di caricarsi con una nomenclatura, a cui con una massa di simboli non necessari manca per lo più ogni base razionale e che, per accrescere l’equivoco, deriva in massima parte da una teoria, che ora è scarsamente valida.
La partecipazione numerosa a questo Congresso è ben un segno evidente che questi inconvenienti sono ammessi da tutti e che è fortemente desiderabile l’eliminarli per raggiungere un punto di vista unico. Il raggiungimento di questo scopo è un premio così bello, che val bene la pena di tentare di raggiungerlo.
L’idea di un Congresso di chimici mi fu espressa già da molto tempo dal collega Kekulé. Questa primavera io feci i primi passi per realizzarla. Da più parti si riconobbe maturo il tempo per il tentativo, per ogni dove incontrai una adesione calorosa, sì che io non dubito che questo Congresso sarà destinato a stabilire un periodo importante per la nostra scienza.
La città di Carlsruhe, che or sono due anni ebbe la fortuna di ospitare uno dei più brillanti Congressi di scienziati e medici, ha ora l’onore di veder riunito nelle sue mura il I Congresso Internazionale dei Chimici.
Carlsruhe è la capitale di un paese piccolo ma benedetto, in cui sotto un principe di spirito elevato ed un governo liberale fioriscono le scienze e le arti e i cultori di queste, stimati ed appoggiati, possono seguire la loro vocazione con gioia ed amore.
Mentre dò loro il benvenuto in questa città non dubito che la stessa letizia penetri in queste riunioni e che un giorno la scienza possa riandare con soddisfazione a questo Congresso.
Dopo questo discorso il commissario generale invita Bunsen ad assumere la presidenza; questi rifiuta e prega l’assemblea di dare a Weltzien l’incarico di dirigere questa prima seduta, ciò che l’assemblea approva. Wurtz, Strecker, Kekulé, Odling, Roscoe e Schishkoff sono incaricati delle funzioni di segretari. Kekulé prende la parola ed espone il seguente programma.
Preparazione letterale di Kekulé al suo discorso nella prima seduta del Congresso Internazionale di Carlsruhe del 18603
Non diritto. Obbligo.
Due parole sullo scopo intravisto e mezzi per raggiungerlo.
Dalle generalità ad un invito.
Essenzialmente: stabilire un accordo o preparare su questioni di forma.
Anzitutto un paio di osservazioni.
A questo punto indulgenza.
Io il più giovane – ad uomini così sperimentati ecc. – oso.
A me sembra:
1. Per la natura della questione, esclusa la comunicazione di fatti nuovi, se non sono in diretto rapporto con le questioni generali da trattarsi.
2. Vorrei pregare.
Parlare il più possibile. Specialmente quei colleghi la cui opinione non coincide:
a. La riunione, come tale, non ha una idea prestabilita.
b. Anzi ponderare il pro e il contro.
3. Inoltre non dimenticare che si tratta solo di opinioni.
4. Infine appena necessario osservare – ciò che è stato espresso già nel primo programma.
Potrei dire un voto vero e proprio senza senso e scopo. Ma potrebbe esser posta la questione se forse (o sempre o nei singoli casi) è adatto allo scopo constatare dalla raccolta dei voti se ecc. ecc. in favore.
… Confesso che ciò mi sembra presentare difficoltà nell’esecuzione e non utilità. Si potrebbe perciò proporre in ogni caso non come principio – tutto al più nei casi che possibilmente si verificano e quindi per proposta speciale.
Al contrario votazione in questioni dell’ordinamento programmatico.
Dopo queste osservazioni preliminari, alla questione.
Scopo principale accordo sulla questione di forma.
È noto a tutti come ciò sia necessario e rispondente allo scopo.
Ad ottener ciò si offrono due vie.
I. Trattare direttamente le singole questioni speciali.
II. Con considerazioni generali, più teoriche, preparare una discussione in proposito.
Così di frequente che una preparazione più lunga faciliti il lavoro. A me sembra che questo sia il caso.
Mi sia permesso di considerare quali questioni, e nella teoria e nella forma, potranno possibilmente esser discusse. E quindi vedere quale di esse può essere ora sottoposta ad una discussione più minuziosa con previsione di successo (soluzione).
Sotto I si potrebbe:
Questione importante a causa del senso delle formule razionali.
Ora ciò che riguarda questioni di forma.
Tra queste questioni, che con una giusta interpretazione sembrano comprendere tutto, ciò che presentemente potrebbe esser discusso, ve ne sono alcune evidentemente insolubili al presente.
Per es. la nomenclatura.
Altre al contrario sembrano risolvibili.
Sarebbe opportuno anzitutto limitare la discussione a queste ultime.
Primo.
1) I e II proposto di riunirli in una sola cosa.
Secondo.
5) Riunire forse con III.
Resta ancora da dire in qual modo può raggiungersi una soluzione. Secondo la mia opinione e l’opinione di molti colleghi con cui ho parlato: da una discussione immediata in assemblea plenaria si avrebbero scarsi risultati.
Meglio una specie di Comitato che discuta le questioni e quindi nella prossima seduta esponga il pro e il contro. Così prepara ed introduce la discussione.
Se mi è permesso di far proposte nella composizione di questa Commissione:
Bureau completato.
Io non posso assolutamente pretendere e non credo neppure di aver esaurito in alcun modo l’argomento e oserei perciò di chiedere ai membri del Congresso di proporre altre questioni. È più opportuno che esse siano presentate per iscritto al Bureau; da questo comunicate al Congresso e quindi, se il Congresso decide per una discussione, assegnate ad una Commissione.
Infine prego che si discuta su queste mie proposte.
Erdmann insiste sulla necessità di deliberare su questioni di forma anziché su punti determinanti di dottrina. Dopo alcune osservazioni di Fresenius, Kekulé, Wurtz, Boussigault, Kopp propone, e l’assemblea approva, che la Commissione tenga le sue sedute a porte chiuse.
Prima seduta della Commissione sotto la presidenza di H. Kopp
La Commissione si riunisce il 3 settembre alle 11 sotto la presidenza di H. Kopp. Il presidente propone di iniziare la discussione sulla nozione di molecola e d’atomo e invita Kekulé e Cannizzaro, i cui studi vertono specialmente sulla questione, a riferire in proposito.
Kekulé insiste sulla necessità di distinguere la molecola dall’atomo e, almeno in principio, la molecola fisica dalla molecola chimica.
Cannizzaro non può concepire il concetto di molecola chimica. Per lui non esistono che le molecole fisiche e la legge d’Ampere e d’Avogadro è la base delle considerazioni relative alla molecola chimica. Questa non è altro che la molecola gassosa.
Kekulé pensa al contrario che solo i dati chimici debbono servire di base a definire e determinare la molecola (chimica) mentre le considerazioni fisiche non debbono essere prese in considerazione che per il controllo.
Strecker fa osservare che in certi casi l’atomo è identico alla molecola, come per l’etilene.
Wurtz dice che l’ossigeno e gli elementi biatomici in generale, essendo comparabili all’etilene, si può essere in imbarazzo nel definire la molecola chimica di questi corpi. Le considerazioni fisiche conducono a considerarle come molecole formate da due atomi, ma finora nessun dato chimico sembra favorire questo raddoppiamento.
Riassumendo la discussione, Kopp dice che sembra evidente la necessità di separare la nozione di molecola da quella di atomo, che la nozione di molecola si può stabilire per mezzo di considerazioni puramente chimiche e che non è necessario per questa definizione prendere in considerazione la densità; infine sembra ovvio denominare molecola la quantità più grande, atomo la quantità più piccola. Terminando l’oratore propone all’assemblea il primo quesito: «È conveniente fare una distinzione fra i termini molecola e atomo, di denominare molecole le quantità più piccole dei corpi che prendono parte ad una reazione o che si formano e che possono compararsi per ciò che concerne le qualità fisiche, di denominare atomi le quantità più piccole dei corpi che sono contenute nella molecola?»
Fresenius richiama l’attenzione sull’espressione atomo composto e dice che essa è contraddittoria. L’osservazione di Fresenius motiva così la redazione del secondo quesito da proporre all’Assemblea: «L’espressione atomo composto può essere soppressa e sostituita da radicale o residuo?»
Kopp riprende in esame l’esposizione di Kekulé e richiama l’attenzione sulla definizione del termine equivalente. Gli sembra che la nozione di equivalente sia perfettamente chiara e si distingua nettamente da quella di molecola e di atomo. Per conseguenza la Commissione senza discussione approva il 3° quesito da proporre all’Assemblea: «La nozione degli equivalenti è empirica ed indipendente da quella di molecola e di atomo».
La seduta continua sotto la presidenza di Erdmann.
La discussione s’inizia sulla notazione. Kekulé fa notare che si può usare la notazione molecolare o atomistica o quella degli equivalenti, ma che in un sistema o l’altro è necessario attenersi rigorosamente e in modo conseguente alla notazione scelta. Sul significato del termine equivalente si fanno alcune osservazioni. Béchamps dice che non si può ammettere l’equivalenza che solo nel caso che le funzioni dei corpi siano identiche. Schischkoff non condivide questa opinione; egli pensa che la notazione di equivalenza e di quantità equivalenti sia indipendente dalle funzioni chimiche. Tutti ammettono una equivalenza fra il cloro e l’idrogeno. Dopo alcune osservazioni fatte sulla questione da diversi altri congressisti si toglie la seduta.
2a seduta del Congresso sotto la presidenza di Boussingault
Boussingault, nell’assumere la presidenza, ringrazia il Congresso per l’onore fatto ad uno scienziato, i cui studi, più che indirizzati a ricerche teoriche, hanno avuto per scopo argomenti di chimica applicata. Egli vede in questa nomina un legame fra ciò che si chiama antica e nuova chimica. Protesta però contro questa distinzione affermando che non invecchia la chimica, bensì i chimici. Annuncia che il lavoro della Commissione non è finito, per quanto essa sia accordata sulle tre questioni da sottoporre all’approvazione dell’Assemblea; pertanto invita uno dei segretari a riferire in merito.
Strecker dà lettura delle questioni redatte dalla Commissione. Kekulé sviluppa i punti indicati nella prima questione. Per ciò che concerne l’ipotesi fondamentale che si può fare sulla natura della materia, l’oratore si domanda se bisogna adottare l’ipotesi atomica e se ci si deve contentare di una ipotesi dinamica. A lui sembra preferibile la prima ipotesi. L’ipotesi di Dalton è verificata da ciò che si conosce sulla natura dei gas. Si è condotti ad ammettere nei gas delle piccole unità, dei piccoli individui e quando uno stesso corpo può presentarsi nello stato gassoso, liquido o cristallino è possibile che le molecole cristalline siano precisamente gli individui piccoli gassosi di cui si tratta o che questi siano frazione di quelli; ma la natura di queste relazioni non può essere precisata. È però certo che nelle reazioni chimiche esiste una quantità che entra e che ne esce nella proporzione più piccola e mai per una frazione di questa proporzione. Queste quantità sono le più piccole che possano esistere libere: sono le molecole definite chimicamente. Ma queste quantità non sono indivisibili, bensì le reazioni chimiche le conducono allo stato di particelle indivisibili. Queste particelle sono gli atomi. Gli elementi stessi, quando sono allo stato libero, hanno le molecole formate da atomi; così la molecola del cloro libero è formata da due atomi. Si è dunque condotti ad ammettere differenti unità molecolari e atomiche:
1) le molecole fisiche
2) le molecole chimiche
3) gli atomi
Ancora non è stato dimostrato che le molecole fisiche gassose siano identiche alle molecole fisiche liquide o solide. In secondo luogo, le molecole chimiche non è dimostrato che siano identiche alle molecole gassose. Così non è certo che la quantità più piccola di un corpo che prende parte ad una reazione sia la quantità più piccola di questo corpo che entra in gioco nei fenomeni termici.
Tuttavia ordinariamente bisogna dire che la molecola chimica è identica alla molecola gassosa. Si è pure preteso che la prima non rappresenti altro che la seconda. Per l’oratore non è così. La molecola chimica ha una esistenza indipendente, e per essere condotti alla distinzione precedente, bisogna dimostrare che in alcuni casi ciò si verifica. Non è dimostrato dalla densità di vapore del solfo, che le molecole chimiche non si separano sempre completamente le une dalle altre, ma in certe condizioni (500°) restano saldate per formare le molecole fisiche? L’oratore aggiunge che l’esistenza e la grandezza delle molecole chimiche possono e devono essere determinate con dimostrazioni chimiche e che i dati fisici non permettono di giungere a questo risultato, Per es., com’è possibile, con considerazioni puramente fisiche, dimostrare che l’acido cloridrico risulta formato da un solo atomo d’idrogeno e un solo atomo di cloro?
Non basterebbe moltiplicare la formula HCl per un certo coefficiente e fare lo stesso per le altre formule per stabilire una perfetta concordanza fra le proprietà fisiche?
Cannizzaro prende la parola per osservare che la distinzione tra molecole fisiche e chimiche non gli sembra né necessaria né stabilita chiaramente.
Wurtz è d’avviso che questo punto sia secondario; al contrario gli sembra che la questione relativa alla distinzione fra molecola e atomo sia giunta ormai a maturazione e tutti ammettono la necessità di tale distinzione. Si tratta di precisare il senso dei termini usati generalmente ed egli pensa che in una questione di questo genere si avrebbe convenienza e sarebbe utile che l’assemblea prendesse una decisione. Questa decisione non avrebbe naturalmente nulla di obbligatorio.
La discussione s’inizia sulla seconda questione relativa al termine «radicale composto». Miller pensa che il linguaggio scientifico non può fare a meno del termine atomo composto. Vi hanno atomi di corpi semplici e atomi di corpi composti.
Kekulé, Natanson, Strecker, Ramon de Luna, Nicklés, Béchamps fanno osservazioni in vario senso, ma la discussione sopra questa questione, come su quella precedente, non porta ad una deliberazione dell’assemblea.
2a seduta della Commissione sotto la presidenza di H. Kopp
Kekulé espone le sue idee sulla notazione chimica. Si deve osservare che si può impiegare o una notazione atomico-molecolare o una notazione in equivalenti. Nel primo caso, la formula chimica rappresenta la molecola, nel secondo l’equivalente. Questa distinzione si comprende con gli esempi seguenti:
Notazione atomico-molecolare |
Notazione in equivalenti |
HCl |
HCl |
H2Ɵ |
HO |
H3Az |
Haz. |
(dove H = 1, Ɵ = 16, Az = 14, az = 14/3). Ciò che importa è di non confondere, come usualmente si fa, queste due notazioni. Si confondono scrivendo l’acqua HO = 9 e l’ammoniaca H3Az = 17, ecc.
Cannizzaro insiste sull’importanza per la notazione delle considerazioni relative ai volumi. Gli argomenti sviluppati dall’oratore sono riprodotti in extenso nel rendiconto della 3a seduta del Congresso (v. oltre).
Il Presidente fa notare che la discussione si prolunga troppo e che nel seno della Commissione le questioni debbono essere accennate più che approfondite. Egli pensa che si può lasciar da parte la discussione relativa alla notazione in equivalenti, come viene formulata da Kekulé. Nessuno se ne serve. L’oratore crede conveniente non stare troppo attaccati alle questioni teoriche, toccando il fondo delle cose e attenersi a questioni di forma.
Opinioni analoghe vengono manifestate da diversi membri: particolarmente Erdmann fa notare l’urgenza di adottare una notazione tale che i simboli rappresentino un valore determinato e invariabile.
Riassumendo la discussione, il Presidente riconosce che, visti i recenti progressi della scienza, è probabile che debbano essere raddoppiati certi pesi atomici, ma che nella notazione in cui ci si serve di questi pesi raddoppiati, sarebbe utile aver riguardo alla notazione impiegata generalmente fin qui e non impiegare esattamente i simboli dell’ultima notazione rappresentando valori diversi. Pensa che sarebbe conveniente, come misura transitoria e per evitare confusione, adottare alcuni segni per indicare le differenze. Per conseguenza egli approva l’abitudine presa da alcuni chimici di sbarrare i pesi atomici doppi.
Terminando, egli formula la questione da proporre al Congresso nel modo seguente: «È desiderabile di mettere in armonia la notazione chimica coi progressi recenti della scienza raddoppiando un certo numero di pesi atomici».
3a seduta della Commissione sotto la presidenza di Dumas
Kekulé riassume la discussione della seduta precedente e riproduce in una forma alquanto mitigata la questione annunciata da Kopp. Secondo l’oratore questa questione si deve porre nel modo seguente: «I progressi recenti della scienza autorizzano un cambiamento della notazione, ecc.?»
Strecker propone di adottare come principio la notazione atomica.
Il Presidente insiste con calore sugli inconvenienti che risultano dalla confusione presente. Se questo stato di cose dovesse prolungarsi esso porterebbe nocumento non solo all’insegnamento e al progresso della scienza, ma anche alla sicurezza dei lavori industriali. Riportiamoci col pensiero, egli dice, a venti anni addietro. La tavola dei pesi atomici di Berzelius era insieme il fondamento della scienza intiera e la guida infallibile delle operazioni dell’industria. Niente sostituisce oggi questa autorità riconosciuta da tutti e bisogna provvedere a che la chimica non decada.
Wurtz è felice di riconoscere che Dumas ha posto la questione sul suo vero terreno e pensa che bisogna ritornare ai principi dei pesi atomici e della notazione di Berzelius. Piccoli cambiamenti nell’interpretazione di alcuni fatti sarebbero sufficienti, secondo l’oratore, per porre i principi di questa notazione in armonia con le esigenze della scienza moderna. La notazione che oggi conviene adottare non è quella di Gerhardt. Questi ha reso servizi immensi alla scienza. Egli è morto e il suo nome dev’essere pronunciato con rispetto. Ma sembra che questo chimico abbia commesso due errori: l’uno è relativo solamente alla forma, l’altro alla sostanza delle cose. Prima di tutto, invece di presentare la sua notazione come fondata su principi nuovi, egli avrebbe fatto meglio a riattaccarsi ai principi di Berzelius, e porre così la sua innovazione sotto l’autorità di questo grande. In secondo luogo, sembra che Gerhardt abbia commesso un errore raffigurando tutti gli ossidi della chimica minerale all’ossido di argento e all’ossido di potassio anidro, attribuendo come a questi ultimi, la formula
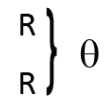
In chimica minerale debbono esservi degli ossidi corrispondenti all’ossido di etilene, come vi sono ossidi che i rappresentanti dell’ossido di etile e altri che corrispondono all’ossido di glicerile, e se l’idrato di potassio per es. può compararsi all’alcool, altri idrati debbono essere comparati al glicol e alla glicerina. Si comprende che queste considerazioni sono di natura tale da provocare e rendere legittimi alcuni cambiamenti nella notazione di Gerhardt e nei pesi atomici ch’egli attribuiva ad alcuni metalli.
Dopo una discussione alla quale prendono parte Cannizzaro, Wurtz e Kekulé questi emette l’opinione che il problema sia sufficientemente maturo per essere sottoposto alla decisione del Congresso e chiede che l’ufficio di Presidenza formuli la proposta. Il che viene approvato.
3a seduta del Congresso sotto la presidenza di Dumas
Assumendo la presidenza Dumas rivolge all’assemblea alcune parole di ringraziamento ed esprime la speranza che si giungerà ad un accordo sopra alcune delle questioni proposte al Congresso. In seguito propone Will e Miller come vice-presidenti. Odling sostituisce Roscoe come segretario. Si dà lettura delle questioni elaborate dalla Commissione, così concepite:
«È da desiderare di porre in armonia la notazione chimica coi progressi della scienza?»
«È conveniente adottare di nuovo i principi di Berzelius, per ciò che riguarda la notazione, apportando ad essi alcune modificazioni?»
«È da desiderare di distinguere, per mezzo di segni particolari, i nuovi simboli chimici da quelli che erano generalmente in uso una quindicina di anni or sono?»
Cannizzaro prende la parola per combattere la seconda proposizione. A lui sembra assai poco conveniente e poco logico far retrocedere la scienza fino ai tempi di Berzelius, per farle poi percorrere il cammino fatto fin qui. In effetti, al sistema di Berzelius sono state fatte successivamente delle modificazioni e queste modificazioni ci hanno condotto al sistema di formule di Gerhardt. Questi cambiamenti sono stati fatti come conseguenza di progressi successivi e non bruscamente. Se Gerhardt non li avesse proposti, ciò avrebbero fatto o Williamson od Odling oppure qualche altro chimico che avesse preso parte al movimento scientifico.
La sorgente a cui rimonta il Sistema di Gerhardt è la teoria d’Avogadro e di Ampère sulla costituzione uniforme dei corpi nello stato gassoso. Questa teoria conduce a considerare le molecole di alcuni corpi semplici come suscettibili di una ulteriore suddivisione. Dumas comprese l’importanza della teoria di Avogadro e la portata delle sue conseguenze. Egli pose questa questione: havvi un accordo fra i risultati della teoria di Avogadro e quelli che si deducono dagli altri metodi che servono a determinare i pesi relativi delle molecole? Accorgendosi della povertà della scienza in risultati sperimentali di questo genere, egli volle riunirne il numero maggiore possibile prima di giungere ad una conclusione generale sopra questo soggetto. Così, adoperando il suo metodo per la determinazione della densità di vapore, egli dette alla scienza risultati preziosi. Tuttavia, da questi risultati, sembra ch’egli non abbia tratto quella conclusione generale alla quale tendeva. Comunque, spetta a lui il merito di aver indirizzato i chimici sulla via della teoria di Avogadro, perché egli ha contribuito più che ogni altro a introdurre l’abitudine di scegliere per i corpi volatili formule corrispondenti allo stesso volume che occupano l’acido cloridrico e l’ammoniaca.
L’influenza della scuola di Dumas si nota nel modo più evidente in una memoria di uno dei suoi allievi, Gaudin. Questi accetta senza riserve la teoria di Avogadro. Egli ha stabilito una netta distinzione fra atomo e molecola, con la quale ha potuto conciliare i fatti con la teoria. Questa distinzione era già stata fatta da Dumas che, nelle sue lezioni di filosofia chimica, aveva denominata la molecola atomo fisico. Essa è certamente uno dei pilastri del sistema di Gerhardt.
Gaudin, più conseguente e più attaccato alla teoria di Avogadro che non lo fosse Gerhardt, profittando dei nuovi dati sperimentali sulle densità di vapore, stabilì che gli atomi non sono sempre la stessa frazione delle molecole dei corpi semplici; vale a dire che queste molecole non contengono sempre lo stesso numero di atomi; che, mentre la molecola dell’ossigeno, dell’idrogeno e degli alogeni è formata da 2 atomi, la molecola del mercurio contiene un solo atomo. Egli per dedurre la composizione relativa della loro molecola arrivò fino a comparare la composizione di volumi uguali di alcool e di etere. Ma il suo spirito da questo confronto non trasse tutte le conseguenze e i chimici hanno dimenticato la sua idea. E pertanto questo confronto è uno dei punti di partenza della riforma proposta da Gerhardt. Altri chimici, fra i quali si può citare Proust, accettarono la teoria di Avogadro e giunsero alle conseguenze generali alle quali era pervenuto Gaudin. In questo stato della scienza, che cosa ha fatto Gerhardt?
Egli accetta la teoria di Avogadro con la conseguenza della divisibilità degli atomi dei corpi semplici, egli applica questa teoria a dedurre la costituzione relativa delle molecole dell’idrogeno, ossigeno, cloro, azoto, acido cloridrico, acqua e ammoniaca. Se si fosse fermato qui, non sarebbe andato oltre Avogadro e Dumas. Ma egli sottopose ad un esame generale tutte le formule della chimica organica e si accorse che tutte quelle formule corrispondenti a volumi eguali di acido cloridrico e di ammoniaca erano confermate da tutte le reazioni e da tutte le analogie chimiche. Egli pensò allora di modificare le formule che facevano eccezione a questa regola famigliarizzata da Dumas. Egli pensò di dimostrare che le ragioni per le quali ci si era allontanati dalla regola dei volumi eguali non erano fondate. Il punto di partenza delle riforme proposte da Gerhardt fu quello di ridurre le formule di tutti i corpi volatili organici a volumi eguali. Come conseguenza di questo primo passo si ebbero le modificazioni dei pesi atomici di alcuni corpi semplici, la scoperta delle relazioni fra gli idrati, sia acidi che basici, con l’acqua. E che avvenne in seguito? Le esperienze memorabili di Williamson sull’eterificazione, sugli eteri misti, sui chetoni, quelle di Gerhardt sulle anidridi degli acidi, di Wurtz sui radicali alcoolici, ecc. confermarono successivamente ciò che Gerhardt aveva previsto come conseguenza del suo sistema. Così si ebbe in chimica qualcosa di analogo che in ottica, quando fu introdotta la teoria delle ondulazioni.
Questa teoria ha fatto prevedere con ammirevole esattezza i fatti che l’esperienza ha più tardi confermato. In chimica, il sistema di Gerhardt non è stato meno fecondo per l’esattezza delle previsioni. Esso è legato intimamente alla storia della scienza, ai lavori che lo hanno preceduto e ai progressi che lo hanno seguito. Non è un salto brusco, un fatto isolato: è un passo regolare in avanti, piccolo in apparenza, ma grande pei risultati. Ormai non si può eliminare questo sistema dalla storia della scienza; si può e si deve discuterlo e modificarlo, ma se vuole introdurre nella scienza un sistema di formule in accordo con lo stato attuale delle nostre conoscenze, bisogna prenderlo come punto di partenza. Alcuni sono forse tentati di dire: la differenza fra le formule di Gerhardt e quelle di Berzelius è piccolissima; per es., la formula dell’acqua è la stessa nei due sistemi. Ma bisogna stare attenti. In apparenza la differenza è piccola, ma in sostanza è grande. Berzelius era sotto l’influenza delle idee di Dalton. L’idea di una differenza fra l’atomo e la molecola dei corpi non è mai entrata nella sua mente. In tutti i suoi ragionamenti ammette implicitamente che gli atomi dei corpi semplici sono, rispetto alle forze fisiche, delle unità dello stesso ordine degli atomi composti. Per questa ragione ha cominciato con l’ammettere che volumi eguali contengono lo stesso numero di atomi. Presto si accorse che questa regola non poteva applicarsi che ai corpi semplici e durante la sua carriera scientifica, per scegliere le formule, non attribuì nessuna importanza agli atomi dei corpi composti. Pertanto fu obbligato a limitare la regola del numero eguale di atomi in volumi eguali ad un piccolo numero di corpi semplici, vale a dire a tutti quelli che sono gas permanenti, introducendo così nella costituzione dei gas e dei vapori una differenza che nessun fisico ha mai potuto ammettere. Berzelius non ammetteva che nella combinazione le molecole dei corpi semplici potessero dividersi, egli al contrario supponeva che spesso due molecole formano la quantità che entra intiera nel composto. È ciò che denominò atomi doppii. Così egli ammetteva che l’acqua e l’acido cloridrico contenessero la stessa quantità di idrogeno, quantità eguale a due molecole fisiche riunite.
Voi vedete dunque, Signori, quale profonda differenza esista fra le idee di Berzelius e quelle di Avogadro, Ampère, Dumas e Gerhardt. Io mi meraviglio che Kekulé abbia accettato la proposizione della Commissione, egli che nel suo trattato ha detto che Gerhardt è il primo e il solo che abbia compreso la teoria atomica.
Io credo di aver dimostrato, continua Cannizzaro, che bisogna prendere come punto di partenza di una discussione delle formule quelle di Gerhardt, ma non sostengo che bisogna accettarle tutte come sono state proposte. Anzi, alcuni anni fa, io ho cercato di apportarvi alcune modificazioni, in modo da evitare le incongruenze che mi sembrano esistere nel sistema di Gerhardt. Infatti, è curioso vedere come questo chimico ha rinnegato la teoria di Avogadro, dopo essersene servito come di base per le sue riforme. Ecco come si esprime: «Vi sono molecole con 1, 2 e 4 vol. come ve ne sono a 1/2, 1/3 e 1/4 di volume» (Comptes rendus des travaux de Chimie, anno 1851, pag 146). E continua così (pag. 147): «Ci si può forse meravigliare di vedermi sostenere questa tesi, dopo che io ho sempre raccomandato di seguire in chimica organica una notazione regolare, rappresentando tutti i corpi volatili con lo stesso numero di volumi, con 2 o con 4. I chimici che in ciò veggono due affermazioni contraddittorie, dimenticano che io non ho mai considerato il principio precedente come una verità molecolare, ma come una condizione necessaria per arrivare alla conoscenza di alcune leggi o di alcuni rapporti che una notazione arbitraria, o appropriata a casi particolari, lascierebbe sfuggire all’attenzione dell’osservatore».
Vi erano dei fatti che obbligavano Gerhardt a rinnegare la teoria di Avogadro, ma vi erano pure delle ipotesi gratuite. I fatti erano le densità di vapore dell’acido solforico monoidrato, dei sali ammonici e del percloruro di fosforo. Voi già sapete, Signori, che in occasione della pubblicazione della memoria di Deville sulla dissociazione termica di alcuni composti, ho cercato per primo d’interpretare il fatto di queste densità anormali, supponendo che questi corpi si raddoppino e che realmente nella determinazione di queste densità si pesa una mescolanza di vapori. Dopo di me, Kopp ha proposto indipendentemente la stessa interpretazione. Io non ripeterò qui gli argomenti che abbiamo esposti, favorevoli a questa interpretazione. Aggiungerò solamente che uno dei membri di questo Congresso mi informa che il punto di ebollizione dell’acido solforico è quasi costante a diverse pressioni, ciò che dimostra che si tratta non di punto di ebollizione, ma di decomposizione. Io sono convinto che altri fatti confermeranno l’interpretazione da noi data per le densità anormali e faranno così svanire i dubbi che alcuni scienziati sembrano ancora conservare in merito alla teoria di Avogadro. Ma indipendentemente dai fatti che ora ho esposto, vi erano pure delle ipotesi gratuite che avevano allontanato Gerhardt dalla teoria di Avogadro. Dimostrerò ora ch’è così.
Gerhardt ammetteva come una verità dimostrata che tutti i composti metallici hanno delle formule analoghe a quelle dei corrispondenti composti idrogenati. Ammesso ciò dà ai cloruri di mercurio le formule HgCl, Hg2Cl, supponendo che la molecola del mercurio libero sia formata da due atomi, come quella dell’idrogeno. Notiamo che le densità di vapore conducono a un risultato diverso. Infatti, per rappresentare la composizione di volumi eguali dai cinque corpi seguenti: idrogeno, acido cloridrico, mercurio, cloruro mercuroso, cloruro mercurico, avremo le formule seguenti:
H2, HCl, Hg2, Hg2Cl, Hg2Cl2
Facendo un confronto fra queste formule vediamo che nelle molecole del mercurio libero e dei suoi due cloruri esiste la stessa quantità di mercurio espressa da Hg2; che il cloruro mercuroso è analogo all’acido cloridrico, mentre il cloruro mercurico contiene nella sua molecola una quantità doppia di cloro. La stessa ragione che ci ha condotto a raddoppiare l’atomo di carbonio deve farci raddoppiare l’atomo di mercurio. Ciò equivale a dire che la quantità di mercurio espressa da Hg2 nelle formule precedenti, rappresenta un solo atomo.
In questo caso si vede che l’atomo è eguale alla molecola del corpo libero, che nei sali mercurosi questo atomo è l’equivalente di un solo atomo d’idrogeno, mentre nei sali mercurici è l’equivalente di 2 atomi d’idrogeno. In altri termini e per impiegare il linguaggio oggi usato, nei sali mercurosi il mercurio è monoatomico, nei sali mercurici è biatomico, come i radicali dei glicoli di Wurtz. È importante fare notare che raddoppiando il peso atomico del mercurio, come si è fatto pel solfo, si ottengono numeri che si accordano con la legge dei calori specifici. Ma se si raddoppia il peso atomico del mercurio, per analogia si è condotti a raddoppiare quelli del rame, zinco, piombo, stagno, ecc., in una parola si ricade nel sistema dei pesi atomici di Regnault, che concorda coi calori specifici, l’isomorfismo e le analogie chimiche.
Era cosa veramente spiacevole questo disaccordo fra il sistema di Gerhardt e la legge dei calori specifici e dell’isomorfismo. Esso in realtà aveva prodotto due chimiche diverse; una, che trattava dei corpi inorganici, attribuiva un grande valore all’isomorfismo; l’altra che studiava i corpi organici, non ne teneva alcun conto, di modo che lo stesso corpo poteva non avere la stessa formula in una o l’altra chimica. Questo disaccordo deriva dal fatto che il sistema di Gerhardt non era conseguente in tutte le sue parti, ma esso sparisce non appena si sopprimono le inconseguenze.
Le densità di vapore offrono il mezzo di determinare il peso delle molecole dei corpi, sia semplici, che composti. I calori specifici servono a controllare i pesi degli atomi e non quelli delle molecole. L’isomorfismo svela le analogie di costituzione molecolare.
A conferma della modificazione che ho proposto dei pesi atomici di alcuni metalli, citerò i fatti seguenti: tutti i composti volatili di mercurio, zinco, stagno e piombo contengono quantità di metallo rappresentate dalla notazione ordinaria da Hg2, Zn2, Sn2, Pb2. Questo fatto solo è sufficiente per indicare che queste quantità rappresentano i veri atomi dei metalli in questione. Si potrebbe pure citare il fatto che esistono tre ossalati di potassio e ammonio (radicali monoatomici), mentre esistono solamente due ossalati di bario e calcio (radicali biatomici). Ma per il momento, non insisto su questo punto e dall’altro lato non posso misconoscere che vi è un caso ove il peso atomico dedotto dal confronto delle composizioni molecolari è in disaccordo con quello che si dedurrebbe dal calore specifico. Questo caso è quello del carbonio. Probabilmente qui la legge dei calori specifici è annebbiata da altre cause che influiscono sul calore specifico.
Riassumendo, Signori, io propongo di accettare il sistema di Gerhardt prendendo in considerazione le modificazioni proposte per i pesi atomici di alcuni metalli e le formule dei loro sali. E se non possiamo essere d’accordo per accettare la base del nuovo sistema, evitiamo almeno di dare un giudizio contrario che, siatene certi, sarebbe senza risultato. Infatti non possiamo impedire che il sistema di Gerhardt non guadagni sempre più partigiani. Oggidì, esso è accettato dalla maggior parte dei giovani chimici, da quelli che prendono la parte più attiva al progresso della scienza. In questo caso, limitiamoci a stabilire qualche convenzione per evitare la confusione che risulta dall’impiego di simboli identici ai quali si attribuiscono valori diversi. Così, generalizzando una usanza già stabilita, si potranno, per rappresentare i pesi atomici doppi, accettare le lettere sbarrate.
Strecker dà alcuni chiarimenti sulla redazione della seconda proposizione sottoposta al Congresso. In essa dapprima si faceva il nome di Gerhardt, ma poi si sostituì a questo nome quello di Berzelius. L’oratore non è favorevole a questa opinione. Non gli pare necessario risalire fino a Berzelius, al quale si può rimproverare la mancanza di logica nella questione degli atomi e degli equivalenti. Ciò che è utile ed urgente è di migliorare ciò che esiste, tenendo conto dei progressi della scienza dopo Berzelius. Strecker aggiunge che le dottrine di cui è l’espressione il «sistema di Gerhardt» presentano dei vantaggi reali. Egli, d’ora in avanti, nelle sue Memorie, adotterà i nuovi pesi atomici, pur pensando che non è ancora venuto il momento di introdurli nell’insegnamento e nei libri elementari.
Kekulé condivide pienamente le opinioni espresse da Cannizzaro. Tuttavia gli sembra utile fare una riserva sopra un punto di dettaglio. Cannizzaro considera il cloruro mercuroso come HgCl (Hg = 200); a lui sembra più razionale considerarlo come un composto analogo al liquido degli olandesi, vale a dire come Hg2Cl2 (Hg = 200) e ammettere che nella vaporizzazione la molecola si scinda.
Will non vuole entrare nei dettagli delle questioni sottoposte al Congresso; si limita a far notare che bisogna procedere direttamente allo scopo. Questo consiste nel trovare una notazione chiara, logica, incapace di generare confusione nella mente di chi s’inizia allo studio delle formule e capace di esprimere, non solo i fatti associati dalla scienza, ma ciò che le scoperte apporteranno cotidianamente.
Erdmann propone di abbandonare le due prime questioni e di limitarsi alla discussione dell’ultima. Gli sembra difficile giungere ad un accordo su questioni di principio e soprattutto di imporre con un voto una notazione.
Wurtz fa notare che nessuno ha avuto l’idea d’imporre una opinione qualunque. Ci si trova in presenza di due specie di questioni di forma. Se le prime non sono ancora così sicure per affermarle con un voto, niente impedisce che ci si accordi e si voti sulle questioni di forma.
Hermann Kopp constata che le opinioni dei chimici sono divise in molti punti teorici. Queste differenze di opinioni sono in parte causate da malintesi, che possono essere tolti da una discussione.
Erlenmeyer propone che per esprimere i pesi atomici che rappresentano gli antichi equivalenti doppi ci si serva sempre dei simboli sbarrati.
L. Meyer fa notare che ciò sembra ormai acquisito, perché nessun ha fatto al riguardo obiezioni.
S’inizia una discussione fra vari membri sull’opportunità di esprimere un voto.
Cannizzaro è d’avviso ch’è inutile votare sulla terza questione.
Boussingault fa osservare che gli sembra difficile che si possa equivocare sul significato dei voti che può dare il Congresso; votando si esprime un desiderata e non s’impone a chicchessia l’opinione della maggioranza.
Will è dello stesso avviso.
Normandy fa osservare che gli scienziati che propongono di fare alcune riforme sulla notazione sono quelli che coltivano principalmente la chimica organica. Poiché non si è d’accordo su vari punti gli sembra prematuro di applicare alla chimica minerale principi che sono ancora in discussione.
Odling prende la parola in merito ai simboli sbarrati. Egli ricorda che furono introdotti da Berzelius per esprimere atomi doppi. La sbarra, egli dice, è dunque il segno di divisibilità e sembra contrario alla logica sbarrare i simboli che rappresentano gli atomi indivisibili dell’ossigeno e del carbonio.
Kekulé, pur accordando che gli atomi doppi di Berzelius avevano un significato diverso da quello degli atomi indivisibili di cui si è proposto di sbarrare i simboli, fa notare che questi simboli sbarrati debbono indicare, non la divisibilità degli atomi, ma la divisibilità del valore espresso da questi simboli e che è doppio di quello che prima si ammetteva.
In risposta alle osservazioni di Erdmann e Normandy, Kekulé aggiunge che nessuno può aver l’idea d’imporre una opinione teorica o una notazione con un voto, ma una discussione sopra questi argomenti è necessaria ed utile e non mancherà di dare i suoi frutti.
Il Congresso esprime il voto che s’introduca l’uso dei simboli sbarrati che rappresentano pesi atomici doppi di quelli che prima si ammettevano.
Dumas toglie la 3a ed ultima seduta del Congresso dopo aver espresso, a nome dell’Assemblea, la sua riconoscenza a S. A. R. il Granduca di Baden per l’ospitalità accordata.
[1] Rendiconto delle Sedute del Congresso Internazionale dei Chimici tenuto a Carlsruhe il 3 ,4, 5 Settembre 1860, Rivista di Chimica Scientifica ed Industriale 1930, 12-16; 41-46; 72-76.
[2] S. Cannizzaro, Notizie storiche e considerazioni sull’applicazione della teoria atomica alla chimica e sui sistemi di formule esprimenti la composizione dei composti, Gazz. Chim. It., 1871, 1, 1-33; 213-230; 293-314; 389-397; 567 -5 86; 629-683.
[3] L. Cerruti, Il luogo del «Sunto», in S. Cannizzaro, Sunto di un corso di filosofia chimica, Sellerio, Palermo, 1991, 207-214.
[4] A. Di Meo, Atomi e molecole fra storia, didattica e teoria, in S. Cannizzaro, La teoria atomica e molecolare, Edizioni Teknos, Roma, 1994, XXIV-XXIX.
[5] A. Gaudiano, Storia della Chimica e della Farmacia in Italia dalle più lontane origini ai primi anni del duemila, Aracne, Roma, 2008, 261.
[6] E. Torracca, Il periodo della chimica classica, in Storia della Chimica, dalla ceramica del neolitico all’età della plastica, A. Di Meo, Ed., Marsilio Editori, Venezia, 1990, 161-164.
[7] https://it.wikipedia.org/wiki/Congresso_di_Karlsruhe (ultimo accesso: 26 Giugno, 2023).
[8] A. M. Maggio, R. Zingales, Appunti di Storia della Chimica, Aracne Editrice, Roma, 2019, 275.
[9] L. Cerruti, Concordia discors. I chimici italiani dell’Ottocento, fra politica e scienza, in Chimica e le tecnologie chimiche nel Veneto dell’800, A. Bassani, Ed., Istituto veneto di scienze lettere ed arti, Venezia, 2001, 11-72.
[10] J. Solov’ev, L’evoluzione del pensiero chimico dal ’600 ai giorni nostri, Mondadori, Milano, 1976, 177.
[11] M. Ciardi, Il segreto degli elementi. Mendeleev e l’invenzione del sistema periodico, Hoepli, Milano, 2019, 51-55.
[12] R. Carpignano, Il chimico Michele Giua, una professione come etica, La Chimica e l’Industria, 2001, 83(3), 71-73.
[13] N. Nicolini, Michele Giua: libertà e morale di un chimico socialista, CnS, numero speciale: Fascismo, Chimica e Scienza, 2022, 91-99.