Il metodo didattico di Stanislao Cannizzaro
Roberto Zingales
Gruppo Nazionale di Fondamenti
e Storia della Chimica (GNFSC)
e-mail: robertozingales@outlook.it
Indice
2. La formazione chimica di Cannizzaro e il suo progetto didattico
Abstract. By analysing some Stanislao Cannizzaro’s papers and conference texts, it can be shown the way in which he taught atomic theory, which he considered the turning point in XIX century Chemistry.
Keywords: Cannizzaro; ipotesi di Avogadro; teoria atomica; didattica
Il chimico palermitano Stanislao Cannizzaro (1826-1910) è noto e stimato in tutto il mondo per la sua attività di ricerca, la sua capacità organizzativa e, soprattutto, per il suo contributo determinante alla risoluzione del problema dei pesi atomici e molecolari. Meno studiata, ma non per questo meno significativa, è stata la sua attività didattica (Tabella 1), nella quale profuse la stessa cura e attenzione dedicate agli altri aspetti della sua vita professionale.
|
Tabella 1. Curriculum didattico di Cannizzaro |
||
|
1845-1847 |
Università di Pisa |
Preparatore straordinario nel Laboratorio di Chimica |
|
1851-1855 |
Collegio Nazionale di Alessandria |
Professore di Fisica, Chimica e Meccanica Lezioni pubbliche serali di Chimica e Meccanica elementare |
|
1855-1861 |
Università di Genova |
Professore di Chimica |
|
1861-1872 |
Università di Palermo |
Professore di Chimica Organica e Inorganica |
|
1872-1909 |
Università di Roma |
Professore di Chimica Organica |
Non avendo mai prodotto un libro di testo convenzionale, l’impostazione e i contenuti delle sue lezioni possono essere dedotti da alcuni suoi articoli e testi di conferenze sull’argomento, molti dei quali sono stati ristampati di recente (Tabella 2) [1].
|
Tabella 2. Elenco dei testi esaminati |
||
|
Anno |
Titolo |
Forma |
|
1858 |
Lezioni sulla teoria atomica |
Pubblicazione su Liguria medica [2] |
|
1858 |
Sunto di un Corso di Filosofia chimica |
Pubblicazione su Il nuovo Cimento [3] |
|
1860 |
Intervento al Congresso di Karlsruhe [4] |
|
|
1872 |
Considerations on some points of the theoretic teaching of Chemistry |
Faraday Discussion [5] |
|
1875 |
Discorso di apertura della Classe III del I Congresso della Società Italiana per il Progresso delle Scienze |
Pubblicato su Gazzetta Chimica Italiana [6] |
|
1891 |
Discorso ai colleghi dell’Università di Roma |
Pubblicato postumo su Rassegna Contemporanea [7] |
|
1895 |
Appunti di lezione redatti da Umberto Neyroz |
ASPI, Archivi on line [8] |
Da essi è possibile capire quali preoccupazioni suscitasse in lui il dover insegnare agli allievi una scienza in continua evoluzione e, per questo, ancora afflitta da grossi equivoci di fondo. Non potendo ricostruire l’esatto ordine con il quale Cannizzaro esponeva i diversi argomenti, per le evidenti discrepanze tra questi testi, si cercherà di individuarne i capisaldi e la strategia didattica generale.
2. La formazione chimica di Cannizzaro e il suo progetto didattico
Pur avendo frequentato per tre anni la Facoltà Medica dell’Università di Palermo, Cannizzaro non si laureò mai, né in Medicina, né in Chimica; tuttavia, negli anni tra il 1845 e il 1847, ebbe l’opportunità di svolgere un efficace tirocinio chimico nel laboratorio di Raffaele Piria, all’Università di Pisa, e di completare poi la propria formazione teorica e sperimentale, nel laboratorio di Chevreul, durante il suo breve esilio a Parigi.
A metà Ottocento, la Chimica stava vivendo il suo periodo di massima evoluzione e il suo carattere eminentemente progressivo [5] implicava un continuo ampliamento delle conoscenze e una continua revisione di ipotesi e teorie, che costringevano gli addetti ai lavori a un aggiornamento costante che, secondo Cannizzaro, doveva estendersi anche ai discenti, a dispetto dei problemi che tutto ciò comportava.
Alla fine del Settecento, le lezioni di Chimica consistevano ancora in un’elencazione (verosimilmente noiosa e, comunque, difficile da memorizzare) di svariati fatti, nozioni, ricette di natura empirica, privi di una visione d’insieme che li collegasse e li razionalizzasse, e di quel fondamento matematico che, secondo Kant, era il requisito essenziale perché una disciplina acquisisse lo status di Scienza [9]. Tuttavia, grazie all’approccio rivoluzionario di Lavoisier, che aveva posto le determinazioni quantitative alla base della ricerca scientifica, e alla scoperta di leggi empiriche ben fondate su fatti sperimentali, come quelle degli equivalenti, delle proporzioni costanti e multiple e dei volumi gassosi, all’inizio dell’Ottocento, la Chimica si era trasformata in una scienza ben fondata su basi numeriche, che esprimeva i fatti sperimentali con un linguaggio e un simbolismo semplici e non equivoci, attraverso formule ed equazioni chimiche.
Anche gli insegnanti dovevano adeguarsi riflettendo su cosa e quanto trasmettere agli studenti alle prime armi di una disciplina nella quale regnava ancora tanta confusione, soprattutto nell’interpretazione dei fatti e nella formulazione delle teorie. Ancora, negli anni ’60 dell’800, in Francia, l’autorevole chimico Jean-Baptiste Dumas invitava i soci dell’Accademia a pronunciarsi su quali forme dovesse assumere l’insegnamento [10].
Cannizzaro era ben consapevole di tutto ciò e, sin dall’inizio della sua carriera di insegnante, si pose il problema di come trasmettere agli allievi, sin dalle prime lezioni, rigore, chiarezza e semplicità concettuale. Poiché era evidente che questo era possibile solo a condizione che il docente per primo avesse le idee chiare sugli argomenti che esponeva a lezione, iniziò una profonda riflessione su quale fosse il metodo migliore per avvicinare i discenti alla Chimica.
Durante la sua attività di preparatore a Pisa, si era reso conto dell’enorme valore didattico delle dimostrazioni pratiche svolte durante le lezioni frontali, tanto è vero che, in tutte le sedi nelle quali insegnò, chiese sempre di poter disporre di aule attrezzate per le dimostrazioni sperimentali e laboratori didattici per gli studenti. Tuttavia, era anche ben consapevole del fatto che un corso di lezioni, impostato soltanto sugli enunciati delle leggi chimiche, la descrizione degli esperimenti e le dimostrazioni pratiche, senza una teoria chiara e semplice, che li spiegasse, li collegasse e li razionalizzasse, rischiava di restare monco e poco comprensibile. Questa non poteva essere che la teoria atomico-molecolare, che non solo aveva interpretato e armonizzato le leggi empiriche già individuate, ma aveva contribuito a farne scoprire delle altre, rendendo più chiari e accessibili, anche ai chimici professionisti, i concetti fondamentali della Chimica e più comprensibile il linguaggio, giustificando l’origine, il significato, il valore e l’uso delle formule grezze e delle equazioni.
Cannizzaro, però, voleva che gli studenti accettassero la teoria atomica non in maniera acritica, come un fatto assodato, ma attraverso un percorso logico induttivo, rigidamente basato sulla descrizione degli esperimenti e sull’interpretazione dei risultati, lungo il quale lui stesso li accompagnava, presentando fatti e ipotesi nel loro succedersi cronologico: in altre parole, attraverso la Storia della Chimica. Queste convinzioni lo portarono sempre a prestare la massima cura all’organizzazione e alla preparazione delle proprie lezioni e a non tralasciare nessuna occasione per discutere, con i colleghi italiani e stranieri, non solo la validità della teoria atomico-molecolare, cercando di prevenirne e superarne obiezioni e resistenze, ma anche quale dovesse essere l’impostazione da dare alle lezioni di Filosofia chimica (cioè di quelle teorie che cercavano di interpretare, spiegare e prevedere i fatti chimici).
3. L’impostazione e il contenuto delle lezioni
Iniziata la sua carriera d’insegnante nel 1851, già nel 1858, a Genova, Cannizzaro aveva pubblicato due articoli, intitolati Lezione sulla teoria atomica [2] e Sunto di un corso di filosofia chimica [3], nei quali mostrava che tipo di impostazione intendesse dare alle proprie lezioni. Mentre, nel secondo, svolgeva dettagliatamente gli argomenti delle sue prime otto lezioni (Tabella 3), nel primo esponeva soltanto i contenuti della prima lezione, che divideva in tre parti: la prima era dommatica, nel senso che dava per accertata la natura corpuscolare della materia, nella seconda anticipava gli argomenti della lezione (Tabella 4) e nella terza esaminava la genesi e lo sviluppo della teoria dei gas.
|
Tabella 3. Elenco delle prime otto lezioni riportate nel Sunto [3] |
|
|
Lezione 1 |
Descrizione delle proprietà dei gas |
|
Lezione 2 |
Ragioni del rifiuto dell’ipotesi di Avogadro e Ampère |
|
Lezione 3 |
Rassegna delle indagini fisiche sul comportamento dei gas |
|
Lezione 4 |
Rassegna delle teorie chimiche dopo Berzelius |
|
Lezione 5 |
Applicazione dell’ipotesi di Avogadro e Ampère |
|
Lezione 6 |
Esame della composizione delle molecole dei cloruri; uso della legge dei calori specifici |
|
Lezione 7 |
Studio dei radicali composti |
|
Lezione 8 |
Confronto del comportamento dei diversi radicali metallici |
|
Tabella 4. Punti salienti della prima lezione, illustrati nell’articolo su Liguria Medica [2] |
|
|
1 |
Come dedurre i pesi relativi delle molecole, sia semplici che composte |
|
2 |
Come determinare, da questi pesi, i pesi relativi dei loro elementi costituenti (legge degli atomi) |
|
3 |
Come scoprire la legge fondamentale che regola i rapporti di combinazione dal rapporto tra le quantità di ciascun elemento, che entrano nel corpo semplice e nei suoi composti |
|
4 |
Come esprimere le formule dei corpi semplici e composti, utilizzando i pesi atomici, rappresentati dai simboli chimici |
Queste variazioni nell’impostazione e nella successione degli argomenti sono presenti anche negli altri articoli, per cui qui si cercherà di evidenziare quelli che per lui costituivano i punti salienti delle lezioni, gli argomenti ai quali attribuiva carattere fondamentale e propedeutico al resto del corso, facendo riferimento soprattutto alla Faraday Lecture [5], tenuta dopo un ventennio di esperienza in classe, durante il quale Cannizzaro avrà certamente avuto modo di rielaborare la propria strategia didattica e di verificarne le ricadute sugli studenti.
Sin dalle prime lezioni, puntava al cuore del problema che, ancora a fine anni ’50 dell’800, continuava a travagliare i chimici: il disaccordo tra le diverse tabelle dei pesi atomici. In particolare, i valori ottenuti con un approccio fisico, dal confronto tra le densità delle sostanze gassose, risultavano differenti da quelli ottenuti con un approccio chimico, attraverso la composizione percentuale delle sostanze solide [11]:
… quando dovevo esporre le così dette generalità della Chimica, ero tormentato da alcune contraddizioni che vi erano nelle applicazioni delle teorie atomiche e molecolari, dalla discrepanza nei concetti direttivi della Chimica inorganica e di quella detta organica.
Il non essere riusciti a risolvere queste discrepanze aveva portato i chimici ad accantonare il problema, rassegnandosi a distinguere l’atomo fisico da quello chimico, e a usare due scale differenti di pesi atomici, in chimica organica e in chimica inorganica. Sebbene assolutamente insoddisfacente, questa soluzione sembrava l’unica praticabile e rischiava di essere sancita nel Congresso di Karlsruhe [4]. Cannizzaro rifiutò l’una e l’altra distinzione, perché aveva capito che i due approcci sperimentali non erano in conflitto, anzi, potevano e dovevano essere armonizzati, se si voleva arrivare alla soluzione del problema dei pesi atomici [11]:
… Stimolato e sospinto dal desiderio di sbrogliare questa matassa ai miei allievi, io mi misi a percorrere passo a passo tutta la storia della dottrina … e così potei scoprire la cagione delle contraddizioni e discrepanze e il modo di eliminarle introducendo alcune modificazioni nel sistema dei pesi atomici e delle formule allora in uso.
Un corso di Filosofia chimica tradizionale avrebbe dovuto iniziare con l’enunciato del principio di conservazione della massa, formulato da Lavoisier, evidenziando come esso fosse indipendente da qualunque ipotesi sulla natura, continua o discontinua, della materia e inducendo gli allievi a considerare materia tutto ciò che è ponderabile, a interpretare le sue trasformazioni semplicemente come aggiunta o sottrazione di oggetti ponderabili, a identificare il peso dei reagenti e quello dei prodotti come l’aspetto essenziale dello studio delle reazioni e a considerare come accessorie, sia le indicazioni sul loro stato fisico che sul loro volume. Una volta recepito, questo aspetto essenziale dei fenomeni chimici costituiva una base solida sulla quale poggiare nuove informazioni, non altrettanto generali o non comprese e dimostrate con la stessa certezza.
Invece, Cannizzaro preferiva spingersi ancor più indietro, fino a Galilei e Torricelli, che aveva determinato il peso dell’aria, e poi Boyle, Amonton e Gay-Lussac che avevano quantificato l’elasticità dei gas (compressibilità ed espansibilità), che risultava uniforme per tutti, a prescindere dalla loro differente identità e comportamento chimico, per arrivare al fondamentale punto di snodo, costituito dall’ipotesi di Avogadro e di Ampère, che lui considerava la base di partenza per mettere chiarezza nei concetti di atomo e molecola, ancora troppo confusi all’interno della comunità scientifica [12]:
Io credo che i progressi della scienza, fatti in questi ultimi anni, abbiano confermato l’ipotesi di Avogadro, di Ampère e di Dumas sulla simile costituzione dei corpi allo stato aeriforme, cioè che i volumi eguali di essi, sieno semplici, sieno composti, contengono l’ugual numero di molecole; non però l’ugual numero di atomi, potendo le molecole dei vari corpi e quelle dello stesso corpo nei vari suoi stati, contenere un vario numero di atomi, sia della medesima natura, sia di natura diversa.
L’incipit del Sunto, sopra riportato, metteva subito in chiaro il suo pensiero:
- l’ipotesi di Avogadro è corretta e va applicata anche ai fenomeni chimici, come le reazioni tra sostanze gassose, nelle quali Gay-Lussac ha individuato la semplicità dei rapporti tra i volumi;
- essa è corretta solo se è applicata alle molecole e non agli atomi, perché i gas reali sono costituiti da molecole e non da singoli atomi;
- le molecole elementari non costituiscono il limite ultimo della divisibilità chimica, perché sono costituite da più atomi eguali, che possono separarsi nel corso delle reazioni chimiche.
Cannizzaro, non solo sanciva la differenza tra atomo e molecola, ma, soprattutto, ne ribaltava le gerarchie, anteponendo le molecole agli atomi sul piano concettuale e la determinazione dei pesi molecolari a quella dei pesi atomici, su quello sperimentale [13]:
… invece di partire dai criteri chimici per determinare i pesi delle molecole e dimostrare in seguito la loro proporzionalità alle densità gassose, io parto da quest’ultima proposizione, che è la teoria di Avogadro, Ampere, Krönig e Clausius, dimostrandola colle considerazioni fisiche; fondo su di essa la dimostrazione di limiti di divisibilità dei corpi semplici, cioè dell’esistenza degli atomi elementari; prendo le occasioni a misura che si presentano per dimostrare che i pesi delle molecole e i numeri di atomi che vi sono contenuti, dedotti dall’applicazione di questa teoria, sono d’accordo co’ criteri introdotti da Williamson …
Esponeva poi la teoria atomica di Dalton, conducendo gli allievi a rendersi conto da soli [14]:
… dell’arbitrio che v’ha nella scelta dei pesi molecolari dei composti, del numero degli atomi elementari contenutovi, e de’ pesi attribuiti a ciascuno di questi ultimi, non disponendo d’altri dati sperimentali, se non della composizione ponderale de’ corpi. … Sarà facile convincerli che queste difficoltà sarebbero eliminate, se si disponesse di controprove de’ pesi delle molecole. …
A questo punto, riprendeva l’ipotesi di Avogadro, per raggiungere due obiettivi: 1) mettere a punto un metodo certo per la determinazione dei pesi molecolari; 2) interpretare la legge di Gay-Lussac in termini molecolari e determinare la composizione atomica delle molecole elementari.
Data per corretta l’ipotesi di Avogadro, come mostrato schematicamente in figura 1, nelle stesse condizioni di temperatura e pressione, volumi eguali di gas differenti contenevano lo stesso numero di molecole. Perciò, confrontare volumi eguali significava confrontare il peso di un egual numero di molecole e, quindi, determinare il rapporto tra i pesi di due singole molecole.

Figura 1. Rappresentazione schematica del principio di Avogadro [15]
Allora, il confronto tra i pesi di volumi eguali di un qualunque gas e di quello preso come riferimento avrebbe dato il peso molecolare relativo di quel gas. Se era scontato scegliere, come termine di riferimento, l’idrogeno, il gas più leggero tra quelli noti, non altrettanto banale era la scelta del valore numerico convenzionale da attribuire al suo peso molecolare.
Dal punto di vista concettuale, era naturale attribuire valore unitario al peso dell’unità di riferimento; tuttavia, dall’interpretazione microscopica della legge di Gay-Lussac, Cannizzaro ricavava la dimostrazione della differenza tra atomo e molecola e l’indizio, già colto da Avogadro e altri dopo di lui, che la molecola di idrogeno fosse costituita da due atomi eguali, che potevano separarsi nel corso delle reazioni.
Come schematizzato in figura 2, se un volume di idrogeno si combinava con un egual volume di cloro per dare due volumi di acido cloridrico, questo risultato imprevisto implicava chiaramente che, per ottenere una molecola di acido cloridrico bastava che si combinassero mezza molecola di idrogeno e mezza molecola di cloro; e se due volumi di idrogeno si combinavano con uno di ossigeno per darne due di vapor d’acqua, ne derivava che una molecola di idrogeno si combinava con mezza molecola di ossigeno per darne una di vapor d’acqua.
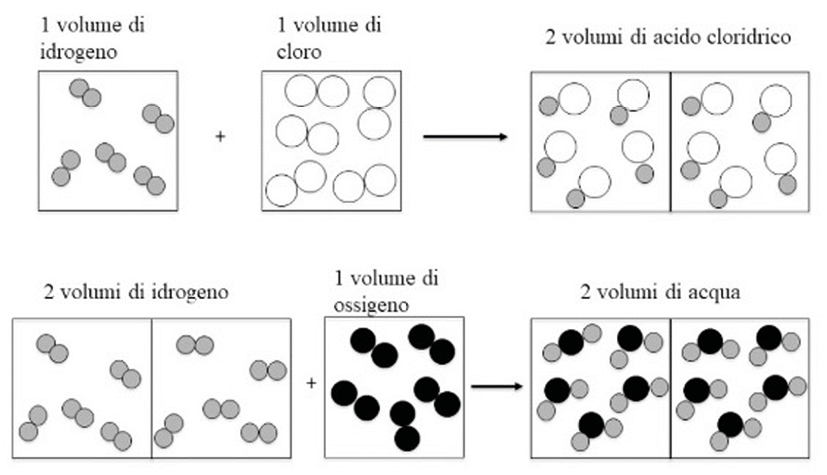
Figura 2. Rappresentazione schematica della legge di Gay-Lussac [15]
Per questo, pur utilizzando la molecola d’idrogeno come termine di riferimento dei pesi molecolari, attribuì il valore unitario alla sua metà, perché era la quantità più piccola che contribuiva al peso molecolare delle sostanze contenenti idrogeno, come, per esempio, l’acido cloridrico. Non ancora pronto a dare la definizione di atomo [16], nel Sunto Cannizzaro usava estesamente il termine mezza molecola, inaccettabile ai chimici, che ritenevano la molecola elementare una particella ultima, e possibile fonte di confusione per gli studenti, ai quali chiedeva di accantonare temporaneamente la teoria di Dalton e seguirlo nel ragionamento che avrebbe sviluppato subito dopo.
Coloro che avevano attribuito valore 1 al peso di un volume di idrogeno, pur avendo ottenuto pesi corretti per le molecole di ossigeno, azoto, alogeni, che ritenevano monoatomiche, nel caso di tutte le molecole volatili delle sostanze composte, avevano ricavato valori dei pesi molecolari doppi di quelli corretti e, quindi, formule molecolari doppie, come già messo in evidenza da Gerhardt. Invece, attribuendo valore 2 al peso del volume di riferimento dell’idrogeno, si ottenevano, per i pesi molecolari di tutte le altre sostanze gassose, semplici o composte, valori congrui con quelli ottenuti attraverso altre procedure sperimentali (Figura 3) [17].
Così, le formule dei composti erano associate a numeri concreti (i pesi di volumi eguali di gas diversi), più semplici da maneggiare, rispetto a quel sistema di uno, due o quattro volumi, che si era cercato di introdurre, aumentando la confusione, a discapito della comprensione. Per Cannizzaro, era fondamentale che gli studenti comprendessero la concretezza reale di questi pesi molecolari, perché, in mancanza di qualsiasi informazione sulle proprietà degli enti microscopici (atomi, molecole), riteneva che al chimico non restasse altro che muoversi sul piano macroscopico, affidandosi a grandezze che, come il peso, potevano essere misurate.
L’aver utilizzato l’approccio fisico per ottenere valori corretti dei pesi molecolari, poneva Cannizzaro in una posizione di vantaggio rispetto a coloro che non lo avevano voluto accettare o prendere in considerazione. La procedura da lui messa a punto per determinare i pesi atomici, utilizzando, come Dalton, Berzelius e tanti altri, i parametri chimici ottenuti dai rapporti di combinazione e dalla composizione percentuale delle sostanze, era semplice, anche se concettualmente densa di significato.
Invitava gli studenti a scegliere un elemento e a considerare il maggior numero possibile dei suoi composti ottenibili nello stato aeriforme, dei quali erano noti i valori di densità, e quindi i pesi molecolari. Combinando questi pesi con la loro composizione percentuale, ottenuta dall’analisi chimica quantitativa, gli studenti potevano determinare il peso di ciascun elemento presente in una quantità dei suoi composti pari al loro peso molecolare, cioè quanti grammi di esso erano presenti in una molecola del composto.
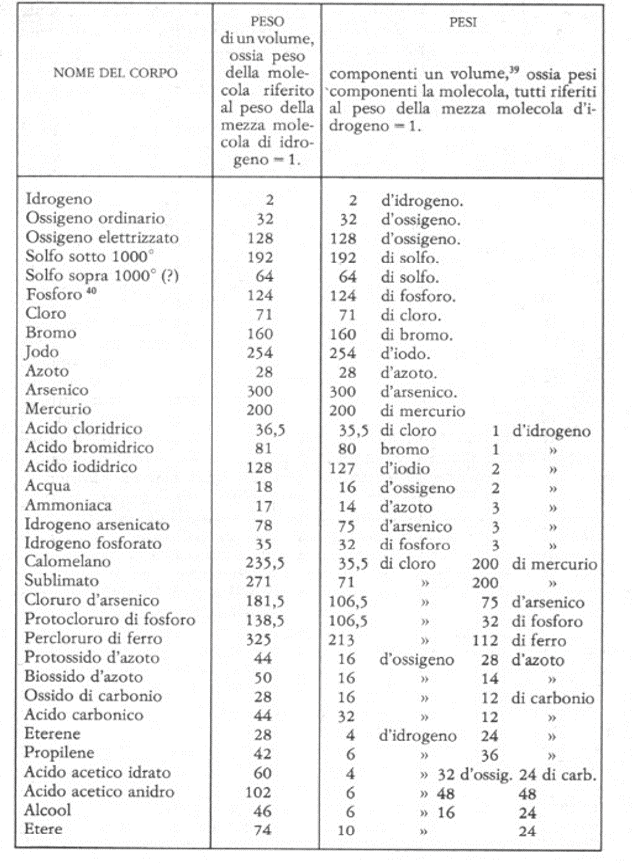
Figura 3. Pesi molecolari ottenuti dal confronto delle densità gassose
In figura 4 sono riportati i risultati per alcune molecole contenenti idrogeno, ossigeno e cloro, comprese quelle elementari [18]. Esaminando con attenzione questi risultati, gli studenti dovevano accorgersi che, in ciascuna tabella, l’elemento selezionato era presente con pesi differenti, ma tutti multipli interi del più piccolo di essi. Questo valore minimo era 1 per l’idrogeno, 16 per l’ossigeno, 35,5 per il cloro, non divisibile, perché partecipava una, o più volte al peso totale delle molecole, ma mai con valori intermedi, cioè con multipli non interi della quantità più piccola, per cui Cannizzaro concludeva [19]:
La legge degli atomi si rivela allora da se stessa. I pesi di ciascun elemento che entrano nelle molecole che lo contengono, sono sempre multipli interi d’uno stesso peso; si chiama atomo questa quantità minimum che entra sempre intera nelle molecole.
Fornì, così, una definizione macroscopica dell’atomo, e, nello stesso tempo, un criterio esatto per la determinazione dei pesi atomici.
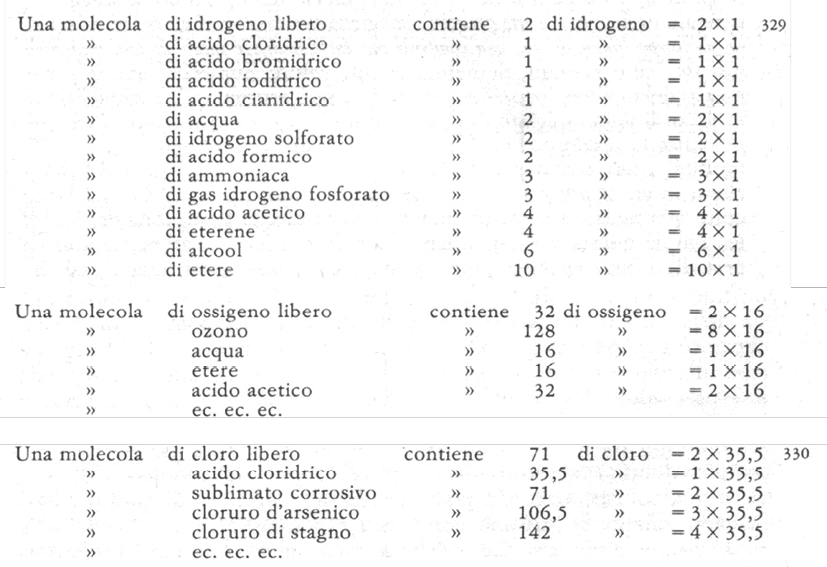
Figura 4. Determinazione dei pesi atomici di idrogeno, ossigeno e cloro
A differenza di quelli che Dalton aveva ricavato da un’ipotesi non dimostrata, questi pesi atomici erano il risultato del trattamento di dati sperimentali, mediante una procedura che, esaminato un numero sufficientemente ampio di composti, metteva al riparo dal pericolo di ottenere valori contrastanti, multipli o sottomultipli di quello corretto. Dalton aveva avuto a disposizione un numero di relazioni (i rapporti tra i pesi di combinazione) inferiore a quello delle incognite (la composizione atomica e i pesi atomici). Cannizzaro aveva aumentato il numero delle equazioni indipendenti nelle stesse incognite, perché, grazie al principio di Avogadro, poteva correttamente paragonare i pesi di uno stesso numero di molecole di gas diversi. Quegli stessi atomi che per Dalton erano espressione dei rapporti dei pesi di combinazione degli elementi, per Cannizzaro indicavano anche la composizione di volumi eguali di gas [20]:
Ecco gli atomi di Dalton, che esprimono non solo i rapporti tra i pesi degli elementi che si combinano, …, ma anche la composizione di volumi gassosi eguali. … Gli atomi dei diversi elementi hanno pesi differenti. Ciò risulta direttamente dalle cifre date dall’esperienza; ma non è questa un’ipotesi preconcetta.
Questo concetto di atomo era tanto svincolato da quello di molecola da consentire, per esempio, di determinare il peso atomico del carbonio, senza conoscere quello della sua molecola (Figura 5) [20].

Figura 5. Determinazione del peso atomico del carbonio
Il risultato più sorprendente era la scoperta che la molecola dell’elemento libero poteva contenere un numero di atomi diverso da uno: due quelle di idrogeno, ossigeno, cloro, quattro quelle di fosforo e arsenico, uno quelle di mercurio e cadmio. Avogadro e Gaudin erano giunti all’ipotesi della biatomicità della molecola d’idrogeno per spiegare la legge dei volumi di Gay-Lussac, Cannizzaro come conseguenza della legge degli atomi. In questo modo era chiarita anche la differenza tra atomo e molecola: questa era la più piccola particella di una sostanza che era possibile trovare in Natura, che era composta da due o più atomi, uguali o diversi, che erano le più piccole particelle di un elemento che entravano a far parte delle molecole dei suoi composti, ma non necessariamente capaci di esistere non combinati.
Grazie a questa esposizione graduale e progressiva di fatti e ragionamenti, gli studenti erano in grado di dedurre, in termini chiari, netti, coordinati e incatenati, questa differenza e quella tra i pesi corrispondenti.
Cannizzaro poteva quindi introdurre il linguaggio delle formule, che finalmente erano piene di significato, perché gli studenti erano in grado di associare spontaneamente i simboli chimici agli atomi e ai loro pesi, e le formule grezze al numero di atomi contenuti nelle molecole e al loro peso totale, in modo che anche il linguaggio diventava un potente strumento conoscitivo [16], perché associava i fatti sperimentali (pesi molecolari e atomici) alla loro interpretazione (molecole e atomi).
Piuttosto che dover ricorrere, come aveva fatto Dumas, a indici frazionari per indicare il numero di molecole elementari contenute in una sostanza e rappresentare, per esempio, la molecola di acido cloridrico come composta da mezza molecola di idrogeno e mezza di cloro, era molto più conveniente affermare che essa conteneva un atomo di cloro e uno di idrogeno.
L’esistenza degli atomi era dedotta come una vera legge, e, per evitare il circolo vizioso di fondarla sul concetto di molecola, bastava sostituirlo con quello dei volumi eguali [21]:
… l’atomo è la quantità costante di un elemento che entra per multipli interi in volumi gassosi eguali dei composti.
La sola proprietà che fosse intimamente legata al concetto di atomo era perciò la massa, la definizione stessa della materia. La definizione concettuale di Dalton era così integrata da una definizione operazionale, più utile ai chimici e quindi più facilmente accettabile: svincolato da ogni immagine di forma, grandezza, distanza, continuità o discontinuità, l’atomo non era altro che un peso costante che costituiva per multipli interi (e mai sottomultipli) i composti chimici e prendeva parte, quantitativamente inalterato, alle reazioni chimiche [21]. I fisici non riuscirono a chiarire la struttura delle particelle elementari fino al XX secolo, i chimici a metà dell’800 avevano perfettamente identificato e caratterizzato gli enti invarianti – qualitativamente e quantitativamente – nelle reazioni chimiche.
Una volta che gli studenti si erano impadroniti consapevolmente dei concetti di molecola e atomo, Cannizzaro passava a discutere i metodi sperimentali per determinarne i pesi, esaminandone i punti deboli e segnalando la necessità di ricorrere a metodi ausiliari, come il calore specifico, l’isomorfismo o le analogie, dei quali verificava i risultati alla luce del principio di Avogadro e della teoria cinetica di Clausius. Infine, esaminava quei vapori che, subendo parziale dissociazione, costituivano una sfida alla teoria atomico-molecolare, e per i quali era più complicata la determinazione dei pesi molecolari.
Cannizzaro era fermamente convinto che la teoria atomico-molecolare potesse risolvere i problemi che, al presente o in futuro, si sarebbero potuti presentare al chimico, o che essa stessa avrebbe messo in evidenza, e citava esplicitamente quelli della valenza (atomicità), della disposizione spaziale degli atomi, della conservazione dell’energia. Rimaneva, però, all’insegnante il problema di come affrontare questi argomenti sui quali, per mancanza di risposte sicure e sperimentalmente convalidate, non c’era certezza.
Come Dumas, Cannizzaro non approvava la facile soluzione di limitarsi a ignorarli, come se non esistessero, ritenendo che gli studenti, lasciati da soli ad affrontarli, si sarebbero smarriti, arrivando a conclusioni fondate sulla fantasia, piuttosto che su salde evidenze sperimentali. Né voleva che dessero per certe le cose che erano solo probabili e come noto ciò che si ignorava, ma cercava di tenerne sotto controllo la fantasia, lasciandoli liberi di formulare, sulla base delle proprietà chimiche e fisiche, differenti ipotesi sulla costituzione atomica e molecolare della materia, per sottoporle tutte al vaglio della ragione, valutare la differente attendibilità delle varie ipotesi, e arrivare alla conclusione che ad atomi e molecole non si potesse legare nessun altro attributo che non fosse la massa.
Riconosceva l’importanza della teoria della valenza, che si andava consolidando in quegli anni, perché includeva parecchie leggi parziali, faceva risultare relazioni importanti, consentiva di coordinare e prevedere con sufficiente sicurezza un gran numero di fatti sperimentali e perché avrebbe contribuito a far luce sulla maniera con la quale gli atomi si legano. Tuttavia, era ancora in fase di evoluzione e lasciava aperte certe questioni come, per esempio, se l’atomicità di un elemento fosse determinata e costante o potesse variare secondo determinate regole. Per evitare che gli studenti fossero indotti a estrapolazioni non giustificate dai risultati sperimentali, suggeriva agli insegnanti di mostrarne sempre ben presente la genesi storica e l’evoluzione, per capire a quale fase dello sviluppo fosse giunta [22]:
Bisogna soprattutto evitare che gli allievi si facciano della valenza degli atomi un concetto fisico e geometrico; bisogna ricordare a essi sovente che i fatti chimici non dimostrano e non contraddicono nulla sulla grandezza, la forma, la continuità, la distanza e la disposizione relativa degli atomi.
La necessità di andare oltre l’aspetto ponderale delle particelle e farsene immagini spaziali non nasceva, secondo Cannizzaro, dall’esigenza di rendersi conto dei fenomeni chimici, ma di interpretare quelli fisici [22]:
Se qualche volta siamo obbligati a usare l’espressione posizione relativa degli atomi nelle molecole e di rappresentare queste posizioni con figure schematiche, bisogna sottolineare che questi sono artifici utilizzati per esprimere con il linguaggio della vista ciò che noi percepiamo solo attraverso le trasformazioni, anche se ignoriamo completamente cosa corrisponda a ciò che chiamiamo posizione, sia nello spazio che nelle trasformazioni della materia.
Questo sembrava in contrasto con i tentativi di definire la struttura delle molecole organiche, portati avanti in quegli anni dai suoi più stretti collaboratori, Körner e Paternò. Il fatto che Cannizzaro non li ostacolasse, ma ne sollecitasse e favorisse la divulgazione delle idee, mostra la sua grandezza di scienziato e di Maestro e come non intendesse negare ai chimici il diritto di formulare ipotesi e di verificarle sperimentalmente. Diverso doveva essere l’atteggiamento degli insegnanti, ai quali chiedeva di evitare di presentare come definite ipotesi ancora da confermare [22]:
Io non credo che sia conforme allo stato attuale della scienza di affrettarsi sin dal principio di un corso di Chimica a definire la valenza degli atomi come proprietà a essi inerente, per dedurne poscia, per così dire a priori, e come corollari, i loro differenti modi di collegamento.
Nel sito dell’Archivio storico della Psicologia italiana (ASPI), sono pubblicate le carte di Umberto Neyroz (1877-1927), psicologo infantile e pedagogista, raccolte dalla moglie Vittorina Lamieri, e rese disponibili dal nipote Carlo, biochimico. Tra queste ci sono alcuni quaderni relativi ai corsi della Facoltà di Medicina e Chirurgia di Roma, redatti tra il 1895 e il 1901. In due quaderni separati, sono raccolti, in due parti, indicate con i numeri I e III, le lezioni di Chimica Generale, tenute da Cannizzaro, nel 1895. Siamo, quindi, indotti a supporre l’esistenza di una parte II, verosimilmente perduta durante la Seconda Guerra Mondiale o il successivo incendio, che hanno distrutto parte dell’archivio.
Dopo un’introduzione a carattere storico, le lezioni della parte I trattano la descrittiva di alcuni elementi non metallici, mentre la parte III è dedicata ai metalli. La grafia ordinata e l’assenza di cancellature fanno pensare che queste pagine siano state ricopiate dagli appunti presi in aula, probabilmente senza cambiare l’ordine con il quale gli argomenti erano stati svolti da Cannizzaro. Anche se un’analisi corretta dei contenuti del corso è compromessa dalla mancanza di una parte di esso, intermedia a quelle sopra descritte, qualche considerazione può essere sviluppata.
L’esame della prima parte mostra come Cannizzaro non seguisse il percorso tracciato nel Sunto, ma piuttosto quello illustrato nella Faraday Lecture del 1872; iniziava il suo excursus storico partendo da Galilei e Torricelli, fino a Dalton, attraverso Boyle, Black, Priestley, Lavoisier, Gay-Lussac, seguendo il filo degli studi sulle sostanze gassose, delle loro proprietà fisiche e del loro comportamento chimico, riconoscendole come uno degli stati di aggregazione della materia. In accordo con la teoria dinamica del calore di Laplace, attribuiva i cambiamenti di stato al maggiore o minore grado di forza viva da cui erano animate le molecole dei corpi, del quale il calore era una conseguenza. Seguiva un richiamo a Lavoisier, del quale descriveva la teoria della combustione, in opposizione a quella del flogisto, la legge di conservazione della materia, la spiegazione dei fenomeni chimici in termini di unione o separazione di sostanze, la distinzione tra corpi semplici e composti, tra ossidi acidi, basici o indifferenti. Terminava con la legge dei rapporti costanti, la teoria atomica di Dalton, il concetto di peso atomico e la legge delle proporzioni multiple.
A meno che non fosse nella parte mancante, contrariamente a quanto ci aspetteremmo, non c’è un capitolo espressamente dedicato all’ipotesi di Avogadro-Ampère, alla determinazione dei pesi molecolari, all’atomicità delle molecole elementari, alla differenza tra atomo e molecola, alla determinazione dei pesi atomici e alla legge degli atomi, insomma ai capisaldi del Sunto. Piuttosto, questi argomenti erano trattati all’interno di altri, opportunamente scelti da Cannizzaro. Per esempio, dimostrava la biatomicità delle molecole di idrogeno e ossigeno sotto la voce acqua [23]:
Con un ragionamento analogo, sapendosi che in un volume di vapor acqueo c’è un intero volume di H e mezzo di O e che nei composti che fa l’H non vi è mai meno di mezzo volume, si capisce che anche la molecola dell’H è sdoppiabile e che quindi rappresentando con H l’atomo, H2 ne sarà la molecola. Dunque quando l’H e l’O si combinano per formare l’acqua avremo:
|
O2 |
+ |
2 H2 |
= |
2 H2O |
|
1 volume di ossigeno |
2 volumi di idrogeno |
2 volumi di vapor acqueo |
Riporta l’esistenza della più piccola quantità di un elemento che entra intera o per multipli interi nei suoi composti alla voce cloro [24]:
In tutti i composti contenenti H la quantità di H è sempre eguale o multiplo intero di volte della quantità contenuta nell’HCl, questa quantità è dunque la più piccola particella di H combinabile, cioè l’atomo.
Infine, dà la definizione di peso atomico nella parte III, alla fine del capitolo sui metalli alcalini [25]:
Il peso atomico di un elemento è quel numero che rappresenta una quantità che entra sempre intera nella costituzione del peso della molecola dei composti di quel tale elemento che si considera. Necessario è dunque determinare il peso molecolare dei composti e quindi il peso atomico degli elementi.
Sull’evidente difformità tra il progetto didattico dettagliatamente esposto nel Sunto e la sua attuazione pratica a quasi 40 anni di distanza, si possono solo fare congetture. Troppo accurata e meticolosa è l’esposizione degli argomenti nel Sunto per giustificarne l’accantonamento con un ripensamento maturato nel corso degli anni, anche come conseguenza dell’esperienza fatta in classe. Forse, Cannizzaro usava il Sunto per rivolgersi ai colleghi chimici, cercando di vincere le loro resistenze con la logica stringente delle proprie argomentazioni e l’abbondanza di esempi portati come prova. E, infatti, il Sunto fu distribuito ai congressisti di Karlsruhe, con un impatto notevole sui chimici europei. La veste didattica con la quale Cannizzaro aveva presentato le proprie argomentazioni era forse un escamotage per non contrariare Piria che, da un lato, lo sollecitava a una maggiore produttività scientifica, dall’altro sconsigliava di pubblicare articoli a carattere esclusivamente teorico [26]. Tuttavia, le motivazioni di Cannizzaro erano, a suo dire, principalmente didattiche [27]:
Le cose contenute in quel libretto [Sunto] non furono pensate e scritte col proposito di contribuire al progresso della scienza, ma furono il frutto degli studi da me fatti per esporre chiaramente ai miei allievi le dottrine fondamentali della Chimica.
Come già detto, agli studenti Cannizzaro non voleva esporre teorie avulse dai risultati sperimentali e, per questo, inseriva i concetti fondamentali della Chimica all’interno della descrizione delle proprietà e del comportamento delle sostanze. Questa ipotesi è suffragata da Luigi Francesconi (1864-1939), suo allievo a Roma [28]:
La parte teorica riguardante i pesi molecolari ed atomici, …, tutti questi argomenti egli trattava via via che andava sviluppando i metalloidi e solo quando i giovani avevano acquistato la conoscenza dei corpi e dei fenomeni sui quali si basano i suddetti capitoli della chimica generale.
Onde il suo corso poteva, a prima, vista, apparire disordinato, ma per chi lo seguiva da principio era sommamente attraente ed efficace.
A conclusione di questo rapido esame dell’approccio didattico di Cannizzaro, si può osservare come il suo intento non fosse quello di far mostra di sé, ma di condividere con gli studenti tutto ciò che aveva appreso e continuava ad apprendere. Non si contentava di instaurare un semplice rapporto trasmittente-ricevente, né che essi si limitassero a un apprendimento mnemonico, ma si preoccupava di fornir loro tutti gli strumenti utili a costruire autonomamente il loro patrimonio culturale, indipendentemente da quali sarebbero stati i loro futuri interessi e le loro future professioni. La sua preoccupazione era quella di formare una nuova classe di professionisti, abituati a pensare con la propria testa e ad analizzare razionalmente problemi e situazioni, prima di prendere decisioni.
Nel caso specifico della Chimica, riteneva importante tenere gli studenti aggiornati sui continui progressi di questa scienza, sviluppando in loro l’attitudine e la preparazione necessarie a seguire gli ulteriori progressi della scienza e le sue trasformazioni, ma questo non significava evitare di mostrar loro quali fossero i cardini fondamentali della disciplina, prima fra tutti la teoria atomico-molecolare, e come il chimico la dovesse utilizzare per interpretare e razionalizzare tutti i fatti sperimentali. Proprio per costruire la loro professionalità, non intendeva imporre dogmaticamente nessuna legge o teoria, ma voleva che essi raggiungessero autonomamente le stesse conclusioni cui era pervenuta la scienza, attraverso un processo logico induttivo, che si intersecava di continuo con lo sviluppo storico dei fatti e delle idee.
Tutto ciò, spesso, non era conforme a ciò che osservava intorno a sé a fine carriera: molti giovani professori, lasciandosi trascinare dal desiderio di essere concisi e di rendere la materia accessibile alle menti meno preparate, esponevano dogmaticamente in un ordine sintetico tutte le leggi e tutte le teorie, nascondendone la genesi, senza distinguere il grado di confidenza che poteva essere accordato a ciascuna di esse, mentre altri eludevano il problema, tacendo sulle leggi e sulle teorie, sebbene poi ne utilizzassero i dettagli [29]:
Si convincano anche [i giovani insegnanti] che nello stato attuale della Chimica … non vi è migliore modo di fare la critica delle varie ipotesi in corso e dei vari concetti in discussione che l’indagarne l’origine e seguirne l’evoluzione. La storia esatta delle dottrine chimiche è la sola che può farne apprezzare al giusto il valore nella fase che attraversa attualmente la chimica.
Cannizzaro teneva anche un occhio rivolto al futuro, e senza sbilanciarsi su ipotesi non ancora consolidate, non voleva negare la solidità del concetto macroscopico di atomo che i chimici avevano adottato, anche grazie al suo contributo, come protagonista indivisibile delle trasformazioni chimiche, e che avrebbe resistito all’individuazione delle particelle subatomiche da parte dei fisici, avvenuta dopo la sua morte (1910) [30]:
Insisto adunque sull’utilità di liberare nell’insegnamento la teoria chimica molecolare e atomica da tutto ciò che non è suggerito direttamente dai fatti sui quali essa si fonda. In questa maniera si conserverà alla teoria tutta la plasticità necessaria per piegarsi e adattarsi ai progressi, alle evoluzioni dei nostri concetti fisici e matematici. Se si giungerà, ad esempio, a farsi della materia un concetto affatto differente da quello che oggi si ha, si troveranno le spiegazioni di ciò che noi chiamiamo atomi e molecole, ed avendo fatto una volta la traduzione di queste parole nelle nuove teorie, si continuerà ad impiegarle, come si è continuato ad impiegare le espressioni di calor latente, capacità pel calore, ecc.
[1] L. Paoloni ed., S. Cannizzaro, Scritti di storia politica e chimica, Quaderni del Seminario di Storia della Scienza, Facoltà di Scienze, Università di Palermo, 1995, n° 5.
[2] S. Cannizzaro, Lezioni sulla teoria atomica, Liguria Medica, 1858, n. 5 e 6, in rif. [1], 169-193.
[3] S. Cannizzaro, Sunto di un corso di filosofia chimica fatto nella R. Università di Genova. Lettera al Prof. S. De Luca, Nuovo Cimento, 1858, 7, 321 -3 66; ristampato da Sellerio Editore, Palermo, 1991.
[4] C. A. Wurtz, Account of the Sessions of the International Congress of Chemists in Karlsruhe, on 3, 4 and 5 September 1860, in M. J. Nye, The Question of the Atom, Tomash Publishers, Los Angeles, 1984, 5-30.
[5] S. Cannizzaro, Considerations on some Points of the Theoretic Teaching of Chemistry, Journal of the Chemical Society, 1872, 10, 941-967; vedi anche: S. Cannizzaro, Sui limiti e sulla forma dell’insegnamento teorico della Chimica, in rif. [1], 195-225.
[6] S. Cannizzaro, Discorso di apertura della Classe III del I Congresso della Società Italiana per il progresso delle Scienze (XII Congresso degli Scienziati Italiani), Gazzetta Chimica Italiana, 1875, 5, 354-371; vedi anche rif. [1], 226-250.
[7] S. Cannizzaro, La Scienza e la Scuola, Rassegna contemporanea, 1910, III, n° 9; vedi anche rif. [1], 259-261.
[8] U. Neyroz, Lezioni di Chimica Generale del prof. S. Cannizzaro, in Archivio Storico della Psicologia Italiana, ASPI, Archivi on line, Carte di Umberto Neyroz, https://www.aspi.unimib.it/collections/object/detail/1778/.
[9] S. Cannizzaro, rif. [6], 249.
[10] J. B. Dumas, Comptes Rendus, 1876, 64, 856.
[11] S. Cannizzaro, rif. [7], in L. Paoloni, rif. [1], 259.
[12] S. Cannizzaro, rif. [3], p. 321; nella ristampa, 21.
[13] S. Cannizzaro, rif. [1], 203-204.
[14] S. Cannizzaro, rif. [1], 209.
[15] A. M. Maggio, R. Zingales, Appunti di Storia della Chimica, Aracne, Roma, 2019, 244.
[16] L. Cerruti, note al Sunto, rif. [1].
[17] S. Cannizzaro, rif. [3], p. 327; nella ristampa, 26.
[18] S. Cannizzaro, rif. [1], pp. 329-330; nella ristampa, 27.
[19] S. Cannizzaro, rif. [5], 216.
[20] S. Cannizzaro, rif. [3], p. 332; nella ristampa, 29.
[21] S. Cannizzaro, rif [5], 217.
[22] S. Cannizzaro, rif. [5], 222-223.
[23] U. Neyroz, rif. [8], foto 23, p. 41.
[24] U. Neyroz, rif. [8], foto 43-44, pp. 81-82.
[25] U. Neyroz, rif. [8], foto 90, p. 24.
[26] S. Cannizzaro, Sulla vita e le opere di Raffaele Piria, Loescher, Torino, 1883.
[27] S. Cannizzaro, rif. [7], in rif. [1], 259.
[28] L. Francesconi, Il Maestro, in S. Cannizzaro, Scritti vari e lettere inedite nel centenario della nascita, Tipografia Leonardo da Vinci, Roma, 1926, 101-109.
[29] S. Cannizzaro, rif. [7], in rif. [1], 260.
[30] S. Cannizzaro, rif. [5], 218.